局部枸橼酸抗凝在肾脏替代治疗中应用的数学建模与临床验证
赵文彪 盛阮妹 陈建勤 戴珍娟 王学敏
肾脏替代治疗(renal replacement therapy, RRT)是重症医学科医师抢救危重症患者的重要治疗手段。局部枸橼酸抗凝(regional citrate anticoagulation, RCA)具有可减少机体炎症反应发生、出血风险小、不引起血小板减少等诸多优点[1-2]。然而,RCA操作的复杂性及其引发的多种并发症阻碍了该药物在临床上的广泛应用[3]。采用RCA的RRT患者因使用无钙置换液和非蛋白结合钙的大量流失[4],易在治疗过程中发生低钙血症。
在RRT的操作中,应用RCA有2个关键点,分别是确定补钙速度和输注枸橼酸钠的速度,其受RRT模式、参数设置、置换液钙水平、患者血钙水平和血细胞比容(HCT)[5]的影响。由于缺乏可靠的算法,目前只能通过频繁测定血浆和滤器后离子钙(iCa)水平来调整钙和枸橼酸钠的输注速率(该方案简称试错法)。试错法增加了临床医疗开支和医师的工作负荷,患者亦难以接受反复抽血;而以监测管路动脉端iCa水平来替代体内iCa水平,则因再循环影响可导致监测结果与实际水平产生较大误差。试错法还可能造成补钙与失钙的失衡,致使一些长期使用RCA的患者发生骨质疏松[6],甚至骨折[7]。
在本研究中,本团队建立了一种新型模拟RCA过程的一室模型,根据模型构建了全新的RCA通用算法。通过与传统的试错法进行了初步比较,以评估在不调整RCA期间补钙速率的情况下,该算法对患者血钙水平的影响,为研制自动化的RCA设备提供理论基础。
1 对象与方法
1.1 研究对象 收集2020年7—10月于上海交通大学医学院附属松江医院急诊科和重症医学科行血液透析滤过的20例患者资料。纳入标准:年龄>18岁;急性肾损伤需行RRT;适合采用血液透析滤过模式。排除标准:肝损伤;体重<45 kg;孕妇。采用区组随机化法将患者随机分至算法组和试错法组,每组10例。本研究经医院医学伦理委员会审核、批准(201907),并在中国临床试验注册中心完成注册(ChiCTR2000029527)。患者及其亲属均签署知情同意书。
1.2 血液透析滤过方案 研究中采用的血液净化设备为Prismaflex(瑞典金宝公司)或Aquarius(德国爱德华生命科学有限公司)。抗凝采用4%枸橼酸钠从滤器前滴入,补钙采用10%葡萄糖酸钙从外周静脉单独输注。无钙置换液含钠124 mmol/L,钾4.3 mmol/L,镁0.83 mmol/L,氯112 mmol/L,碳酸氢盐16 mmol/L,糖7.4 mmol/L。操作前测定患者的血钙水平和HCT,确定目标血钙值(CaTarget)。根据临床需要设定血流量(QB),净超滤量,前、后置换液量。算法方案的枸橼酸钠和葡萄糖酸钙的输注速率分别见式(1)、(3)、(4),试错法方案的枸橼酸钠和葡萄糖酸钙的输注速率方案分别为QB×2%和QB×2%×6.1%。两种RCA方案的枸橼酸钠和葡萄糖酸钙输注速率的调整方案见表1。

表1 两种RCA方案中枸橼酸钠和葡萄糖酸钙输注的调整方案
1.3 观察指标 RCA期间每隔1~2 h测定废液量和废液中总钙浓度,以及滤器后iCa水平;采集患者动脉血测定体内血钙和血iCa水平。iCa水平测定采用Cobas b 123血气分析仪(瑞士罗氏诊断有限公司);血钙水平由医院检验室测定。计算钙输入值,等于单位时间内输入的葡萄糖酸钙与置换液中钙之和减去废液中的钙。
1.4 RCA算法
1.4.1 数学模型 建立一室模型,以模拟钙在滤器中混合、稀释和丢失的过程(图1)。血液滤过时,血液与前置换液在滤器中混合,其中非蛋白结合钙(CaProt)可自由通过滤膜进入废液;血液透析和血液透析滤过时,血液虽不直接与透析液混合,但是血液中的非CaProt可自由通过滤膜进入透析液,因此把血液和透析液视为同处一室。模型假设非CaProt水平可以在滤膜的两侧达到平衡。

Cit为枸橼酸;CaCit为枸橼酸钙图1 RCA一室模型
1.4.2 枸橼酸钠输注方程 本研究采用一种新型的Cit需求量计算方法,根据滤器中钙的含量来计算所需的枸橼酸钠剂量,以适应含钙置换液的使用。以单位时间内滤器中血液、前置换(或透析液)中钙的含量之和乘以系数(kCit):
(1)
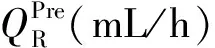
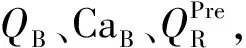
kDis
(2)
式中,kDis表示滤器中非CaProt的比例,本研究中此值预设为0.85或0.90。
钙丢失量等于废液中的钙减去置换液中的钙。为了计算钙需要量,以CaTarget代替CaB:
(3)

由于实际CaB与CaTarget不同,因此由式(3)计算出来的补钙量与实际失钙量有个差值(QDiff)。本研究分别将CaB和术前CaB代入式(3),并相减:
QDiff=QCa(Target)-QCa(B)

(4)
为了减少RCA初期血iCa波动,以及快速纠正患者术前异常血钙,设定RCA第1小时补钙速度为QCa+3×QDiff,第2小时为QCa+2×QDiff,第3小时为QCa+QDiff,第4小时起皆为QCa。
1.4.4kDiskDis表示非CaProt的比例,这部分钙能够通过滤膜[4, 8]。可以根据式(2),以及测定血浆和废液中的钙来计算实际的kDis值。计算CaEff,应用每隔1~2 h收集的废液中的钙水平代替。每例次的kDis值等于每个时间点计算得到的kDis值的均值。
2 结 果
2.1 基线资料和临床特征比较 两组患者一般资料比较的差异均无统计学意义(P值均>0.05或0.01)。见表2。

表2 两组患者基线资料和临床特征 (N=10)
APACHE Ⅱ为急性生理与慢性健康评分系统
2.2 不同RCA方案对血钙和滤器后iCa水平的影响 在RCA期间,算法组有2例患者,试错组有8例患者的血iCa水平为0.8~<0.9 mmol/L,两组患者构成比的差异有统计学意义(P=0.007)。算法组无患者血iCa水平<0.8 mmol/L,而试错法组则有3例<0.8 mmol/L,两组患者构成比的差异无统计学意义(P=0.060)。算法组有2例,试错法组有1例患者的滤器后iCa水平>0.4 mmol/L,两组患者构成比的差异无统计学意义(P=0.531),两组均无外循环功能障碍发生。试错法组8例患者需要调整补钙速率,每例需调整2~4次;算法组则无患者需额外调整补钙速率,两组间的差异有统计学意义(P=0.001)。
以式(3)计算的QCa=100%为标准,试错法组的初始钙输注速率偏低,经过多次调整后,治疗后期钙输注速率>QCa值;而算法组除了前3 h按照公式设定的速率高于QCa外,其后钙输注速率均近似等于QCa(图2)。
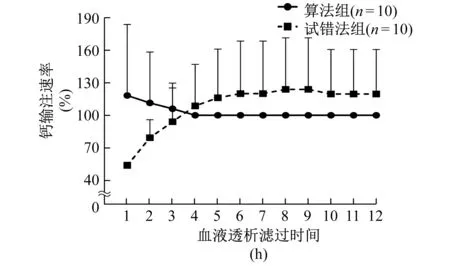
钙输注速率为相对值,以实际速率除以对应参数下的QCa值的百分比表示图2 两组钙输注速率比较
2.3 血钙和iCa水平、钙输入值变化 本研究中患者治疗前血钙水平为1.47~3.36 mmol/L,将每组患者按照治疗前血钙水平分为<2.0 mmol/L(低钙血症)、2.0~2.4 mmol/L(正常血钙)和>2.4 mmol/L(高钙血症)3个亚组。算法组高钙血症患者在RCA初期血钙水平快速下降,低钙血症患者则快速上升,其后3个亚组血钙变化趋于平稳,并向靶目标水平趋近(图3A)。该组3个亚组患者的iCa水平变化也呈类似趋势(图3B)。算法组低钙血症患者起始钙输入值为正值,而高钙血症患者则为负值,并逐渐向零轴靠近(图3C)。试错法组的3个亚组患者,均在治疗开始后第1小时出现血钙水平明显下降,其后因为不断调整补钙速率,血钙水平逐渐上升(图3D),iCa水平变化趋势亦类似(图3E)。试错法组的钙输入值,无论低钙还是高钙血症患者,起始皆为负值,随后低钙血症和正常血钙患者钙输入值在干预下大幅升高(图3F)。RRT期间算法组患者总钙输入值与患者治疗前钙水平呈负相关(图4A)。试错法组患者的总钙输入值亦与治疗前血钙水平呈负相关(图4B)。算法组的kDis值为0.91±0.08。

A 算法组血钙水平 B 算法组iCa水平 C 算法组钙输入值 D 试错法组血钙水平 E 试错法组iCa水平 F 试错法组钙输入值图3 两组患者血钙、iCa水平和钙输入值的亚组分析
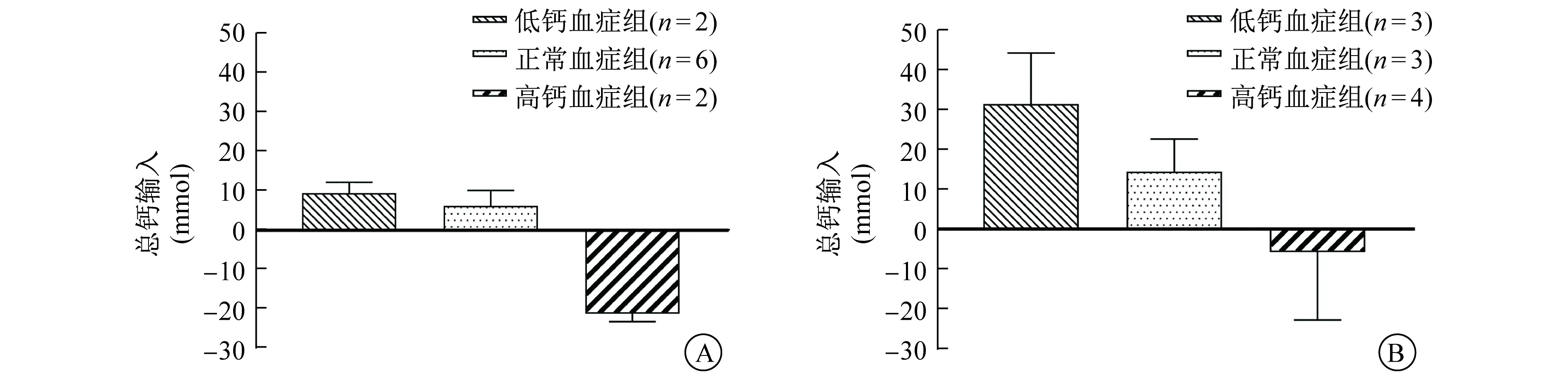
A 算法组总钙输入值 B 试错法组总钙输入值图4 两组总钙输入值变化的亚组分析
3 讨 论
RCA期间钙流失量显著增加,易导致低钙血症。由于缺乏实时、准确计算RCA时补钙量的方法,医务人员通常通过频繁测定血iCa水平来调整补钙速率。研究者设计了多种数学模型和方程来指导RCA操作[9-12],并在临床上进行了部分验证[4,13-15]。一些医药公司也已开发相关软件。近年来,连续性肾脏替代治疗(CRRT)设备多附带RCA算法模块[8, 16]。然而, 当前的算法在应用和推广上仍有诸多限制,且仍需在RCA过程中干预补钙速率。本研究构建了一种计算RCA期间钙和Cit需要量的通用算法,即在RCA期间无需人为干预补钙速率即可维持患者的血钙平稳。
本算法适用于各种含钙置换液,但因本研究所采用的试错法方案仅适用于无钙置换液,故本研究采用无钙置换液。试错法根据血液中的iCa水平来调整补钙速率,而iCa受多种因素影响,纠正了iCa水平并不意味着补充了足够的钙[17]。失钙量和总钙量,并非与iCa水平相关[8]。
许多接受RRT的患者术前即有血钙水平异常,RCA过程中不仅要补充丢失的钙,还应纠正异常的初始血钙水平。方程采用靶目标血钙浓度代替实际血钙浓度来估算补钙量,当实际血钙水平低于靶目标水平时,补钙量将超过失钙量;当实际血钙水平高于靶目标水平时,补钙量将低于失钙量。该方案可以自动纠正异常的血钙,并将其波动值维持在一个较小的范围内。此外,在RCA的前3 h,本研究给予了一个额外的补钙量QDiff,以避免RCA初期iCa水平的明显下降[4, 13],并缩短纠正血钙水平异常所需的时间。对于严重低钙血症患者,该算法指导下RCA初期血钙水平将快速上升,而对于高钙血症患者,QDiff将为负值,减少初期补钙量。
滤器内的钙丢失量是计算RCA期间补钙量的重要依据,而kDis是计算补钙速率的重要参数。在RCA期间,滤器中的钙在Cit的螯合作用下,与蛋白质解离并通过滤膜是一个动态的过程。当部分钙通过滤膜后,一室内非CaProt水平降低将促使更多的CaProt解离[8]。以往的研究[4]显示,静态时非CaProt的比例为0.87,而kDis值可能与其有所差异。根据本研究结果显示,影响kDis的因素与RRT模式和置换液中钙水平相关。kDis值设置误差会引起钙靶目标值与实际值的偏差。
传统的方法是根据预设的滤器前血Cit水平,或者直接以QB乘以一个固定的比值来确定所需的枸橼酸钠剂量,目前的计算方法(包括试错法)仅适用于无钙置换液。Cit和钙不能自由进入红细胞[5],以QB代替血浆流量,对于治疗前存在明显HCT异常的患者,可能会导致较大的计算偏差。本研究发现,以Cit与钙比值为目标参数,较Cit水平更好地控制了iCa水平,在此基础上,本研究提出了根据滤器中总的钙含量来计算所需的Cit量的观点。
本研究在使用无钙置换液的血液透析滤过中验证了本团队首创的新算法,初步评估了新算法对于患者血钙影响的安全性。然而,本研究纳入的病例数较少,故该算法的适用性仍需进一步验证。
综上所述,本团队建立了一种模拟RCA的一室模型,构建了相应的数学方程,并制订了新的RCA补钙剂量调整方案。该方案以RCA过程中无需干预补钙速率为目标,这将极大地减少医疗监测负担,并提高患者的治疗满意度。该算法在不同RRT模式、参数设置、置换液种类和患者血钙水平中的适用性,以及应用的安全性和有效性,仍有待更大样本量的研究进一步验证。

