Koenigs-Knorr糖基化反应的研究进展
田思思
(天津大学 药物科学与技术学院,天津 300072)
糖,又称为碳水化合物,广泛存在于生物体内、各种天然产物和药物分子中。其中单糖是组成多糖和天然产物中糖组分的最基本单元,通式为Cn(H2O)n。而寡糖与蛋白质、核酸和脂质一起并称为生命活动过程中的4类重要的生物大分子,在生理过程中起着重要作用。
糖的本质是一类多羟基的醛酮,醛糖的C-1或酮糖的C-2位被称为糖的端基异构中心,它们是单糖分子中最具活性的部分。在移除活性中心的取代基团后,能够得到含碳的活性物种(例如阳离子物种,阴离子物种,自由基物种)。活性物种与其他受体结合形成新的C-X键,依据环外原子X的不同,可以将其分为氧苷、氮苷、硫苷及碳苷。从合成角度上来说,糖化学本质上是研究糖苷键以及糖保护基的化学。
通过对糖结构的分析研究和不断深入,人们发现糖类药物在各个治疗领域中占据了重要的比重。如抗菌药物万古霉素[1];改善高血压症状的葛根素[2]及抗HIV病毒药物地丹诺辛[3]等都体现了糖类药物的重要性,因此合成糖类药物是至关重要的。合成糖类药物的核心就在于构建糖苷键,而糖基化反应在糖苷键的构筑中表现出了其独特的高效性。
1 Koenigs-Knorr糖基化反应简介
糖基化反应是1879年由Michael首次报道的,几年后,由Koenigs和Knorr共同改进,发展了Koenigs-Knorr糖基化反应。随着糖基化反应的进一步探索,人们对其进行了巨大的改进,逐渐形成了一系列糖给体及其活化方法。如卤代糖给体、三氯乙酰亚胺酯、硫苷给体、亚砜给体、羧酸给体、糖醇给体、糖烯给体等[4]。其中卤代糖给体制备简单,合成的构型单一,成为了一类应用非常广泛的糖给体,最为经典的糖基化反应Koenigs-Knorr糖基化反应就是利用卤代糖给体来构筑糖苷键。
最为经典的Koenigs-Knorr糖基化反应是一种古老而操作简单的反应,即用卤代糖和醇在促进剂的作用下反应,生成相应的糖苷化合物。具有如下反应特点:(1)各种卤代糖的反应活性和稳定性各不相同,氯代糖最稳定,其次是溴代糖,碘代糖最不稳定;(2)卤代糖的反应活性不仅和自身的性质有关,还与反应溶剂、温度、催化剂等有关;(3)反应具有很高的非对映立体选择性;(4)由于卤代糖的稳定性较差,所以Koenigs-Knorr糖基化反应通常在室温或低温条件下进行[5]。随着Koenigs-Knorr糖基化反应在糖苷合成中的广泛应用,因此,得到了糖化学家的持续关注。
近年来糖基化反应的进展令人瞩目,目前已经有很多关于Koenigs-Knorr糖基化反应的报道,然而传统的Koenigs-Knorr糖基化反应是氯代糖或溴代糖在重金属Ag、Hg、Sn等、计量的Lewis酸或相转移催化剂的催化条件下进行的反应。但这些Koenigs-Knorr糖基化反应往往存在着立体选择性差、对人体危害较大、对环境严苛、底物使用范围窄等局限性,因此,Koenigs-Knorr糖基化反应成为当今糖化学领域的一个研究热点。本文对近年来的Koenigs-Knorr糖基化反应的主要研究进展进行了综述。
2 金属催化的Koenigs-Knorr糖基化反应
2.1 In催化的Koenigs-Knorr糖基化反应
虽然金属催化的Koenigs-Knorr糖基化反应已被大量报道,但主要是以重金属催化剂促进的Koenigs-Knorr糖基化反应,而采用较温和的金属催化剂的例子还是比较少见。2017年,Xue等[6]报道了使用催化量的InI3作为催化剂催化2-O-苯甲酰基-3,4,6-三-O-苄基氟代葡萄糖给体生成糖苷化产物的新型糖基化策略。该策略可用于组装β-连接的功能性糖缀化合物,并且该反应具有广泛的底物适用性的特点,比如类天然产物醇,氨基酸类醇以及糖醇类等受体,共得到了28例糖苷化产物,产率高达95%(图1a)。该体系中所使用的催化剂InI3耐水性好、可商业获得、且体系中不需要添加额外的助催化剂或添加剂。该方法对于氟代葡萄糖的活化具有很重要的意义。特别地,在立体选择性允许的条件下构建带有可选择性除去的2-O-苯甲酰基的部分苄基保护的吡喃葡萄糖苷,其作为糖基受体具有巨大的潜力,可以进一步构建1,2-O-糖苷键。
一年后,Xue等[7]又开发了一种有效的糖基化反应策略,该策略是采用催化剂In(NTf)3催化全苄基溴代葡萄糖的Koenigs-Knorr糖基化反应。该反应的特点是反应条件温和、官能团耐受性好、不需要任何添加剂、以令人满意的收率和良好的立体选择性得到各种糖苷(图1b)。同时使用NMR光谱的机理研究表明,反应是通过形成烷氧基-铟加合物进行的,该烷氧基-铟加合物对于游离醇显示出较强的以氧为中心的亲核性。这种通过促进剂活化受体以此来介导Koenigs-Knorr糖基化反应已成为构筑糖苷键的代表性新策略。

图1 In催化的Koenigs-Knorr糖基化反应Fig.1 In catalyzed the Koenigs-Knorr glycosylation reaction
2019年,Suh等[8]开发了一种高效的Koenigs-Knorr糖基化反应方法,该方法采用一种温和、稳定、绿色且易于处理的固体催化剂In(OTf)3(III),可催化活化全苄基氟代糖给体在室温下就可进行新型糖基化反应。该糖基化过程简单便捷、不需要预活化、预蒸馏或繁琐的后处理步骤,且在该反应条件下催化糖基化可兼容各种糖基受体,包括一些酸敏感性醇和电子富集的酚。值得注意的是,在相同条件下也能够顺利合成具有立体选择性的C-糖苷(图2b)。这种通用的方法在糖苷的合成中具有一定的突破。Suh等开发的此方法不仅能被用于糖苷的立体选择性形成,且将广泛应用于各种糖缀合物的合成中。

图2 In(OTf)3催化氟代糖给体的糖基化反应Fig.2 In(OTf)3 catalyzed the glycosylation of glycosyl fluoride
2.2 Fe催化的Koenigs-Knorr糖基化反应
2018年,Demchenko等[9]报道了一种简单廉价、使用催化量的FeCl3(III)作为催化剂来活化各种氯代糖的糖基化反应。与先前的方法相比,即使在较苛刻且对环境不友好的条件下,该方法也可实现较温和的活化氯代糖给体,只是糖基化反应的产率不理想。但本文获得的大多数结果与Ye等[10]和Jacobsen等[11]最近开发的有机催化反应相当。由于体系中未添加任何添加剂或催化剂和助剂,所以与2,3,4,6-四-O-苄基-氯代糖反应得到的糖苷化产物并未取得较好的立体选择性,但该方法可作为将来完善立体选择性的基础(图3)。此外,该作者还探讨FeCl3的作用,认为化学计量的FeCl3的作用可能优先由于糖基化后的异构化反应优先。
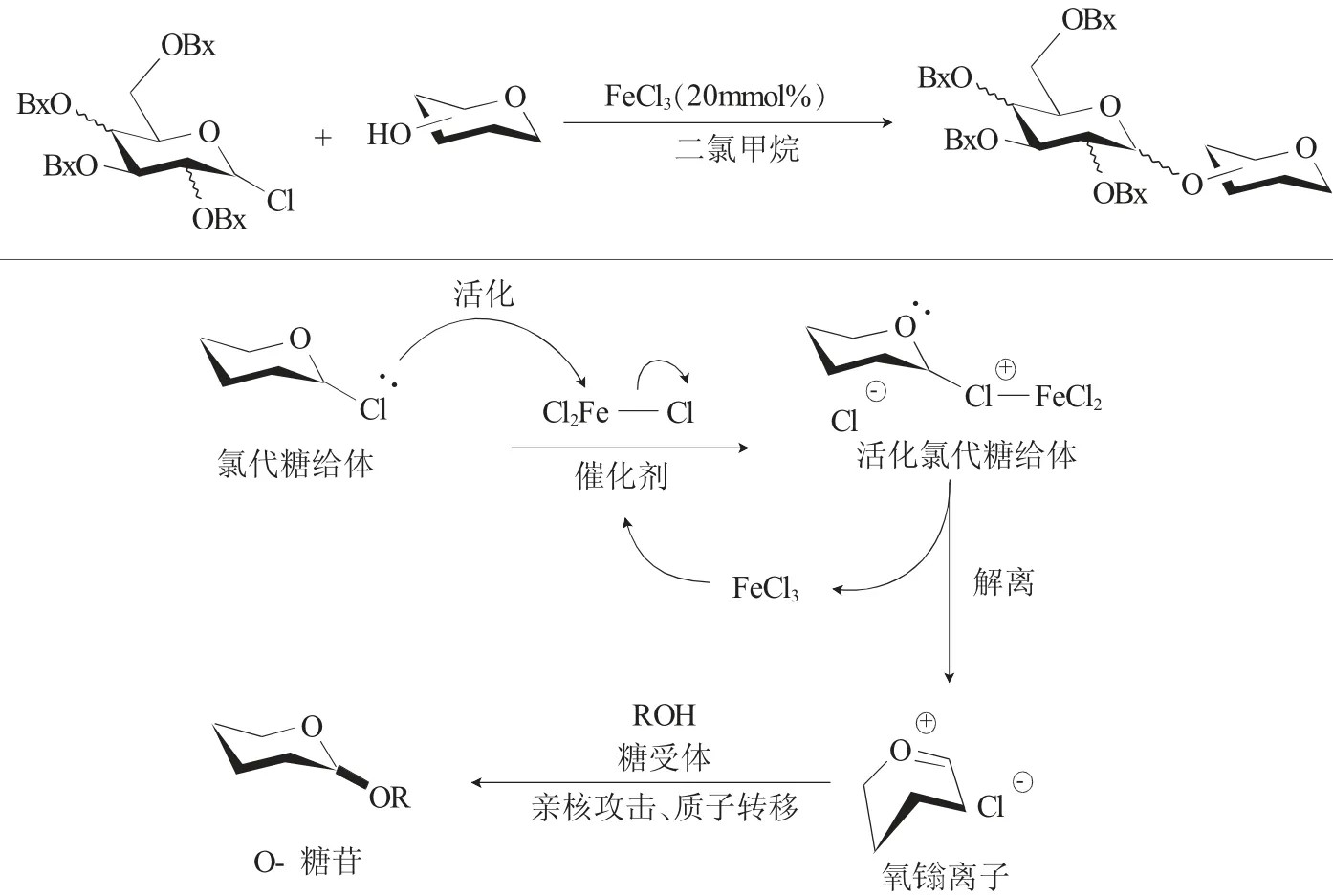
图3 FeCl3活化氯代糖的糖基化反应Fig.3 FeCl3 activated glycosylation of glycosyl chlorides
3 非金属催化的Koenigs-Knorr糖基化反应
3.1 脲催化的Koenigs-Knorr糖基化反应
众所周知,传统Koenigs-Knorr糖基化反应是在重金属等的催化条件下进行的反应,其危害较大,因此,发展环境友好型的Koenigs-Knorr糖基化反应在糖化学领域迫在眉睫。2016年,Ye等[10]采用尿素作为催化剂,活化氯代糖与醇进行Koenigs-Knorr糖基化反应,并对其立体选择性进行了改进。该方法的优异性体现在尿素介导的氢键活化相对应的氯代糖或溴代糖进行糖基化反应,在大多数情况下,都可以实现出色的产率和高异头选择性。当用2,3,4,6-四-O-苄基-葡萄糖给体时虽然观察到较低的α-立体选择性,但可以通过添加TTMPP(三(2,4,6-三甲氧基苯基)膦)使其提高选择性(图4a)。与现有的Koenigs-Knorr糖基化[4,12]方法相比,该方法具有立体选择性和无重金属催化等优点。
2017年,Jacobsen等[11]报道了大环双硫脲衍生物在糖基化反应中的应用(图4b)。该反应采用大环双硫脲衍生物作为催化剂来催化氯代糖给体,采用SN2机制使其α-氯代糖给体立体构型定向转变生成相应的β-糖苷化合物。由于糖基化反应中的立体化学选择性高度依赖于偶联部分的空间和电子性质,因此碳水化合物的合成不容易被预测。在这里,Jacobsen等发现大环双硫脲衍生物作为促进剂催化氯代甘露糖给体的立体定向转化取代途径。在合成反式1,2-,顺式1,2-和2-脱氧-β-糖苷中证明了该催化剂的效用。该反应机制中,亲电试剂和亲核试剂能够同时被活化来进行立体定向取代的Koenigs-Knorr糖基化反应。

图4 脲催化Koenigs-Knorr糖基化反应Fig.4 Urea-catalyzed Koenigs-Knorr glycosylation
3.2 TMSOTf参与的Koenigs-Knorr糖基化反应
2018年,Demchenko等[14]发展了3,3-二氟吲哚(HOFox)介导的Koenigs-Knorr糖基化反应。在该反应中3,3-二氟-3H-吲哚-2-基(OFox)的酰亚胺被发现是一个关键中间体,原位合成的溴代葡萄糖和OFox酰亚胺化物的活化都可以以再生的方式进行糖基化反应,而且该反应适用于不同糖系列的各种糖苷键的合成,在提高糖基化反应的产量的同时还能够缩短反应时间。对于该类反应,这种再生糖基化反应具有以下3个优点:(1)生成的少量反应型OFox亚氨酸盐给体有助于最大程度地减少副反应;(2)OFox给体不断再生,确保使用"新鲜"给体进入循环体系;(3)可以使用稳定的前体,并且详细监测糖基化反应以确保仅使用必要量的试剂(图5)。此外,该方法也可用于多步再生合成寡糖,为一些寡糖的合成提供了便利有效的方法。
2019年,Demchenko等[13]报道了一种由非金属催化剂三甲基甲硅烷基三氟甲磺酸盐(TMSOTf)催化的快速Koenigs-Knorr糖基化反应。该反应在传统的Ag(I)氧化促进的溴代糖苷化(Koenigs-Knorr糖基化反应)中添加Lewis酸TMSOTf,可大大加速反应的进行(图5)。该反应具有反应条件非常温和,可以保持实用的中性pH值,同时具有高速率和高糖基化产率等优点。另外,该反应还呈现了一系列不同保护的糖基溴化物之间的异常反应趋势。更特别地是,在该反应条件下,苯甲酰化的α-溴化糖比其苄基化的对应物更具活性。反应性差异通过竞争实验证明,Demchenko等还研究了Koenigs-Knorr糖基化反应的助催化剂Ag2O与路易斯酸催化剂协同作用的反应机理。在他们的实验室中,仍然在进一步研究,优化反应条件以应用于其他给体和体系。

图5 Demchenko发展的糖基化反应Fig.5 The glycosylation developed by Demchenko
3.3 非金属催化的无挥发性溶剂Koenigs-Knorr糖基化反应
碳水化合物在生物识别过程中起着至关重要的作用。自从Michael和Fischer等为糖基化反应建立基础以来,已经有许多糖基化方法被发展。但糖缀化合物的复杂性和多样性(如分支结构、不同的端基构型、可能出现的区域异构体和各种各样的寡糖)仍然存在。与其他生物聚合物(蛋白质和核酸)相对简单的序列相关的问题要求使用有效的合成方法并限制自动化方法。2017年,Mathue等[14]发展了在超临界二氧化碳(scCO2)中无金属无挥发性溶剂的Koenigs-Knorr糖基化反应(图6)。超临界二氧化碳(scCO2)可在不存在挥发性有机溶剂(VOC)的情况下使用卤代糖作为糖基给体来进行无过渡金属催化的Koenigs-Knorr糖基化反应。他们发展的此反应条件,可用于在完全绿色反应中获得糖苷以及原酸酯。该方法对温度的变化比对压力的变化更敏感,因为氯代糖需要比溴代糖更高的温度才能被活化。其中新戊酰基是良好的亲CO2单元,其被证明是获得良好立体选择性的最佳选择,此外也证明了流体性质和超临界条件的相关性。该方法具有避免了挥发性溶剂(VOCs)的使用、无过渡金属催化剂、溶剂可循环使用等优势。

图6 scCO2中的糖基化反应Fig.6 Glycosylation in scCO2
4 总结与展望
本文综述了近年涌现的一些Koenigs-Knorr糖基化反应。这些Koenigs-Knorr糖基化反应制备糖苷化合物大多具有立体选择性好、产率高、反应条件温和且底物适用范围广等优点。但由于Koenigs-Knorr糖基化反应不仅受卤代糖的反应活性及其自身的性质的影响,还与反应溶剂、温度、催化剂等有关,这为接下来进一步利用催化量的、环境友好型的催化剂实现Koenigs-Knorr糖基化反应提供了更多可能的机会。

