复发性卵巢癌应用培美曲塞联合洛铂治疗的临床效果
夏海清 米婷婷 任红娟
临床上复发性卵巢癌的病情进展,能够导致患者终末期恶病质的发生,增加患者的病死率。现阶段临床上主要通过放化疗进行辅助性治疗,从而抑制肿瘤的扩散、缩小病灶。但长期的临床随访研究显示,包括铂类及吉西他滨等药物在内的相关静脉化疗药物的治疗,并不能显著改善患者的生存预后,其治疗后的血清肿瘤生物学因子的表达仍然较高[1-2]。培美曲塞是1种结构上含有核心为吡咯嘧啶基团的抗叶酸制剂,通过破坏细胞内叶酸依赖性的正常代谢过程,培美曲塞能够通过拮抗癌细胞的增殖、促进癌细胞的凋亡等,辅助治疗复发性卵巢癌[3-4]。部分研究已经探讨了培美曲塞在治疗中晚期卵巢癌中的临床价值,但用于复发性卵巢治疗的研究不足,同时对于治疗后的患者体内的肿瘤生物学相关因子的表达分析研究不足。为了进一步指导临床上复发性卵巢癌的治疗,本次研究选取2018年1月至2020年2月在我院治疗的复发性卵巢癌患者64例,探讨了培美曲塞联合洛铂的临床效果,并将结果报告如下。
1 资料与方法
1.1 临床资料
选取接受治疗的复发性卵巢癌患者64例作为研究对象,纳入标准:①均经病理组织学证实;②卡氏功能状态评分(KPS)≥60分;③预计生存期>3个月;④有CT扫描可测量病灶;⑤患者及家属知情并签署同意书。排除标准:①有心电图异常、肝肾功能不全、凝血机制障碍、化疗禁忌证者;②近1个月内有放疗、化疗、激素治疗等。将患者随机分为试验组(n=31)和对照组(n=33),2组患者的临床资料比较无统计学差异(P>0.05),见表1。

表1 2组临床资料比较
1.2 治疗方法
对照组:吉西他滨,第1、8天,1 000 mg/m2,静脉滴注;第2天予以洛铂,50 mg/m2,静脉滴注;连续治疗28 d为1个疗程。试验组第2天给予培美曲塞静脉滴注,500 mg/m2,第2天予以洛铂静脉滴注,50 mg/m2,连续治疗28 d为1个疗程。2组均连续治疗4~6个疗程。
1.3 判断标准
(1)参照WHO制定的RECIST 1.0实体瘤客观疗效评价标准评价化疗4个周期后疗效,完全缓解(CR)为肿瘤消失,无新病灶发生;部分缓解(PR)为肿瘤病灶最大直径与最大垂直直径之积较治疗前缩小≥50%;稳定(SD)为肿瘤病灶最大直径与最大垂直直径之积较治疗前缩小<50%,或增大<25%;进展(PD)为肿瘤病灶最大直径与最大垂直直径之积较治疗前增大≥25%。总有效=CR+PR。(2)不良反应采用美国NCI-CTC 3.0版毒性反应评价标准评估。
1.4 检测方法
收集患者静脉血约5 ml后取其上清液,采用酶联免疫吸附法测定血清中CA125、SIL-2R和HE4水平,试剂盒由北京中杉金桥生物有限公司生产;采用全自动生化检测法测定血小板或者白细胞进行检测,配套试剂由南京碧云天生物科技有限公司生产。
1.5 统计学处理
2 结果
2.1 2组患者近期疗效的比较
试验组和对照组近期总有效率分别为32.26%和30.30%,无统计学差异(Z=-0.043,P>0.05),见表2。
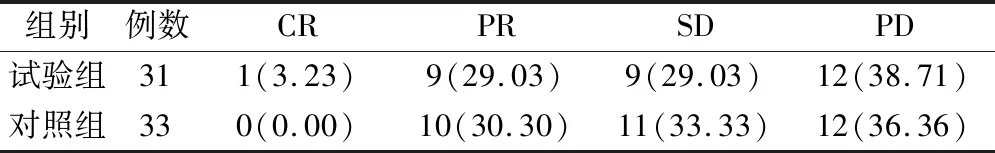
表2 2组患者近期疗效的比较(例,%)
2.2 2组患者CA125、SIL-2R和HE4水平比较
试验组和对照组治疗后CA125、SIL-2R和HE4水平均较治疗前明显降低(P<0.05);治疗后试验组CA125、SIL-2R和HE4水平明显低于对照组(P<0.05)。见表3。

表3 2组患者CA125、SIL-2R和HE4水平比较
2.3 2组治疗前后KPS评分比较
试验组和对照组治疗后KPS评分明显较治疗前升高(P<0.05);治疗后试验组KPS评分明显高于对照组(P<0.05)。见表4。
表4 2组治疗前后KPS评分比较分)
2.4 2组不良反应比较
试验组3~4级血小板和白细胞下降发生率明显低于对照组(P<0.05);试验组和对照组3~4级恶性呕吐和肝功能损害发生率比较无统计学差异(P>0.05)。见表5。

表5 2组不良反应比较(例,%)
2.5 2组PFS和OS比较
随访截至2017年12月,试验组中位PFS和OS分别为6个月和11个月,明显长于对照组的4个月和8个月,差异比较有统计学意义(χ2=32.507和33.538,P>0.05),见图1。

图1 试验组和对照组生存曲线
3 讨论
复发性卵巢癌患者的总体病死率较高,治疗后的病情缓解率较低,特别是近年来随着中晚期卵巢癌的检出率的上升,卵巢癌的复发或者转移等问题,已越来越成为临床上威胁患者生存预后的主要因素。传统的放化疗方式,特别是静脉化疗能够通过促进癌细胞的凋亡,影响到局部肿瘤新生血管的血流动力学指标,促进新生血管的闭合及坏死等,促进肿瘤病灶的萎缩,并影响到卵巢癌患者的5年生存率及中位生存时间[5]。一项汇集了113例样本量的复发性卵巢癌患者的临床治疗随访研究显示,传统吉西他滨辅助静脉化疗后的治疗有效率不足35%,同时治疗后患者体内的相关肿瘤生物学因子如糖类抗原125(CA125)、可溶性白细胞介素2受体(SIL-2R)和人附睾蛋白4(HE4)等,仍然无明显的下降[6]。
培美曲塞能够抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酰胺核苷酸甲酰转移酶的活性,这些酶都是合成叶酸所必需的酶,参与胸腺嘧啶核苷酸和嘌吟核苷酸的生物再合成过程。在卵巢癌方面,培美曲塞对于卵巢生发上皮细胞、浆液腺癌、黏液性癌、透明细胞癌等,均具有显著的癌细胞促进凋亡作用[7-8]。 培美曲塞对于癌细胞周期的调控,能够提高癌细胞G0/S期的比例,降低癌细胞跨越G0的速度,并促进癌细胞持续性停滞于静止期。相关已有的研究揭示了培美曲塞在辅助治疗卵巢癌中的价值,认为培美曲塞辅助治疗后患者的肿瘤高负荷表现及短期内的病情缓解水平均明显改善[9],但缺乏对于生存质量评分KPS评分或者肿瘤生物学因子的表达分析研究。
本次研究通过不同的化疗方案的对比研究发现,培美曲塞辅助化疗后患者的近期或者远期治疗效果并无明显的改善,这与部分研究者的结论存在一定的差别,部分研究者认为培美曲塞的辅助治疗至少在改善患者的近期临床症状或者治疗总体有效率等方面具有显著的价值,但本次研究并无相关的结论,这主要考虑与不同研究的化疗方案的周期不同、随访观察的具体指标或者治疗效果的评估系统具有一定的差异有关。培美曲塞辅助治疗后患者体内的CA125、SIL-2R和HE4等肿瘤生物学因子均明显下降,提示了培美曲塞辅助治疗价值,培美曲塞对于患者体内的相关肿瘤生物学因子的抑制作用,主要考虑与下列几个方面的因素有关[10-12]:①培美曲塞能够通过抑制癌细胞表面糖蛋白受体的激活,抑制细胞膜表面糖尿病的释放导致的CA125等的释放;②培美曲塞能够抑制癌细胞DNA的扩增,降低癌细胞过度分裂过程中释放的细胞碎片。有研究者[13-14]在探讨了不同样本量的培美曲塞辅助化疗结局后发现,复发性卵巢癌患者治疗后的血清中CEA或者CA125等肿瘤指标均可显著下降,其中CA125的下降可达25%以上,随着化疗周期的延长、治疗敏感性的增加,CA125等指标的下降更为明显。培美曲塞治疗后的患者生活治疗评分KPS评分的改善,提示了复发性卵巢癌患者治疗后的生活质量的改善。在临床安全性方面,培美曲塞辅助治疗后的患者体内的血小板和白细胞的下降程度明显受到了抑制,其下降程度较低,血液系统的毒性作用较轻,临床安全性较为明显。同时培美曲塞辅助治疗后的复发性卵巢癌患者的生存预后明显改善,治疗后的患者生存指标的改善主要考虑与培美曲塞对于肿瘤高负荷效应的改善、降低了远期的复发水平等因素有关[14-17]。
本次研究的创新性在于探讨了培美曲塞辅助治疗后患者体内的CA125、SIL-2R和HE4等指标的变化。综上所述,复发性卵巢癌应用培美曲塞联合洛铂治疗有较好的临床效果,不良反应较轻,在二线治疗中可推广使用。

