两种铁氧化物对无机磷的吸附特征分析❋
郭智俐, 李 苓, 刘晓月, 李 敬, 曹晓燕1,2,❋❋
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室 海洋高等研究院, 山东 青岛 266100; 2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学实验室, 山东 青岛 266237; 3. 中国海洋大学化学化工学院, 山东 青岛 266100)
近年来,水体中富营养化的现象频繁发生,磷是海洋生态系统中十分重要的营养元素之一,却也是引起水体富营养化的主要元素之一[1]。磷在沉积物上的吸附解吸过程是海洋中磷循环的一个重要的环节,对海洋生态系统的营养水平有着不容忽视的影响。海洋中沉积物的主要活性组分通常是粘土矿物、铁、锰、铝水合氧化物、有机质和碳酸盐[2]。铁氧化物作为沉积物活性组分中的重要部分,对磷在沉积物上的吸附和释放有重要贡献[3]。海洋沉积物中,铁氧化物具有多种不同的形态,常见铁氧化物有针铁矿、赤铁矿、无定形铁氢氧化物(水铁矿)、纤铁矿、磁赤铁矿、磁铁矿等[4]。
不同形态间的铁氧化物化学活性存在差异[5]且可以相互转化[6],已有研究表明,与无定形氧化铁相比,α-Fe2O3吸附能力较弱[7-8],α-Fe2O3对无机磷的吸附多以配位交换的方式进行[9-10],无定形氧化铁对磷的吸附能力较强[11],无机磷以内圈络合物的形式发生吸附[12]。目前关于铁氧化物上无机磷的吸附特征研究多在淡水介质中进行,本研究则从海洋环境出发,探讨作为海洋沉积物重要组分的铁氧化物对无机磷的吸附特征。
文中制备了α-Fe2O3和无定形氧化铁,对其组成和结构性质进行了表征,并初步探究了其对无机磷的吸附特征和机制:考察了不同离子强度下两种铁氧化物对无机磷的吸附动力学和热力学等温线,绘制了无定形氧化铁对无机磷的吸附pH边曲线,探讨了温度、离子强度及pH对氧化铁吸附无机磷的影响,所得结果可为认识无机磷在海洋沉积物上的吸附机制提供研究基础,同时可为人们解决水体富营养化问题提供了理论支持和技术手段。
1 材料与方法
1.1 铁氧化物的制备
将27.0 g FeCl3·6H2O溶于150 mL蒸馏水中,用NH3·H2O调节pH在11~12之间,433~443 K油浴加热约2 h。离心将所得沉淀分别用蒸馏水和无水乙醇洗涤多次,干燥、煅烧制得α-Fe2O3,研磨备用;称取80.0 g FeCl3·6H2O,溶于500 mL 蒸馏水中,将25%~28%的氨水滴加入体系中,使其pH到7~8后剧烈搅拌,迅速离心,沉淀用高纯水洗涤后在318 K下烘箱内烘40 h左右,制得无定形氧化铁,研磨备用[7,13]。
1.2 铁氧化物的表征
采用Bruker D8 Advance X射线衍射仪(XRD)对矿物的类型和结晶度进行测定。采用Nicolet 380 FT-IR红外光谱仪对矿物进行表征。样品的比表面积参数利用N2吸附-脱附方法,采用Brunauer、Emmet、Teller在Langmuir方程基础上推导出的BET方程(BET法),通过Micromeritic ASAP2020M物理吸附分析仪进行测定[14]。
1.3 吸附动力学曲线测定
称取0.02 g α-Fe2O3或无定形氧化铁样样品于100 mL磨口带塞锥形瓶中,加入50 mL 1.0 mg/L KH2PO4溶液,固液比为0.40 g/L,置于298K恒温水浴振荡器中振荡,振速为150 r/min,分别于0 min,10 min,20 min,30 min,45 min,1 h,2 h,4 h,8 h,12 h,16 h,24 h,36 h,48 h取样,在4 000 r/min下离心并经醋酸纤维滤膜(孔径0.45 μm,上海新亚)过滤,采用磷钼蓝分光光度法显色[15]测定滤液中的无机磷浓度,通过其初始浓度与吸附后的浓度之间的差异计算获得无机磷的吸附量Qt,以时间t-无机磷吸附量Qt为横纵坐标,绘制吸附动力学曲线,每组实验做两个平行样。
1.4 吸附等温线测定
因无定形氧化铁吸附能力较强,故将α-Fe2O3和无定形氧化铁吸附等温线的初始浓度范围分别设置为0~1 mg/L和0~10 mg/L,吸附介质为离子强度与天然海水相似的0.7 mol/L NaNO3。分别各称取α-Fe2O3和无定形氧化铁0.02 g于100 mL磨口带塞锥形瓶中,加入50 mL不同浓度的磷酸盐溶液。该体系在398 K振荡(150 r/min)24 h后取出,离心、过滤、无机磷浓度测定等步骤同上,获得无机磷的吸附量,绘制吸附等温线,每组实验做两个平行样。
分别考察离子强度、温度以及pH等环境因素对两种铁氧化物表面上无机磷吸附等温线的影响。电解质选用NaNO3溶液,浓度分别为 0.01、0.10和 0.70 mol/L;温度为 298,303和308 K。吸附pH边曲线实验:利用Mettler Toledo FE28 pH计测量初始磷溶液pH后用稀HNO3和稀NaOH将一系列无定形氧化铁无机磷悬浊液初始pH分别调至3.0,4.0,5.0,5.5,6.0,6.5,7.0,7.5,8.0,9.0,电解质溶液为0.70 mol/L NaNO3。振荡过程中调节pH 2~3次,每组实验做两个平行样。
2 结果与讨论
2.1 样品性质
图1为两种铁氧化物的X-射线衍射图,由图可知,所制备的α-Fe2O3样品的衍射峰的位置以及峰的相对强度与下方JCPDS标准卡(No.33-0664)相匹配,同时所制备的无定形氧化铁没有明显的衍射峰。
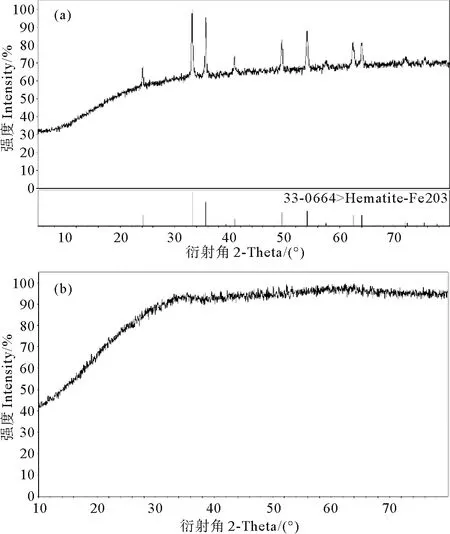
图1 α-Fe2O3(a)、无定形氧化铁(b)的粉晶X-射线衍射图
由图2可知,α-Fe2O3的红外光谱图显示存在560和480 cm-1的吸收峰,这两处峰是由于Fe-O的伸缩振动造成的,而3 360 cm-1处是OH氢键缔合羟基的特征峰,其中在2 420 cm-1出现的峰是O-H伸缩振动峰[16]。无定形氧化铁中3 360 cm-1峰面积较大,可认为是OH氢键强度较强所致。

图2 α-Fe2O3(a)、无定形氧化铁(b)的傅里叶红外光谱图
经测定,α-Fe2O3的比表面积为:12.06 m2/g,无定形氧化铁的比表面积为:273.2 m2/g,可见无定形氧化铁具有更大的比表面积。
2.2 铁氧化物对无机磷的吸附动力学
对α-Fe2O3和无定形氧化铁进行吸附动力学曲线测试,吸附介质选择与天然海水离子强度相似的0.70 mol/L NaNO3溶液。结果如图3所示。可以看出,在初始的1 h以内,吸附量随时间快速增长,之后吸附量随时间变化增长缓慢,最终达到平衡,较为明显地显示出吸附分为快速吸附和慢速吸附两个阶段,二者都是在短时间内快速吸附达到一个高值,之后缓慢吸附达到最大吸附量。用二段一级动力学方程对无机磷在α-Fe2O3和无定形氧化铁的吸附动力学参数进行拟合,二段一级动力学方程如下,得到拟合参数见表2。
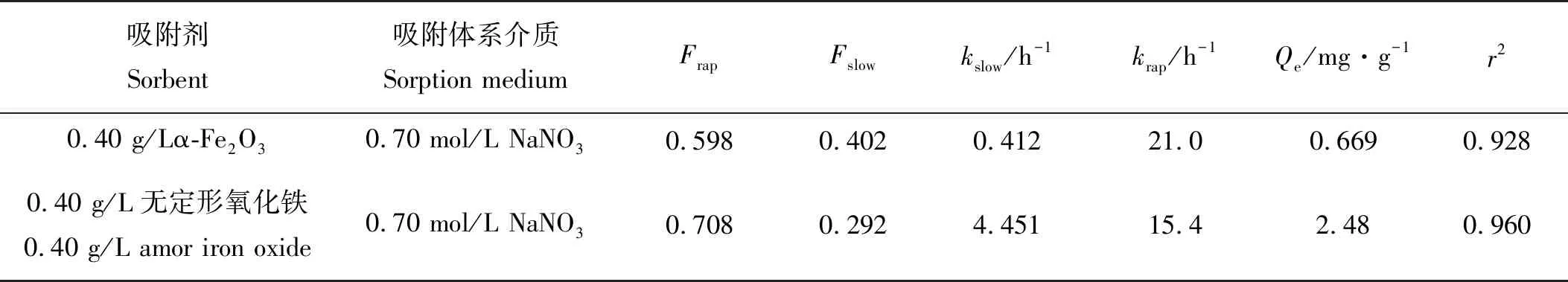
表2 无机磷在α-Fe2O3和无定形氧化铁的吸附动力学拟合参数

图3 无机磷在α-Fe2O3和无定形氧化铁的吸附动力学拟合曲线
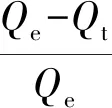
(1)
其中:Frap、Fslow是快速和慢速吸附部分所占的质量分率;krap,kslow(h-1)分别指快速和慢速吸附速率常数;t为吸附时间;Qt(mg/g)为某时刻铁氧化物吸附无机磷的量;Qe(mg/g)为铁氧化物对无机磷的平衡吸附量。快速吸附过程以物理吸附为主,而慢速吸附过程则主要为化学吸附作用,两种氧化铁对无机磷的吸附应为物理吸附与化学吸附共存的过程。
由表2可知,在相同固液比0.40 g/L条件下,α-Fe2O3的Frap值为0.598,而无定形氧化铁则为0.708,无定形氧化铁的物理吸附能力显著大于α-Fe2O3。α-Fe2O3的平衡吸附量为0.669 mg/g,无定形氧化铁的平衡吸附量为2.48 mg/g, 这可能是因为α-Fe2O3的吸附作用中配体交换效应较强而表面羟基主要分布在边面,板面对无机磷的吸附能力较小[17],而无定形氧化铁结晶度差比表面积大,对无机磷的吸附能力较强。
2.3 铁氧化物对无机磷的吸附热力学分析
不同温度下磷酸盐在两个氧化铁表面的吸附平衡等温线如图4所示,吸附等温式方程拟合结果列于表3。由图4和表3可知,Freundlich方程可以很好地描述两种氧化铁对无机磷的吸附,Freundlich等温吸附方程见公式(2)。

图4 无机磷在α-Fe2O3(a)和无定形氧化铁(b)的吸附等温线
Qe=KFCe1/n。
(2)
其中:Qe是铁氧化物对无机磷的平衡吸附量(mg/g);Ce是吸附平衡时上清液的无机磷浓度(mg/L);KF和n为吸附系数。
由表3可知,α-Fe2O3和无定形氧化铁的吸附系数KF均随着温度的升高而增加,温度升高对吸附能力是有利的,吸附为吸热过程。
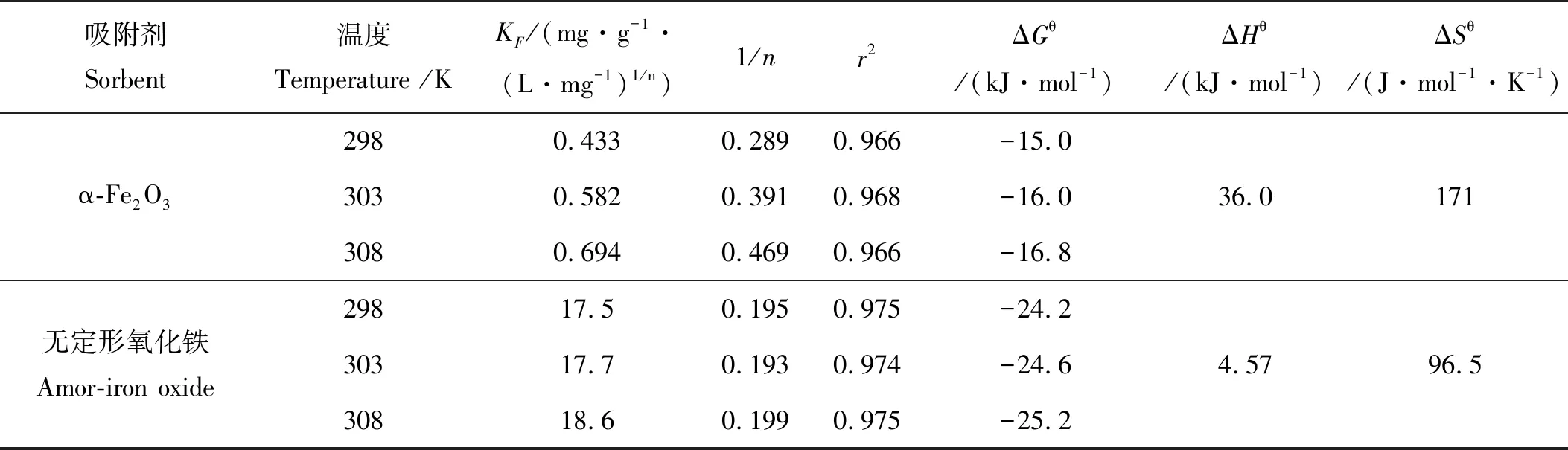
表3 无机磷在α-Fe2O3和无定形氧化铁的等温吸附参数
吸附焓、吸附Gibbs自由能及吸附熵的计算公式如下:
ΔGθ=-RTlnK=ΔHθ-TΔSθ。
(3)
式中:K为吸附平衡常数(L/mg);R为气体常数(8.314 J/mol·K);T为温度(K);ΔGθ为标准吸附Gibbs自由能变(kJ/mol);ΔHθ为标准吸附焓变(kJ/mol);ΔSθ为标准吸附熵变(J/mol·K)。
表3可知,无机磷在α-Fe2O3的ΔGθ在-16.8~-15.0 kJ/mol之间,无定形氧化铁表面的ΔGθ在-25.2~-24.2 kJ/mol之间,表明无机磷在两种铁氧化物上的吸附均为自发进行的,且以物理吸附为主[18],与α-Fe2O3相比,无定形氧化铁的自发性稍强[19]。同时,α-Fe2O3的吸附热ΔHθ为36.0 kJ/mol,而无定形氧化铁的吸附热ΔHθ为4.57 kJ/mol,二者存在较为显著的差异,原因可能是无机磷在α-Fe2O3上的吸附存在部分配位基交换或氢键力作用,而无机磷在无定形氧化铁上的吸附则可能主要是氢键力、偶极间力作用的结果[20]。
2.4 不同离子强度下铁氧化物对无机磷的吸附
图5所示是三种离子强度NaNO3介质中磷在α-Fe2O3和无定形氧化铁上的吸附等温线。用Freundlich等温吸附方程对吸附等温线进行拟合,拟合参数见表4,其r2值均在0.950以上。由图5可以看出随着离子强度的增大,无机磷在α-Fe2O3和无定形氧化铁上的吸附量均增大,可见离子强度的增加促进无机磷在两种铁氧化物表面的吸附。这可能源于其对无机磷的吸附为内圈络合作用[21],而铁氧化物表面带有较多的负电荷,随着离子强度的增加,吸附层表面的双电层结构被压缩,负电荷量减小,从而促进无机磷的吸附[22]。在各不同离子强度介质中,无定性氧化铁吸附无机磷的KF值仍显著高于α-Fe2O3。
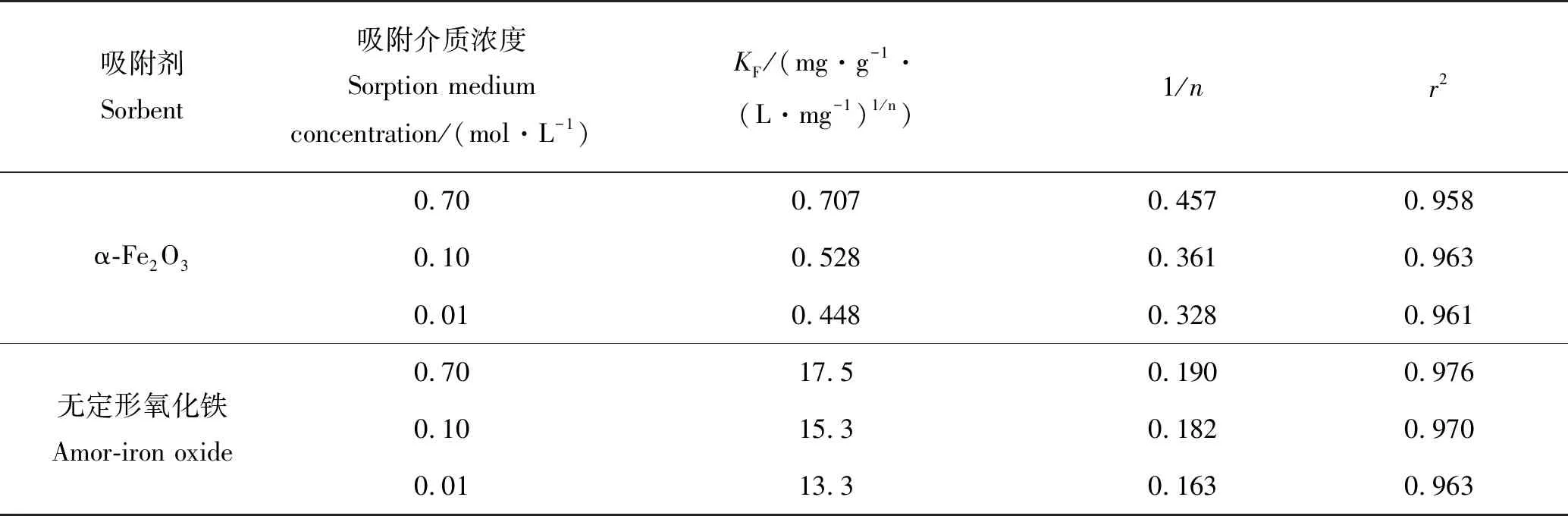
表4 不同离子强度下无机磷在α-Fe2O3和无定形氧化铁的等温吸附参数
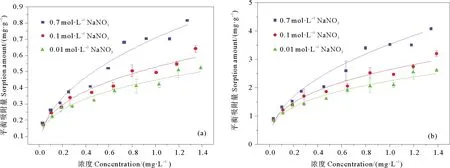
图5 不同离子强度下无机磷在α-Fe2O3(a)和无定形氧化铁(b)上的吸附等温线
氮是海洋初级生产力的限制因子,沉积物对氮的吸收与释放对海洋生物的生存有着重要的作用[23]。文中选用的0.01 mol/L的NaNO3较好的表现了海洋实际环境的氮磷比,随着NO3-浓度的大幅增加,无机磷在铁氧化物上的吸附量仍呈现出的增加趋势,说明氮的增加不会对无机磷在铁氧化物上的吸附产生竞争关系。
2.5 铁氧化物对无机磷的吸附pH边曲线
因无定形氧化铁对无机磷的吸附能力更强,故选用无定形氧化铁做吸附pH边曲线,结果如图6所示,无定形氧化铁在pH=3~9之间时,随着碱性的增大,其对无机磷的吸附量减少。就无定形氧化铁的表面性质分析,其对无机磷的吸附以静电吸附为主,体系-OH增多氧化物表面负电性增强,不利于静电吸附[8];从磷酸根在水溶液中的形态变化来分析,随着pH由3至9的变化,溶液中磷酸根的存在形式从以H2PO4-为主逐渐变为以HPO42-为主,与HPO42-形态相比,金属氧化物的表面羟基可能更易与H2PO4-形态发生配体交换反应,所以随着pH的升高,无定形氧化铁的吸附量逐渐减少,该研究结果与Chubar等[24]一致。

图6 无机磷在无定形氧化铁的吸附pH边曲线
3 结论
(1)二段一级动力学方程可以很好的描述两种铁氧化物对无机磷的吸附动力学,无机磷在氧化铁上的吸附分为快慢吸附两个部分。在相同固液比条件下,无定形氧化铁的吸附能力远大于α-Fe2O3。
(2)无机磷在两种铁氧化物上的吸附等温线可以用Freundlich等温吸附方程进行拟合,温度升高有利于吸附的进行。α-Fe2O3对和无定形氧化铁对无机磷的吸附为物理和化学吸附并存的过程,无定形氧化铁的物理吸附能力显著大于α-Fe2O3。
(3)离子强度对无机磷在两种铁氧化物上的吸附有不同的影响。两种氧化铁的KF均随离子强度的增加而减小。氮的增加不会对无机磷在铁氧化物上的吸附产生竞争作用。

