植物甲基化类黄酮及其O-甲基转移酶研究进展
陈建华,李晓曼,杨文钰,刘 江*
1农业部西南作物生理生态与耕作重点实验室;2四川省作物带状复合种植工程技术研究中心;3四川农业大学 生态农业研究所,成都 611130
果蔬、豆类和茶叶中富含类黄酮[1],因其具有抗抑郁[2]、抗炎、抗过敏、抗糖尿病、抗衰老[3]和抗癌[4]等多种药用功能而备受关注[5]。类黄酮结构与其生物功能密切相关,O-甲基化类黄酮是含有OCH3基团的类黄酮,其在植物根瘤固氮[6,7]、吸引昆虫传粉[8,9]等生长发育进程及抗虫、抗病[10]、抗杂草[11]等抗逆[12,13]反应中发挥了重要作用。研究证实,O-甲基化类黄酮具有更强的抗氧化[14]、抗炎[15]、抗癌[16]等功能,且具有更高的生物利用度[17,18],更具药用价值。类黄酮O-甲基转移酶(FOMT)属于O-甲基转移酶(OMT)亚家族,催化类黄酮合成O-甲基化类黄酮,在植物中广泛存在。本文综述了O-甲基化类黄酮结构与功能,及OCH3基团对其功能的影响;整理归纳了FOMT研究现状,并对其进行了生物信息学分析,以期为O-甲基化类黄酮及FOMT的进一步的研究与应用开发提供参考。
1 O-甲基化类黄酮结构
类黄酮是重要的植物次生代谢产物,在植物中存在超过10 000种类黄酮[19],其基本结构为C6-C3-C4,是一类2-苯基色原酮类化合物,由两个芳环(A和B),通过含氧杂环(环C)连接形成。其合成起始于丙二酰辅酶A和4-香豆酸辅酶A[20],与木质素具有共同的合成前体,也有一些特殊的类黄酮的合成起始于辅酶A,如肉桂酸和二羟基香豆酸。类黄酮亚组包括:黄酮、黄酮醇、黄烷酮、黄烷醇、异黄酮、花色素等。修饰反应导致了类黄酮化合物结构与功能的多样性[21],基本的修饰反应包括:酰基化、糖基化、羟基化、异戊烯基化、甲基化等。甲基化是类黄酮重要的修饰反应,包括C-甲基化和O-甲基化两类,O-甲基化的类黄酮在植物中广泛存在,而C-甲基化的类黄酮存在于少数植物中,例如无刺藤[22]。O-甲基化修饰是一种常见的化学修饰,在类黄酮的不同位点都会发生;类黄酮经不同位点与不同数量的O-甲基化修饰,产生不同的O-甲基化类黄酮,常见的类(异)黄酮如表1和2所示,其结构骨架分别见图1和2。由表可知,植物类黄酮的O-甲基化修饰在A环和B环上均会发生,且多发生于B环的3′和4′号羟基位点和A环的6、7、8号羟基位点(其中,A环以7号位点修饰居多);而已见报道的植物异黄酮O-甲基化修饰多发生于B环的4′号羟基位点,极少数发生于A环的7号羟基位点。不同物种的植物类黄酮O-甲基化修饰位点不同,其中,大豆、苜蓿等双子叶植物类黄酮的O-甲基化修饰多发生于3′和4′号羟基位点,而水稻等单子叶植物多发生于3′、5′、7号羟基位点。

图1 类黄酮骨架Fig.1 Flavonoid skeleton
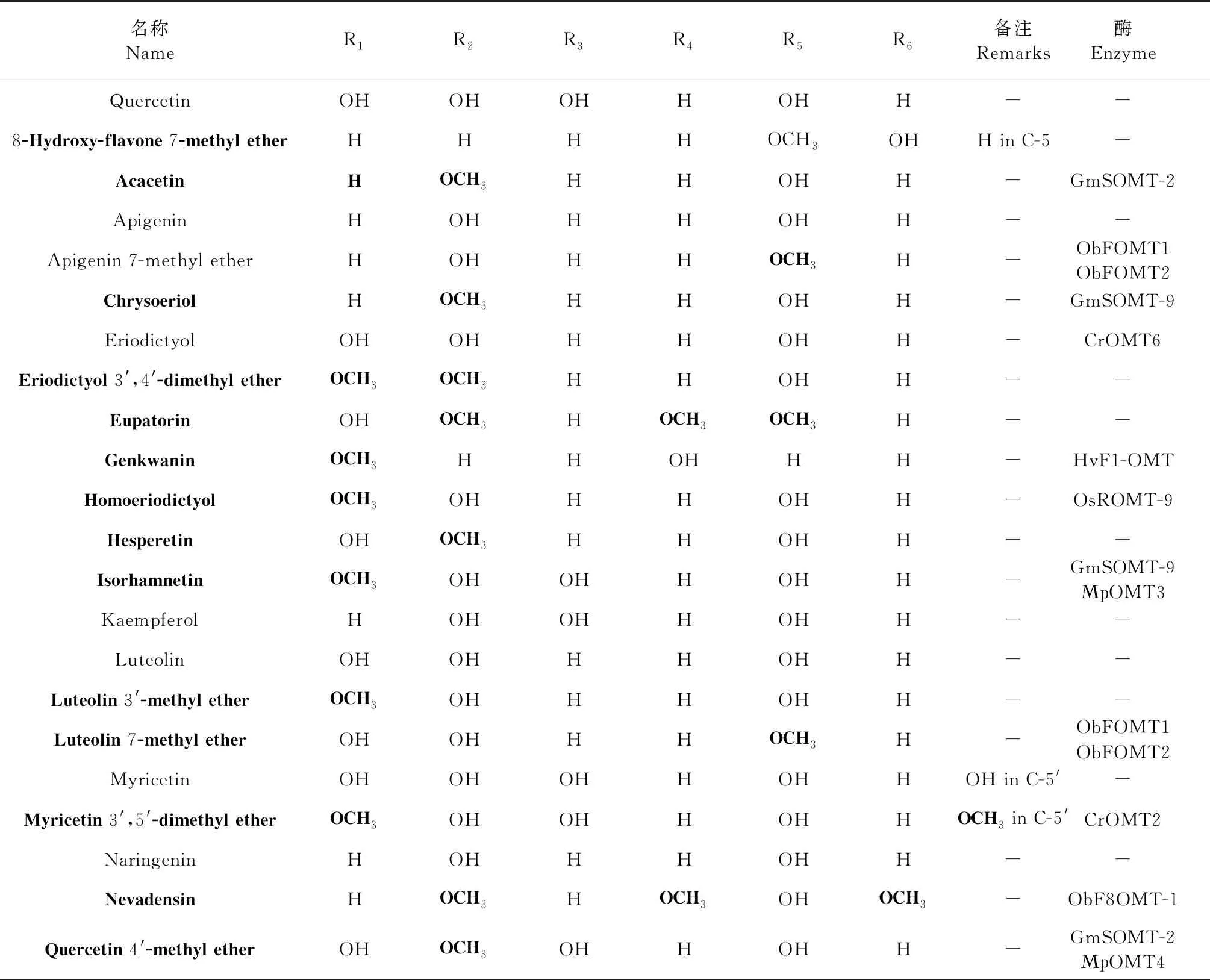
表1 常见类黄酮结构

续表1(Continued Tab.1)

图2 异黄酮骨架Fig.2 Flavonoid skeleton
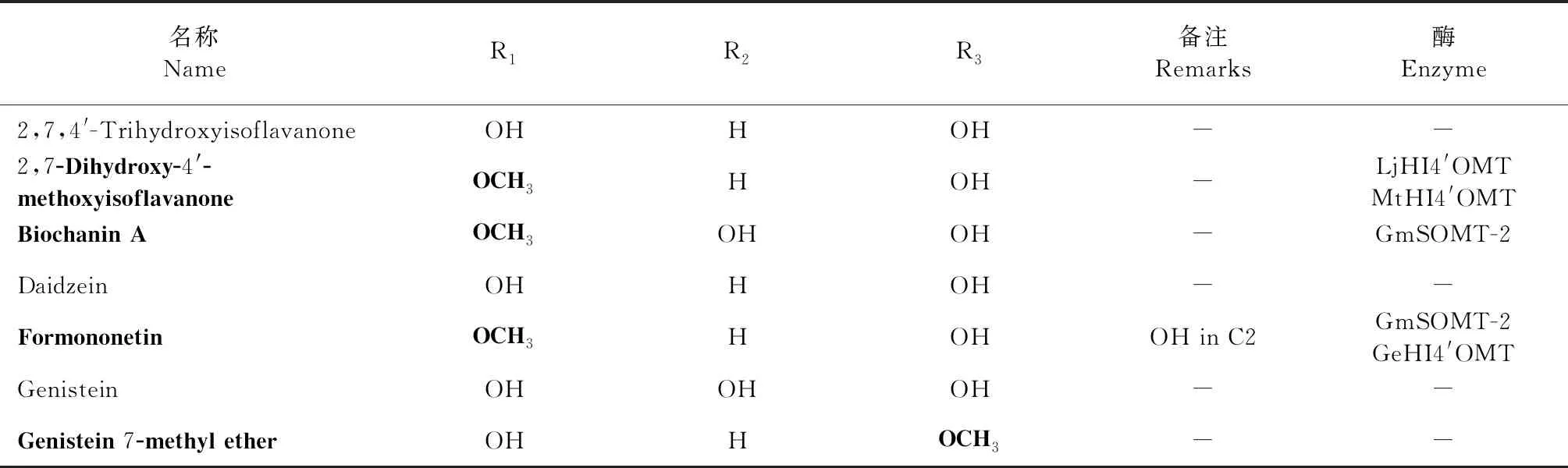
表2 常见异黄酮结构
2 O-甲基化修饰对类黄酮功能的影响
2.1 O-甲基化类黄酮药用功能
诸多研究表明,O-甲基化类黄酮具有多种药用功能,且O-甲基化修饰可提高部分类黄酮的药用活性。C-8位的O-甲基化修饰可增强类黄酮促胰岛素分泌活性,从而提高抗糖尿病功能[23]。O-甲基化修饰还能提高类黄酮抑制糖尿病并发症的能力[24,25],蛋白质糖化形成晚期糖基化终产物AGEs(advanced glycation end products)[26],引起糖尿病并发症,染料木素可抑制蛋白糖化,而C-7位和C-4′位O-甲基化的染料木素抑制能力更强[27]。肿瘤坏死因子相关凋亡诱导配体(TRAIL)诱导各种肿瘤细胞凋亡,O-甲基类黄酮(5,7-dimethoxyflavone、5,7,4′-trimethoxyflavone、3,5,7,3′,4′-pentamethoxyflavone)可通过死亡受体和线粒体途径,增强TRAIL诱导的人白血病MOLT-4细胞凋亡[28]。刺芒柄花素(C-4′位O-甲基化)可抑制MCF-7乳腺癌细胞[29],其还能通过G0/G1期阻滞抑制细胞增殖,促进ES2和OV90卵巢癌细胞的凋亡[30]。5,7,4′-三甲氧基黄酮对SCC-9人舌鳞癌细胞抑制效力,是5,7,4′-三羟基黄酮(芹菜素)的8倍,其IC50值分别为5 μM与40 μM[31]。O-甲基化修饰提高类黄酮的抗氧化活性,提高抗炎能力。异鼠李素是一种3′-O-甲基化槲皮素,能抑制促炎物质分泌,降低活性氧(reactive oxygen species,ROS)含量,具有强抗氧化作用[32]。在应对关节炎时,橙皮素具有镇痛与抗炎的功效[15]。O-甲基化类黄酮可影响多药耐药蛋白活性,提高机体防御有毒化合物的能力[33]。
2.2 O-甲基化修饰提高类黄酮药用价值的机理
研究表明,O-甲基化修饰可提高类黄酮的结构稳定性、蛋白亲和力、转运力,降低其水溶性,这些性质的改变是其药用价值提升的关键。生物利用度是指制剂中药物被吸收进入人体循环的速度与程度,它反映了化合物在生物体内吸收,分布,代谢和排泄的情况[34]。类黄酮的低生物利用度,使其在临床治疗与化学预防上的应用受到极大的限制[35,36],而O-甲基化能有效提高类黄酮的生物利用度[17]。
O-甲基化类黄酮具有更好的稳定性。类黄酮主要以苷类或游离苷元的形式存在于植物中[37],摄入人体后会进行一系列的代谢反应。首先,类黄酮苷在小肠中水解成苷元[38,39],然后在小肠、大肠或结肠中,与甲基、硫酸盐基团和葡萄糖醛酸发生偶联反应[35],在肝脏完成代谢转化,然后以不同的偶联物进入血液[38]。由于快速的新陈代谢,摄入富含类黄酮的食物后,血液中类黄酮浓度仍低于10 μM[40]。而O-甲基化修饰可以保护类黄酮免受肝脏代谢的影响,抑制类黄酮与葡萄糖酸和硫酸盐结合,提高其代谢稳定性[17]。
在人体内,O-甲基化类黄酮具有更好的转运能力[41],人体内外源化合物的运输主要依赖血清蛋白,O-甲基化提高了类黄酮的蛋白亲和力,从而增强转运能力[42]。O-甲基化还降低了类黄酮的水溶性,增强疏水性[43],这种疏水相互作用在类黄酮与蛋白结合过程中起到重要作用,从而提高类黄酮的蛋白结合能力。甲基化通过提高黄酮的稳定性与转运能力,提高其肠道吸收量[17,18]与生物利用度,较其他类黄酮具有更强的药用活性,更高的生物利用度也进一步使得O-甲基化类黄酮能够稳定有效地发挥药效。
3 类黄酮O-甲基转移酶(FOMT)研究进展
3.1 FOMT分类
类黄酮的甲基化修饰反应,由类黄酮甲基转移酶催化完成。根据不同目标附着物,甲基转移酶可以简单地分类为O-甲基转移酶(OMT)、N-甲基转移酶(NMT)和C-甲基转移酶(CMT)[44,45]。OMT在自然界中广泛存在,大多数植物源OMT以二苯乙烯和类黄酮等酚类化合物作为底物[43]。FOMT属于OMT亚家族,其保守结构域在Pfam数据库(http://pfam.xfam.org/)的索取号为PF01596。
FOMT催化S-腺苷-1-甲硫氨酸(SAM,AdoMet)上的甲基转移到类黄酮上,形成O-甲基衍生物和S-腺苷-1-高半胱氨酸(SAH)[46]。基于氨基酸序列长度可将植物OMT分为两类[47],I类OMT的分子量(约23~29 kDa)较低,催化过程需要二价阳离子参与,如:Mg2+、Ca2+;这些二价阳离子起稳定结构的作用,还可直接参与底物与酶的结合过程[48]。II类OMT的分子量较大(38~43 kDa),催化过程不需要阳离子参与,这类OMT活性可利用基于组氨酸(His)催化的二元体来增强其酶活性[49],FOMT大多属于II类OMT[50]。目前,被报道的部分植物类黄酮O-甲基转移酶如表3所示。

表3 植物类黄酮O-甲基转移酶
图3进化树分析表明,不同物种的FOMT蛋白具有较高同源性。图中不同颜色代表不同的催化位点,分支1蛋白来自双子叶植物,分支2蛋白来自单子叶禾本科植物,主要催化3′、4′、5′号位点;分支3蛋白来自双子叶唇形科植物,主要催化位点为C-7位;除HvF1-OMT外,分支4蛋白均来自双子叶植物,且大部分属于豆科,催化C-4′位。总而言之,具有相同催化位点与相同科属的FOMT同源性更高。
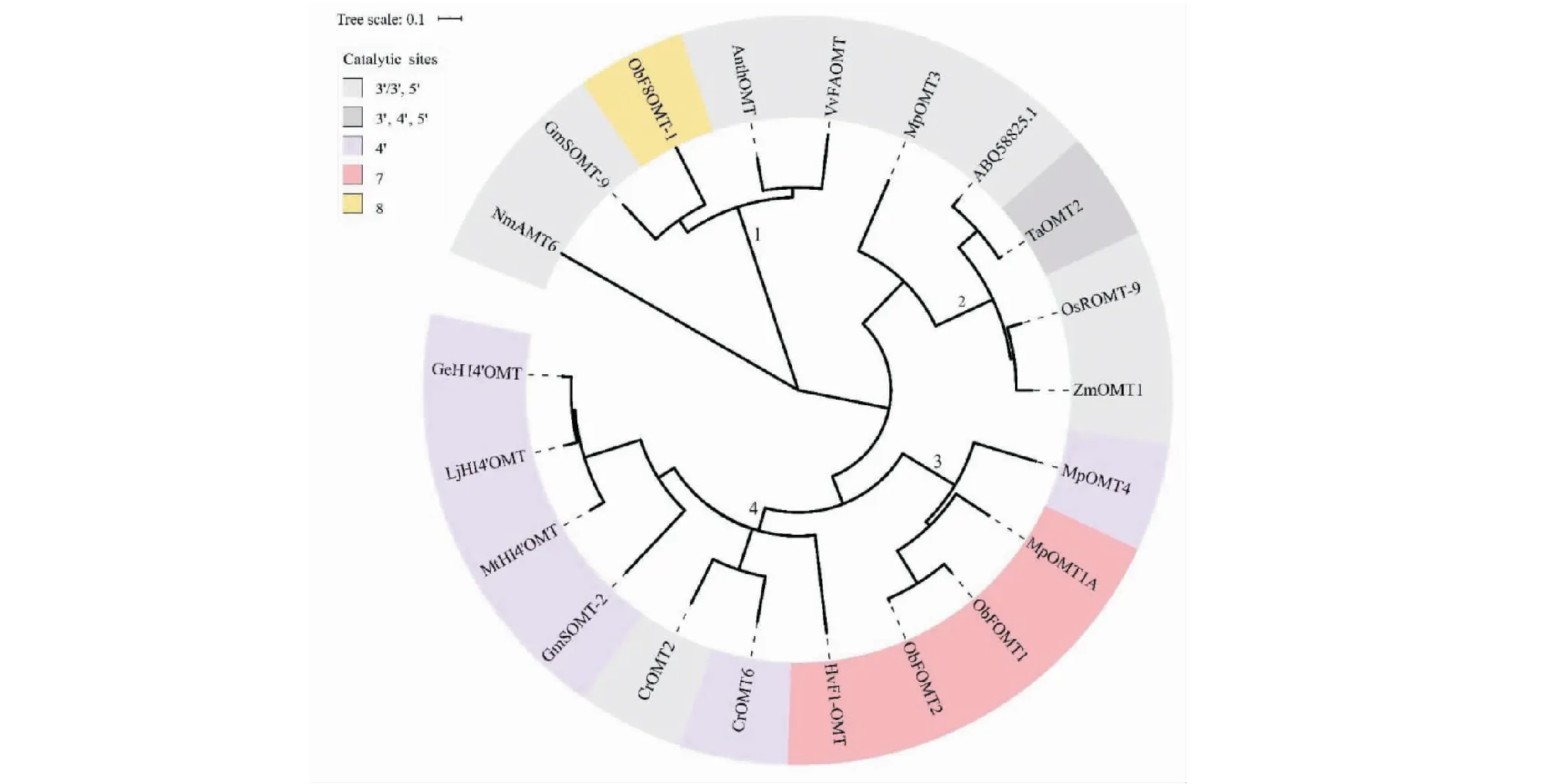
图3 不同物种FOMT进化树分析Fig.3 FOMT evolutionary tree analysis of different species
3.2 FOMT功能鉴定
在鉴定FOMT功能时,通常在原核生物大肠杆菌(Escherichiacoli)中过表达待鉴定基因,纯化出该基因编码的蛋白,再进行体外酶活实验验证FOMT功能。Itoh等[21]从台湾香檬(Citrusdepressa)中克隆了5个FOMT基因,其中CdFOMT5在大肠杆菌中成功表达为可溶性蛋白,体外酶活实验证实CdFOMT5可对槲皮素,柚皮素,(-)-表儿茶素和雌马酚的C-3、C-5、C-6和C-7位进行甲基化修饰。Liu等[50]从苔藓类植物Plagiochasmaappendiculatum中克隆了Pa4′OMT基因,在大肠杆菌中成功表达,并检测出Pa4′OMT蛋白具有催化芹菜素甲基化的活性。
3.3 FOMT基因的表达调控
近期研究表明,植物FOMT的表达,受环境与基因的双重调控。茉莉酸甲酯(MeJA)的可诱导葛根中PlOMT4基因表达上调,3′-O-甲基化异黄酮生物合成量增加[68]。小麦白粉病病原体可诱导大麦F1-OMT基因表达,促进芹菜素7-O-甲基转移酶发挥作用,生成甲基化抗毒素[54];而禾谷镰刀菌侵染大麦后,包括FOMT在内的丙烷类生物合成的酶的积累量增加,羟基肉桂酸酰胺和类黄酮含量增加,这使得植物细胞壁增厚,增强抗病能力[69]。在苜蓿中过表达IOMT基因,发现IOMT蛋白可将未受病原菌侵染的苜蓿叶片中的大豆苷元转化为7-O-甲基大豆苷元。此外,使用CuCl2诱导或用茎点霉(Phomamedicaginis)感染的IOMT过表达植株中,4′-O-甲基异黄酮(芒柄花素)含量升高[70]。
3.4 FOMT的应用
作为植物天然产物,许多O-甲基化类黄酮在植物体内的含量并不高,而化学合成步骤繁琐,操作不便。因此,许多研究者尝试通过生物合成方法实现O-甲基化类黄酮的大量生产。Lee等[71]构建了含3′-OMT(SlOMT3)/7-OMT(OsNOMT)融合蛋白的大肠杆菌,能够将槲皮素、木犀草素、圣草酚、二氢槲皮素,分别转化为甲基鼠李素、毡毛美洲茶素、2-O-甲基圣草酚、2-O-甲基二氢槲皮素。Berim等[72]构建了含FOMT的酵母菌株,其能够催化类黄酮底物产生柚皮素和木犀草素的O-甲基化衍生物。FOMT在O-甲基化类黄酮的生物合成过程中起着重要的调控作用。
4 前景展望
长期以来,植物类黄酮的药用价值和生物合成调控备受关注,但类黄酮的生物利用度低,使其在药用开发上受到限制。甲基化修饰可提高类黄酮的代谢稳定性与体内转运能力,提高生物利用度,弥补其在临床应用上的短板。近年来,植物O-甲基化类黄酮及FOMT研究成为热点,随着植物基因组学研究的深入,大量植物FOMT基因被发现,但得到充分功能验证的FOMT基因还为数不多。而现阶段对于FOMT的研究多采用体外酶催化、生化特征分析等手段,仅有少数FOMT基因进行了体内功能验证,有关FOMT基因表达调控的研究则更为匮乏。随着O-甲基化类黄酮与FOMT研究的深入,FOMT有望用于O-甲基化类黄酮的工厂化生产,为相关医药保健品生产提供高性价比原料;此外,O-甲基化类黄酮也是植物体内重要的抗逆代谢物,FOMT在绿色农药开发、作物抗性育种领域也具有较大的应用潜力。

