蜘蛛香中的环烯醚萜类化合物在巨噬细胞中的抗炎活性研究
姜明言,饶凯瑞,廖彩岑,刘 欢,李洪梅,李蓉涛,刘 丹
昆明理工大学 生命科学与技术学院,昆明 650500
炎症是对刺激、组织损伤和感染做出的一种正常保护性反应,是维持免疫系统稳态和愈合所必需的生理过程[1]。在炎症过程中,免疫系统产生高水平的促炎介质在宿主细胞防御中发挥重要作用[2,3]。然而,不受控制或长时间的炎症反应是产生机体损伤或慢性疾病如癌症、风湿性关节炎和血管疾病等的重要原因。单核细胞和巨噬细胞是天然免疫的重要防线也是一系列促炎细胞因子的重要来源。当巨噬细胞受到病原体或内源刺激时,它们分泌包括肿瘤坏死因子(TNF-α)、白细胞介素(IL-1、IL-6和IL-12)[4]在内的多种细胞因子,以及趋化因子、前列腺素、白三烯和补体等,所有这些炎症介质协同作用,增强血管通透性和招募免疫细胞。目前常用的非甾体抗炎药(NSAIDs)尚存在胃损伤、支气管痉挛、肾脏和心脏损伤等不良反应[5]。因此,从传统中药中发掘新的低毒副作用的天然抗炎药物具有重要的意义。
蜘蛛香ValerianajatamansiJones,系败酱科(Valerianaceae)缬草属(ValerianaL.)植物,主要分布于中国云南、贵州、四川等地,是我国多民族常用的传统草药。其根茎具有镇静安神、理气止痛、消炎止泻、祛风除湿等多重功效,可用于脘腹胀痛,跌打损伤,呕吐泄泻,风湿痹痛,月经不调,疮疖等症的治疗[6-8]。研究发现,其化学成分主要有环烯醚萜类,黄酮类,挥发油等[9-11]。药理学研究表明,主要成分之一环烯醚萜类化合物具有抗菌、抗氧化、抗病毒等作用。我们在前期研究中发现蜘蛛香中分离得到的环烯醚萜类化合物具有一定的抗流感病毒活性[12]。为了进一步寻找其中的活性物质,我们对该部位进行了系统的化学研究,对从中分离得到的14个环烯醚萜类化合物进行了抗炎活性检测,并对具有明显抗炎活性化合物的相关作用机制进行了进一步的研究。
1 材料与方法
1.1 材料
蜘蛛香的干燥根与根茎于2017年10月购自昆明市新螺蛳湾药材市场,由昆明理工大学钟金栋副教授鉴定为蜘蛛香ValerianajatamansiJones,标本存放于昆明理工大学生命科学与技术学院资源药物化学重点实验室(标本号为KUMST20171001)。
羟丙基葡聚糖凝胶(Sephadex LH-20)(Pharmacia公司);MCI CHP-20P(75~150 μm,日本Mitsubishi公司);脂多糖(LPS)(Sigma公司);胎牛血清(Hyclone公司);DMEM培养基(Thermofisher公司);Griess试剂、一氧化氮合酶抑制剂(L-NMMA)(碧云天公司);MTT、DMSO(Solarbio公司);ELISA试剂盒:IL-6、IL-1和TNF-α(R&D生物试剂公司,Minneapolis,USA);单克隆一抗和山羊抗兔二抗(Cell Signaling Technology,Beverly,MA,USA)。Agilent 1200型高效液相色谱仪(Agilent公司);VG Autospec-3000质谱仪(英国VG公司);CO2恒温培养(Thermofisher公司产品);Spectra Max M2多功能读板机(美国Moleccular Devices 公司)。
1.2 方法
1.2.1 提取和分离
干燥的蜘蛛香根及根茎20 kg,粉碎,在室温下95%乙醇冷浸提取3次(25 L×3),每次浸泡24 h。合并提取液,减压蒸馏浓缩将乙醇除去,分别用石油醚、乙酸乙酯和正丁醇萃取3次,合并得到相应的石油醚相(48.0 g)、乙酸乙酯相(64.0 g)和正丁醇相(58.0 g)。
乙酸乙酯相经80~100目硅胶65 g 拌样,200~300目硅胶290 g装柱,以石油醚-乙酸乙酯(80∶1、60∶1、40∶1、20∶1、10∶1、5∶1、3∶1、2∶1、1∶1、0∶1)进行梯度洗脱,得到4个部分,即Fr.1~Fr.4。Fr.1(21.4 g)用硅胶柱层析(石油醚-乙酸乙酯 40∶1)进行洗脱,进一步分为4个组分:Fr.1.1~Fr.1.4。Fr.1.1(460.0 mg)通过反复硅胶柱色谱并结合Sephadex LH-20(氯仿-甲醇1∶1)以及HPLC半制备(甲醇-水68%)纯化得到化合物4(5.0 mg,tR= 17.5 min)、5(2.5 mg,tR= 17.0 min)、7(13.1 mg)和10(6.2 mg)。Fr.1.2(320.0 mg)经反复硅胶柱色谱并结合Sephadex LH-20(氯仿-甲醇1∶1)得到化合物化合物1(5.0 mg)、3(3.1 mg)、8(9.0 mg)、9(4.0 mg)。Fr.1.3(420.0 mg)通过反复硅胶柱色谱并结合Sephadex LH-20(氯仿-甲醇1∶1)和HPLC半制备(68%甲醇-水)得到化合物2(6.5 mg)、6(9.0 mg,tR= 16.5 min)、11(20.0 mg)。Fr.2(10.8 g)通过硅胶柱层析(石油醚-乙酸乙酯20∶1)进行洗脱,进一步得到2个组分,即Fr.2.1和Fr.2.2。化合物14(34.5 mg)经硅胶柱层析(石油醚-丙酮 30∶1)从组分Fr.2.1(5.6 g)中纯化得到。Fr.2.2(4.4 g)经反复硅胶柱色谱得到化合物12(6.3 mg)和13(7.2 mg)。
1.2.2 细胞培养
小鼠单核巨噬细胞RAW264.7使用DMEM培养基(添加10%胎牛血清和1%青/链霉素双抗溶液)置于37 ℃,5% CO2培养箱中进行培养,每日观察细胞生长情况,取对数生长期的细胞进行后续实验。
1.2.3 化合物配置及毒性检测
取适量化合物干燥粉末溶于DMSO溶剂中,配置成浓度为50 mmol/L的母液保存于-20 ℃,使用时用培养基稀释配置成所需浓度,并保证DMSO终浓度不超过1‰。
将RAW264.7细胞以3×104/孔的密度接种至96孔板,37 ℃,5% CO2培养24 h。加入含不同终浓度化合物的培养液处理24 h,同时设置调零组和对照组(添加等浓度DMSO)。每孔加入20 μL MTT(5 mg/mL)溶液培养4 h后吸去上清并加入150 μL DMSO,避光振摇15 min使其充分溶解,酶标仪490 nm波长检测吸光度。
细胞存活率 =(OD实验组-OD调零组)/(OD对照组-
OD调零组)×100%
1.2.4 Griess法检测一氧化氮(NO)
RAW264.7细胞以6×104/孔的密度接种于96孔板,24 h后进行给药处理,并将细胞分为化合物处理组、模型组、空白对照组。化合物处理组添加所需浓度化合物和终浓度为1 μg/mL的LPS,模型组添加等浓度DMSO和终浓度为1 μg/mL的LPS,空白对照组只添加等浓度DMSO,每组3个复孔,作用24 h后,取上清液加入Griess试剂测定各组一氧化氮(nitricoxide,NO)含量。
NO生成抑制率 =(OD模型组-OD化合物处理组)/
(OD模型组-OD对照组)×100%
1.2.5 ELISA检测炎症因子的分泌
RAW264.7细胞以8×105个/孔接种于12孔板,分组处理方式同“1.2.4”。不同浓度的化合物预处理1 h后,加入1 μg/mL的LPS共同作用细胞18 h,收集细胞上清液,使用ELISA试剂盒检测上清溶液中TNF-α、IL-6 和IL-1β细胞因子的含量。
1.2.6 Western blotting分析
RAW264.7细胞以8×105个/孔接种于12孔板中培养24 h,分组处理方式同“1.2.4”。不同浓度的化合物预处理1 h,用LPS(1 μg/mL)分别刺激18 h(检测iNOS、COX-2、STAT3、NLRP-3)和30 min(检测MAPKs、NF-κB)后,加入裂解液进行细胞裂解。蛋白样品经10% SDS-PAGE凝胶电泳分离并转膜,4 ℃封闭1 h,一抗低温孵育过夜,之后室温孵育二抗1 h,加入ECL化学发光试剂,化学发光凝胶成像分析系统进行显影。
1.3 统计分析
用SPSS 21.0对试验数据进行单因素方差分析(Oneway Anova),图表中数据均用平均值±标准误差表示。当P<0.05时,认为具有统计学显著性差异。
2 结果和分析
2.1 结构鉴定
经NMR数据[12]与文献报道比对,确定化合物的结构,如图1所示。

图1 蜘蛛香中分离得到的化合物1~14的结构Fig.1 Structures of compounds 1-14 isolated from Valeriana jatamansi
2.2 化合物体外抑制NO生成结果
本文利用Griess法检测NO生成评估了14个化合物的体外抑制NO活性(见表1),化合物1、2、3、5、8、9对NO的生成具有明显的抑制作用,IC50分别为0.88、0.62、5.57、18.78、4.07、26.99 μmol/L。根据实验结果我们选择化合物1和2作为进一步的研究对象。
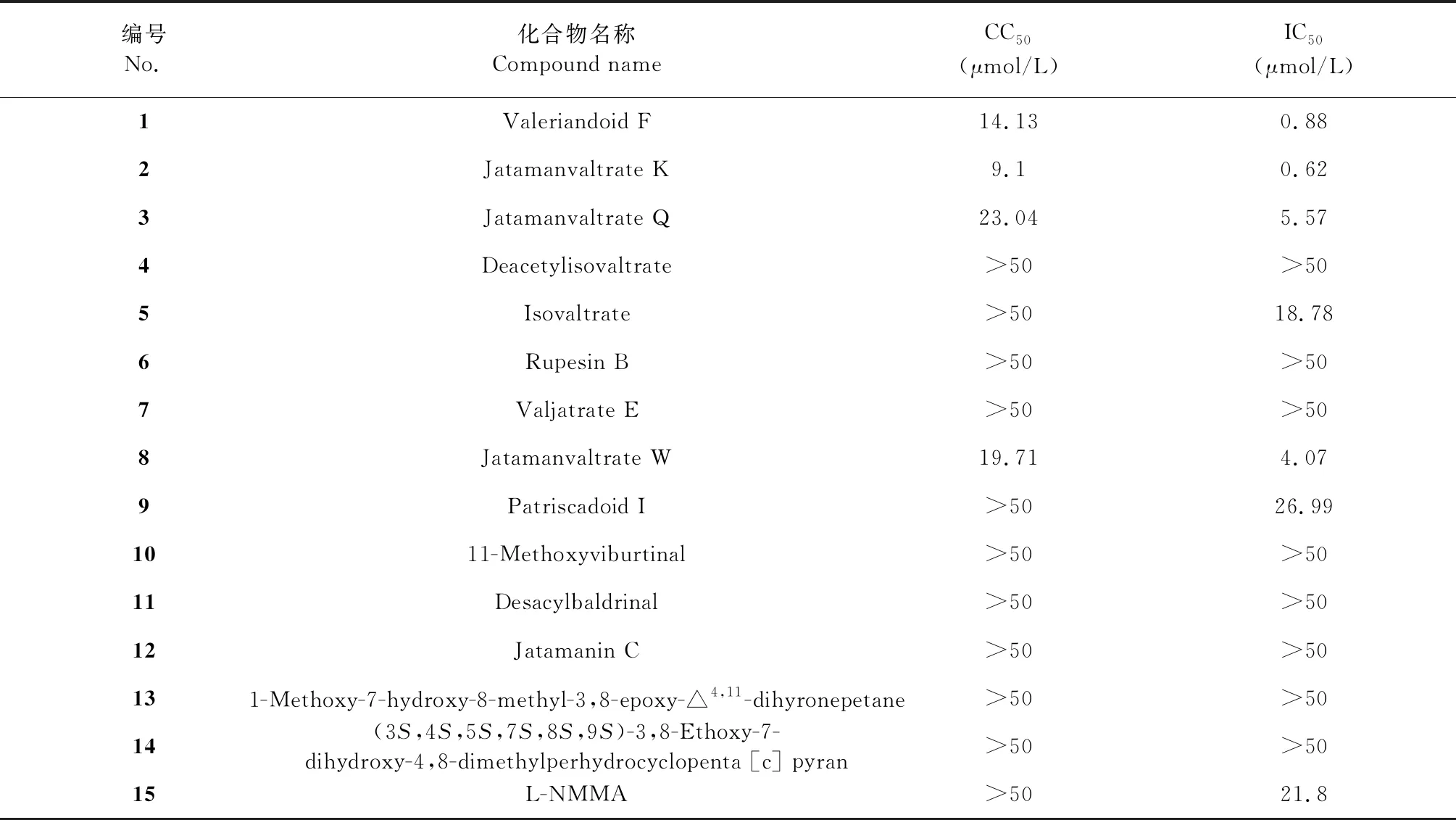
表1 化合物1~14对RAW264.7细胞的细胞活力及NO生成的影响
2.3 化合物1和2对RAW264.7细胞活力的影响
在测定化合物的抗炎活性之前,首先评估了化合物对细胞活力的影响。如图2所示,与空白对照组相比,化合物1和2浓度在0.4~3.2 μmol/L时对细胞存活率均无明显影响。而当化合物2达到6.4 μmol/L浓度时,RAW264.7巨噬细胞活性下降(P<0.05),在此浓度下化合物1没有表现出细胞毒性。
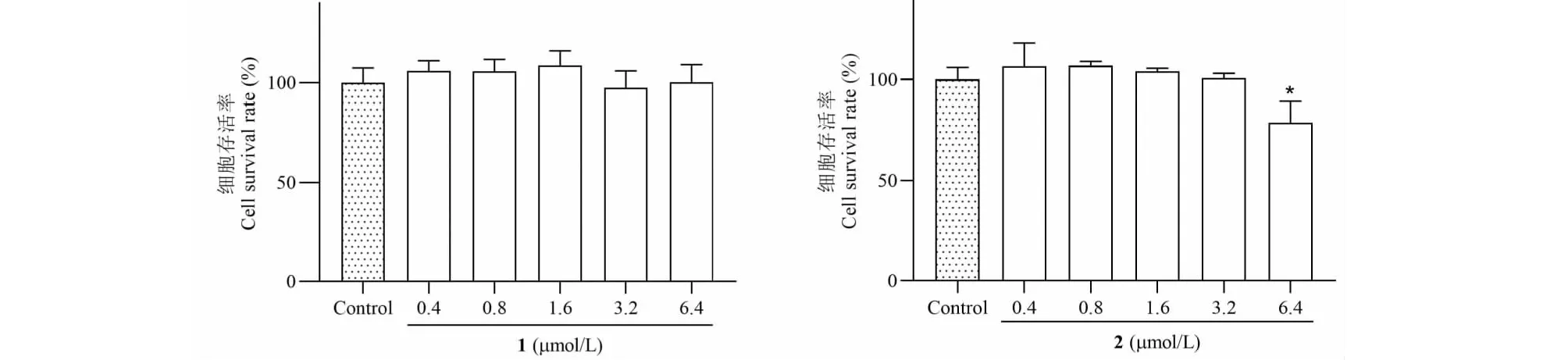
图2 化合物1和2对RAW264.7细胞活力的影响Fig.2 Effect of compounds 1 and 2 on cell viability in RAW264.7 cells注:与模型组对比,*P<0.05,**P<0.01,***P<0.001。Note: Compared with model proup,*P<0.05,**P<0.01,***P<0.001.
2.4 化合物1和2对NO生成及iNOS、COX-2蛋白表达的影响
当致炎因子如LPS刺激巨噬细胞会导致iNOS的高表达,进而诱导细胞产生大量的NO,同时,还能直接将COX-2催化位点硝基化而促使COX-2的活化[13]。如图3所示,与空白对照组相比,模型组RAW264.7细胞中NO的生成量显著增加(P<0.001);与模型组相比,化合物处理组(0.2、0.4、0.8、1.6和3.2 μmol/L)NO产生量受到明显抑制(P<0.05),呈剂量依赖性,IC50分别是0.88和0.62 μmol/L。同时免疫印迹研究结果表明,与空白对照组相比,模型组中关键蛋白酶iNOS、COX-2的表达显著上调(P<0.001),确认了炎症模型成立;而与模型组相比,化合物1和2(0.8、1.6、3.2 μmol/L)处理组iNOS、COX-2的表达均被显著抑制,并呈现良好的剂量依赖关系。

图3 化合物1和2对LPS诱导的RAW264.7细胞NO生成及iNOS和COX-2蛋白表达的影响Fig.3 Effects of compounds 1 and 2 on NO production,iNOS and COX-2 protein expression in LPS-induced RAW264.7 cells注:与空白对照组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。下同。Note: Compared with control,#P<0.05,##P<0.01,###P<0.001; Compared with model group,*P<0.05,**P<0.01,***P<0.001.The same below.
2.5 化合物1和2对IL-6、TNF-α分泌的影响
IL-6、TNF-α作为巨噬细胞分泌的重要的炎症因子,介导多种生物功能,参与对感染、损伤和炎症的应答。在LPS诱导的RAW264.7炎症模型中,化合物对炎症因子IL-6和TNF-α生成的影响是评价其抗炎活性的重要指标。如图4所示,与空白对照组相比,LPS诱导的巨噬细胞中,IL-6、TNF-α的产生量均显著升高(P<0.001);而化合物1和2在0.8~3.2 μmol/L浓度范围内均显著抑制IL-6和TNF-α的产生,且呈剂量依赖性。
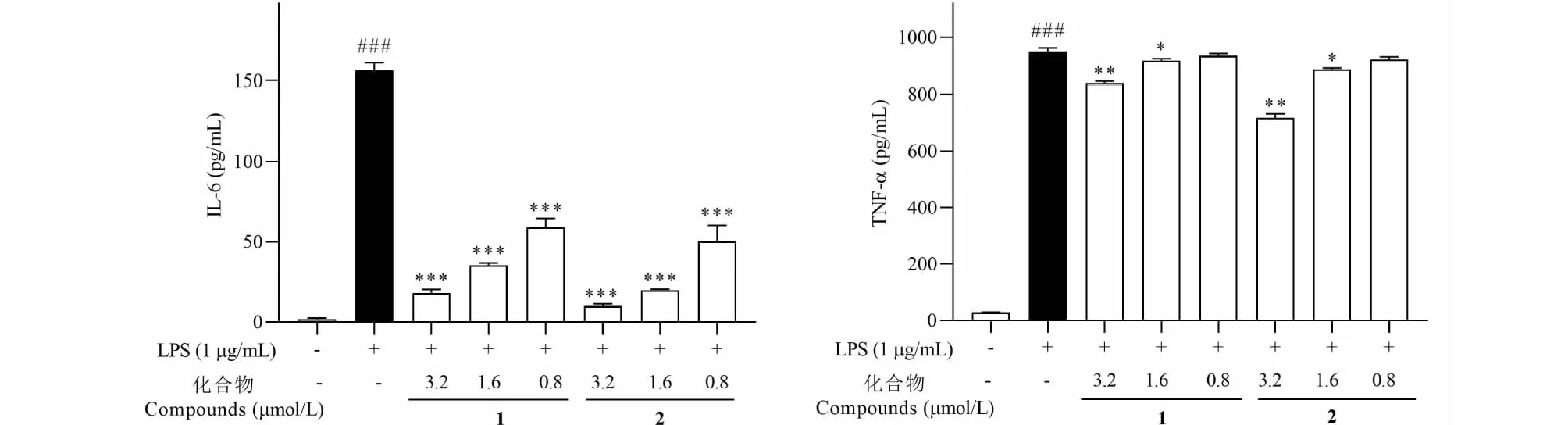
图4 化合物1和2对LPS诱导的RAW264.7细胞中IL-6和TNF-α生成量的影响Fig.4 Effects of compounds 1 and 2 on IL-6 and TNF-α production in LPS-induced RAW264.7 cells
2.6 化合物1和2对IL-1β分泌及NLRP3蛋白表达的影响
IL-1是吸引中性粒细胞,促进炎症介质释放以及引起发热的重要炎症介质。炎症小体NLRP3激活可通过活化caspase-1促进炎症因子IL-1β的分泌。如图5所示,LPS刺激导致IL-1β水平显著升高(P<0.001),而化合物处理组IL-1β的产生和分泌被显著抑制,差异具有统计学意义(P<0.001)。进一步的,对炎症小体NLRP3表达的检测结果显示,与空白对照组相比,LPS处理的细胞模型能显著诱导NLRP3蛋白的表达(P<0.01),而化合物1、2处理组NLRP3表达水平显著降低。提示了化合物对炎症小体生成的抑制作用。
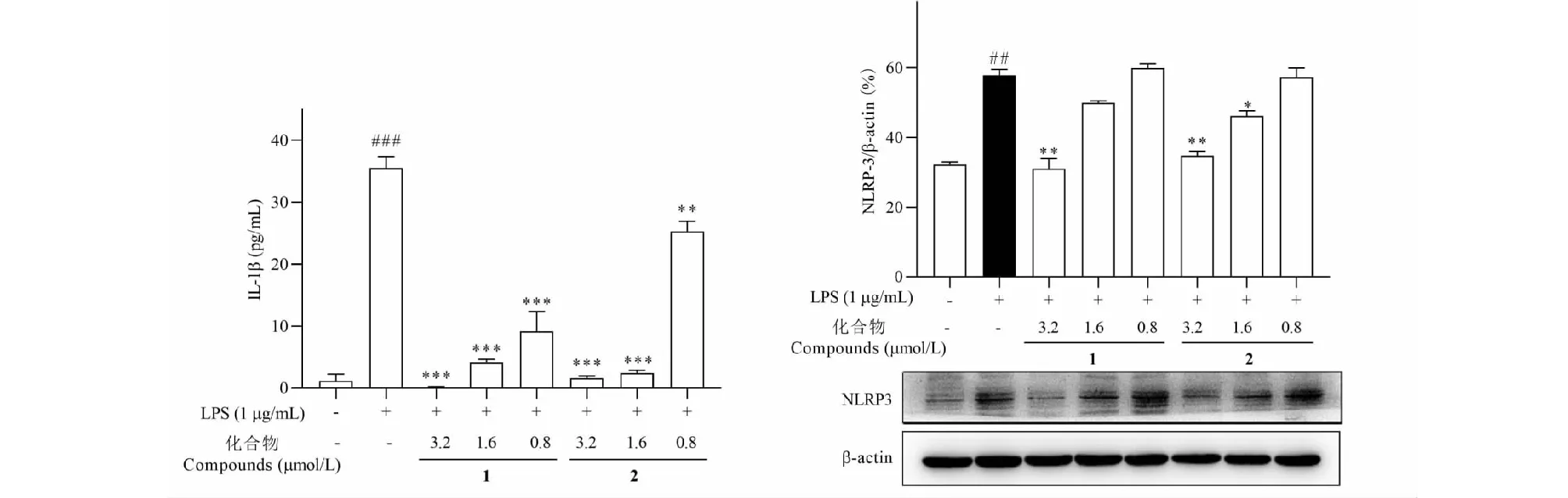
图5 化合物1和2对LPS诱导的RAW264.7细胞IL-1β分泌和NLRP3蛋白表达的影响Fig.5 Effects of compounds 1 and 2 on IL-1β secretion and NLRP3 protein expression in LPS-induced RAW264.7 cells
2.7 化合物1和2对NF-κB、MAPK信号通路的影响
免疫印迹检测化合物对LPS诱导的巨噬细胞中蛋白信号通路NF-κB、MAPK的影响。如图6所示,与空白对照组相比,LPS诱导的模型组能够显著上调细胞IκBα磷酸化水平(P<0.01),引起NF-κB信号通路的激活;化合物处理组对IκBα磷酸化水平表现出一定程度的抑制作用。同时,LPS刺激显著上调了ERK、p38MAPK和JNK的磷酸化水平,不同浓度的化合物处理均对p38MAPK、ERK、JNK的磷酸化和表达没有明显影响。
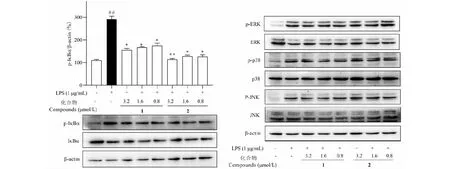
图6 化合物1和2对LPS诱导的RAW264.7细胞中NF-κB和MAPKs信号通路的影响Fig.6 Effects of compounds 1 and 2 on NF-κB and MAPKs signaling pathways in LPS-induced RAW264.7 cells
2.8 化合物1和2对mTOR/ STAT3通路的的影响
通过免疫印迹实验进一步检测化合物对mTOR和STAT3表达和激活的影响。与对照组相比,模型组mTOR和STAT3的磷酸化水平显著升高,提示该通路在LPS作用下发生了激活;而各剂量组的化合物1、2处理均可明显下调mTOR和STAT3的磷酸化水平(P<0.05),说明通路的激活受到明显抑制,且化合物对于STAT3磷酸化的抑制效果更为显著,如图7所示。

图7 化合物1和2对LPS诱导的RAW264.7细胞中STAT3、mTOR表达和磷酸化的影响Fig.7 Effects of compounds 1 and 2 on expression and phosphorylation of STAT3 and mTOR protein in LPS-induced RAW264.7 cells
3 讨论
巨噬细胞在免疫及炎症反应中扮演着至关重要的角色,在内、外界刺激激活时,诱导细胞MAPKs、NF-κB等相关信号通路的活化,进而调节下游的多种炎症相关基因的表达,推动级联瀑布反应,释放大量炎症因子进行防御[14]。而过度的免疫激活往往造成机体损伤,最终导致疾病进一步恶化。
iNOS、COX-2均为诱生型酶,在大多数组织中不表达或低表达,但在一些炎性细胞因子作用下可呈现高表达。iNOS广泛参与趋炎因子的表达以及反应性氮化、氧化产物的产生,在炎症病理发生发展中起关键作用。COX-2是催化花生四烯酸转化为前列腺素的一种关键酶,故在炎症诱导及维持过程中也具有重要作用。以上两者的表达以及炎症因子TNF-α和IL-1的产生均受转录因子NF-κB及STAT3的调控[15,16]。
非激活状态下,NF-κB与阻抑蛋白IκBα在细胞质中以复合体形式存在。许多细胞外配体(如TNF-α、IL-1、LPS等)可快速触发经典的NF-κB信号通路并进一步激活下游激酶,使IκBα发生磷酸化并进而泛素化降解,游离NF-κB转位入核,激活一系列的促炎靶基因,促进炎症因子及iNOS、COX-2的表达。STAT3在调控细胞生长、增殖、分化和凋亡等方面起重要作用,可被多种细胞因子和生长因子激活,如IL-6和EGF/EGFR等,其两个关键的磷酸化位点705位酪氨酸和727位的丝氨酸,受mTOR、MAPKs、PKC多通路的调节。mTOR作为一种参与蛋白和脂质合成、自噬、糖酵解和炎症在内的多种生命进程的重要调控因子[17],其磷酸化可显著激活STAT3,而活化的STAT3进一步诱发下游炎症基因的表达,释放IL-6、C3等,进一步反馈刺激STAT3信号通路,形成持续的炎症微环境[18],是造成炎症迁延和细胞因子风暴的重要原因。
此外,炎症小体作为一类胞浆蛋白复合物,是人体天然免疫系统的重要组成部分,在多种炎症相关疾病的发生发展过程中都发挥了关键作用。其中NLRP3炎症小体是目前研究最为广泛的炎症小体类型。而炎症小体NLRP3的激活失控可通过活化caspase-1促进炎症因子IL-1的过量分泌,是造成炎性机体损伤的重要原因之一[19]。
因此,以上介质和信号通路均被认为是预防及治疗炎症性疾病[20]的药物靶点并且相互之间存在着密切的联系和协同作用。本研究对从蜘蛛香中分离获得的14个环烯醚萜类化合物进行了抗炎活性筛选,发现化合物1、2、3、5、8、9具有明显的抗炎活性,我们重点关注了巨噬细胞炎症模型中环烯醚萜类化合物1和2的负性调控作用。研究发现化合物1、2明显减轻LPS诱导的炎症因子NO、IL-1、IL-6及TNF-α的分泌,导致iNOS、COX-2、NLRP3的表达量降低。进一步的实验研究结果显示,化合物1、2处理抑制了LPS刺激的IκBα磷酸化,从而有效的抑制NF-kB信号通路被激活。同时化合物对于mTOR、STAT3磷酸化的抑制进一步减轻了炎症介质的分泌及其后续产生的反馈作用。
综上所述,化合物1和2对LPS诱导的巨噬细胞炎症反应具有负向调控作用,其通过下调NF-κB及mTOR/STAT3信号通路,抑制炎症小体生成并显著降低iNOS、COX-2的表达从而调控NO和各种炎症因子的释放,表现出良好的抗炎活性。本研究表明蜘蛛香中以化合物1和2为代表的环烯醚萜类化合物具有显著的抗炎活性,很可能是蜘蛛香在传统用药中良好抗炎作用的主要活性成分。本研究为蜘蛛香在抗炎方面功效的综合开发与利用提供实验基础和科学理论依据。

