新型异噻唑酰胺类化合物的设计、合成及其杀菌活性研究
张石鑫,裴鸿艳,郎钰莹,张熹晗,张 坡,张 静,张立新
(沈阳化工大学 功能分子研究所 辽宁省绿色功能分子设计与开发重点实验室, 辽宁 沈阳 110142)
异噻唑类化合物于1959年由Adams和Slack首次发现并报道[1],在农药领域,主要用作杀菌剂.该类化合物目前已有5个商品化品种(如图1所示):噻霉酮(benziothiazolinone)、烯丙异噻唑(oryzaemate)、异噻菌胺(isotianil)、dichlobentiazox及benclothiaz.噻霉酮由陕西西大华特科技实业有限公司独家研制,目前仅在国内使用,主要用于防治黄瓜霜霉病、梨黑星病、苹果疮痂病、柑橘炭疽病、葡萄黑痘病等多种细菌、真菌性病害[2];烯丙异噻唑是由日本明治制果株式会社开发的一种杀菌剂,可防治水稻稻瘟病和叶枯病,并具有良好的内吸活性和植物激活性能[3];异噻菌胺由拜尔公司研制[4],2010年在韩国上市,其商品名为Routine,主要用于水稻稻瘟病的防治[5];Dichlobentiazox是由日本组合化学开发的一种苯并噻唑类杀菌剂,主要用于水稻稻瘟病的防治[6];Benclothiaz是由先正达公司报道的一个具有杀线虫作用的化合物,也可用于防治根瘤病[7].

图1 已商品化的异噻唑类化合物Fig.1 Commercialized isothiazole
杀菌剂的使用是防治植物病害的重要手段,其中酰胺类杀菌剂在作物病害防治历史中具有举足轻重的地位.酰胺类杀菌剂的作用机制主要为通过影响病原菌的呼吸链电子传递系统而达到抑制病原菌的生长,从而导致病原菌死亡[8];自成功开发以来,该类化合物作为杀菌剂已经有50多年的历史,其代表品种有氟吡酰菌胺和啶酰菌胺等(如图2所示).
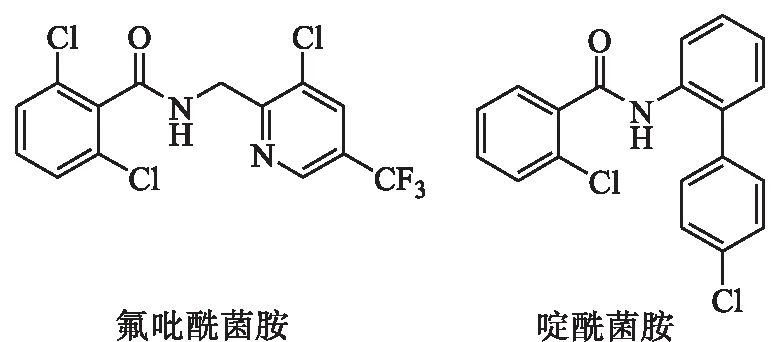
图2 氟吡酰菌胺和啶酰菌胺化学结构式Fig.2 Chemical structures of fluoplcollde and boscalid
然而,随着简单重复单一用药模式的不断增强,现有的酰胺类杀菌剂抗性问题日益突出,不断研发新型结构、新型作用机制的酰胺类杀菌剂则是解决这一难题的有效途径.因此,本文选取异噻唑类化合物4-氨基-3-苯基-5-异噻唑甲酸乙酯(由美国FMC公司公开,具有良好的杀线虫活性[9])作为先导化合物,并结合酰胺类杀菌剂的骨架特点,采用活性亚结构拼接[10]、生物电子等排[11]策略,在4-氨基-3-苯基-5-异噻唑甲酸乙酯中引入酰胺类结构,设计、合成了一系列结构新颖的异噻唑酰胺类化合物(如图3所示,式中R的具体取代情况见表1),并对所合成的化合物进行了一系列杀菌活性测定.
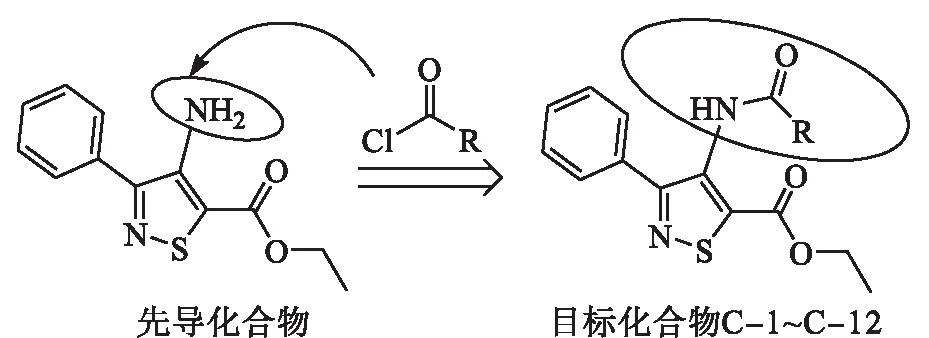
图3 目标化合物C-1~C-12的设计思路Fig.3 Design idea of compound C-1~C-12
根据药物辅助设计理论和活性亚结构拼接、生物活性等排原理推测异噻唑酰胺类杀菌剂在引入脂肪链与芳香链后logP值改变,随着烷基链的延长,logP值增大,亲脂性增强,渗透能力增加;在结构中引入氟原子能增加有机分子的亲脂性,由于氟原子能增加分子的亲脂性,使得含氟化合物在生物体内对膜、组织的穿透能力增加;引入氟原子可以在一定程度上改变药物的物理化学性质、提高药物代谢稳定性、改善药物作用时间、增强药效、消除活性代谢中间体等.另外此类杀菌剂作用机制新颖,对作用靶标可能具有一定的选择性.
1 实验部分
1.1 仪器与试剂
核磁共振仪,BRUKER Avance 300 MHz型,瑞士BRUKER公司;LC-MSD-Trap-VL&Agilent LC-MS 6130,安捷伦科技有限公司;全自动熔点测定仪,济南海能仪器股份有限公司;BUCHI R-100型旋转蒸发仪,瑞士BUCHI公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司.
实验所用试剂均为市售化学纯或分析纯.
1.2 目标化合物的合成
目标化合物C-1~C-12的合成路线如图4所示.
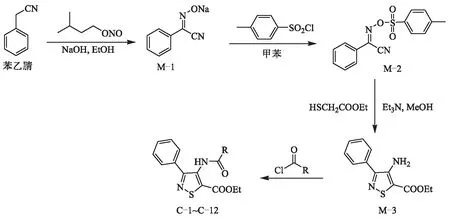
图4 目标化合物C-1~C-12的合成路线Fig.4 Synthesis routes of compounds C-1~C-12
1.2.1 中间体的合成
1.2.1.1 苯甲酰腈肟钠盐(M-1)的合成
称取苯乙腈23.41 g(0.20 mol)、氢氧化钠8.15 g(0.20 mol)放入装有机械搅拌、温度计和尾气吸收装置的1000 mL三口瓶中,加入150 mL无水乙醇后,降温至10~20 ℃.在此温度下,向其中缓慢滴加含有28.11 g(0.24 mol)亚硝酸异戊酯的无水乙醇溶液50 mL.滴加完毕后,撤去冰浴,室温下继续反应2.5 h.TLC监测反应完毕后向反应液中加入200 mL无水乙醚,搅拌30 min后过滤,滤饼用无水乙醚洗涤,空气干燥、真空干燥(70~80 ℃)后得白色固体15.31 g,熔点286~288 ℃,质量分数98.13 %,收率44.74 %.
1.2.1.2 1-(4-甲基苯磺酰基氧胺基)苯乙腈(M-2)的合成
称取苯甲酰腈肟钠盐(M-1)14.55 g(87.00 mmol)和对甲苯磺酰氯16.51 g(87.00 mmol)放入500 mL的两口瓶中,加入130 mL甲苯,升温至回流,反应3 h.TLC监测反应完毕后冷却至室温,加入200 mL乙酸乙酯稀释,有机层依次用100 mL水、100 mL饱和食盐水洗涤,无水硫酸镁干燥、过滤、减压脱溶后得黄色固体22.11 g,熔点130~132 ℃,质量分数97.15 %,收率82.67 %.
1.2.1.3 4-氨基-3-苯基-5-异噻唑甲酸乙酯(M-3)的合成
将1-(4-甲基苯磺酰基氧胺基)苯乙腈(M-2)22.10 g(74.00 mmol)、巯基乙酸乙酯10.68 g(89.00 mmol)放入装有机械搅拌、温度计和尾气吸收装置的1000 mL三口瓶中,加入200 mL甲醇后置于冰浴下操作.搅拌下向其中缓慢滴加三乙胺14.95 g(148 mmol),滴加过程中维持反应温度不超过40 ℃.滴加完毕后撤去冰浴,室温下再继续反应3 h.TLC监测反应完毕后加入150 mL乙酸乙酯稀释,有机层依次用100 mL水、100 mL饱和食盐水洗涤,无水硫酸镁干燥、过滤、减压脱溶,残余物柱层析(洗脱剂为体积比1∶10的乙酸乙酯/石油醚)纯化,得白色固体11.88 g,熔点46~48 ℃,质量分数95.33 %,收率61.99 %.
1.2.2 目标化合物的合成
合成通法1:以化合物C-1为例,其合成路线为
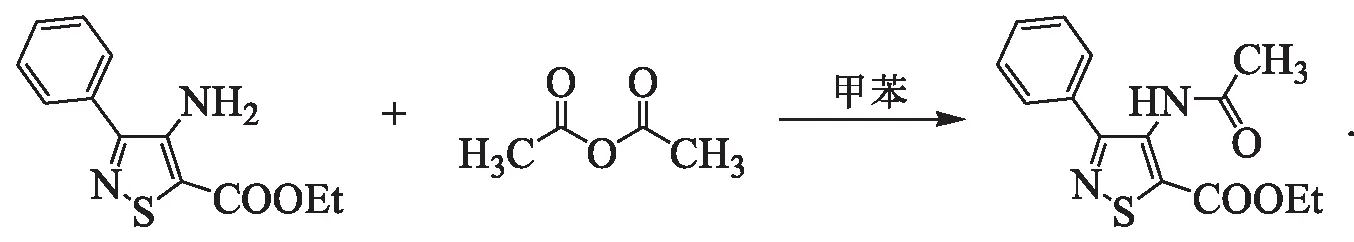
将0.51 g(2.06 mmol)M-3与0.25 g(2.45 mmol)乙酸酐溶于10 mL甲苯中,回流反应5 h.TLC监测反应完毕后冷却至室温,减压脱溶,柱层析(洗脱剂为体积比1∶10的乙酸乙酯/石油醚)纯化,得白色固体0.56 g,熔点108~110 ℃,质量分数97.38 %,收率91.54 %.
合成通法2:以化合物C-12为例,其合成路线为
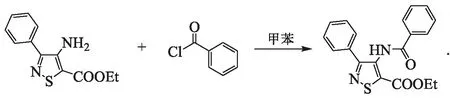
将0.43 g(1.73 mmol)M-3与0.28 g(2.00 mmol)苯甲酰氯溶于10 mL甲苯中,回流反应5 h.TLC监测反应完毕后冷却至室温,减压脱溶、柱层析(洗脱剂为体积比1∶10的乙酸乙酯/石油醚)纯化,得白色固体0.58 g,熔点76~78 ℃,质量分数95.53 %,收率90.84 %.
采用通法1合成化合物C-1~C-3;采用通法2合成化合物C-4~C-12.
化合物C-1~C-12的化学结构、理化性质及反应收率见表1.
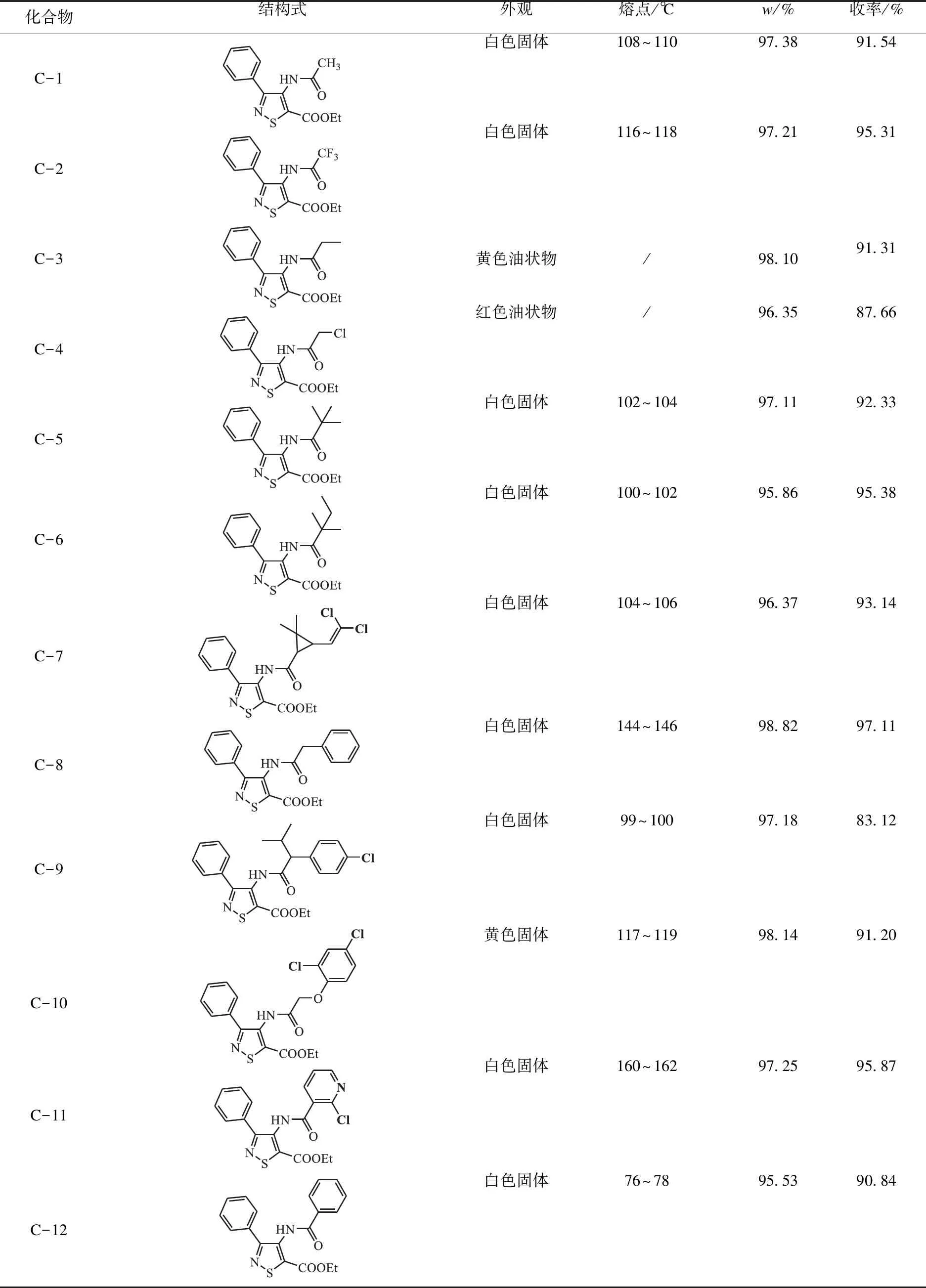
表1 化合物C-1~C-12物化常数Table 1 Physicochemical data of compounds C-1~C-12
1.3 杀菌活性测定
活体保护活性测定:采用活体盆栽测定方法.待测化合物原药用少量丙酮[V(丙酮)/V(喷液)=0.05]溶解,用含有0.1 %(体积分数,下同)吐温80的水稀释至质量浓度400 mg/L、100 mg/L、25 mg/L和6.25 mg/L的待测液.喷雾施药到植物试材上,24 h后进行病害接种.接种后,将植物放在人工气候室中培养,24 h后将植物试材移入温室培养.待对照充分发病后(通常为1周时间)进行化合物防病效果评估.
离体杀菌活性测定:待测化合物原药用DMSO溶解,配制成质量浓度2000 mg/L的待测液.取适量待测液加到96孔培养板的小孔中,再将79 μL病原菌孢子或孢子囊悬浮液加入其中,配制质量浓度为25 mg/L、8.3 mg/L、2.8 mg/L和0.9 mg/L的待测液,处理后放置培养箱中培养.24 h后进行调查,调查时目测每个处理的孢子或孢子囊萌发情况,并根据DMSO处理的萌发情况,评价化合物抑菌率.
2 结果与讨论
2.1 目标化合物的结构表征
合成的目标化合物均经1H-NMR及LC-MS确证,C-1~C-12的表征数据如下所示.
C-1,1H-NMR(300 MHz,CDCl3),δ:8.19(bs,1H,NH),7.58~7.78(m,2H,3,5-2H),7.41~7.44(m,3H,2,4,6-3H),4.41(q,J=7.2 Hz,2H,CH2),2.12(s,3H,COCH3),1.41(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):291.1[M+1].
C-2,1H-NMR(300 MHz,CDCl3),δ:9.02(s,1H,NH),7.59~7.64(m,2H,3,5-2H),7.42~7.46(m,3H,2,4,6-3H),4.45(q,J=7.2 Hz,2H,CH2),1.42(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):344.8[M+1].
C-3,1H-NMR(300 MHz,CDCl3),δ:8.24(s,1H,NH),7.65~7.68(m,2H,3,5-2H),7.38~7.42(m,3H,2,4,6-3H),4.39(q,J=6.9 Hz,2H,OCH2),2.33(q,J=7.2 Hz,2H,COCH2),1.39(t,J=6.9 Hz,3H,CH3),1.14(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):304.7[M+1].
C-4,1H-NMR(300 MHz,CDCl3),δ:9.12(s,1H,NH),7.66~7.69(m,2H,3,5-2H),7.43~7.47(m,3H,2,4,6-3H),4.44(q,J=7.2 Hz,2H,OCH2),4.11(s,2H,CH2),1.42(t,J=7.2 Hz,3H).LC-MS(m/z):326.2[M+1].
C-5,1H-NMR(300 MHz,CDCl3),δ:8.65(s,1H,NH),7.63~7.65(m,2H,3,5-2H),7.37~7.40(m,3H,2,4,6-3H),4.41(q,J=7.2 Hz,2H,CH2),1.41(t,J=7.2 Hz,3H,CH3),1.25(s,9H,3CH3).LC-MS(m/z):332.9[M+1].
C-6,1H-NMR(300 MHz,CDCl3),δ:8.73(s,1H,NH),7.64~7.65(m,2H,3,5-2H),7.39~7.41(m,3H,2,4,6-3H),4.42(q,J=6.9 Hz,2H,OCH2),1.59(q,J=7.2 Hz,2H,CH2),1.41(t,J=6.9 Hz,3H,CH3),1.20(s,6H,2CH3),0.83(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):347.2[M+1].
C-7,1H-NMR(300 MHz,CDCl3),δ:8.62(s,1H,NH),7.70~7.71(m,2H,3,5-2H),7.40~7.42(m,3H,2,4,6-3H),6.08(d,J=7.8 Hz,1H,C===CH),4.43(q,J=7.5 Hz,2H,OCH2),2.19~2.21(m,2H,2CH),1.43(t,J=7.5 Hz,3H,CH3),1.31(s,3H,CH3),1.10(s,3H,CH3).LC-MS(m/z):439.9[M+1].
C-8,1H-NMR(300 MHz,CDCl3),δ:7.53~7.56(m,2H,3,5-2H),7.39~7.46(m,3H,2,4,6-3H),7.22~7.28(m,3H,Ph-3′,4′,5′-3H),7.02~7.05(m,2H,Ph-2′,6′-2H),4.22(q,J=7.2 Hz,OCH2),3.87(s,2H,CH2),1.30(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):367.3[M+1].
C-9,1H-NMR(300 MHz,CDCl3),δ:8.42(s,1H,NH),7.39~7.41(m,4H,Ph-2′,3′,5′,6′-4H),7.28~7.31(m,1H,3-H),7.18~7.22(m,4H,2,4,5,6-4H),4.38(q,J=7.5 Hz,CH2),2.25~2.38(m,1H,CH),1.38(t,J=7.5 Hz,3H,CH3),1.08(d,J=6.6 Hz,1H,CH),1.00(d,J=6.6 Hz,3H,CH3),0.70(d,J=6.3 Hz,3H,CH3).LC-MS(m/z):444.3[M+1].
C-10,1H-NMR(300 MHz,CDCl3),δ:8.28(bs,1H,NH),7.46~7.49(m,1H,Ph-3′-H),7.39~7.40(m,2H,3,5-2H),7.18~7.19(m,3H,2,4,6-3H),6.99(d,J=8.7 Hz,1H,Ph-5′-H),6.78(d,J=8.7 Hz,1H,Ph-6′-H),4.68(s,2H,COCH2),4.27(q,J=7.2 Hz,2H,OCH2),1.29(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):451.8[M+1].
C-11,1H-NMR(300 MHz,CDCl3),δ:9.08(bs,1H,NH),8.51(d,J=8.7 Hz,1H,pyridine-4-H),8.07(d,J=6.3 Hz,1H,pyridine-6-H),7.57~7.77(m,2H,3,5-2H),7.43~7.45(m,3H,2,4,6-3H),7.27~7.47(m,1H,pyridine-5-H),4.43(q,J=7.2 Hz,2H,CH2),1.41(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):389.2[M+1].
C-12,1H-NMR(300 MHz,CDCl3),δ:9.26(s,1H,NH),7.88~7.91(m,2H,Ph-2′,6′-2H),7.76~7.79(m,2H,Ph-3′,5′-2H),7.56~7.59(s,1H,Ph-4′-H),7.47~7.52(m,2H,3,5-2H),7.39~7.41(m,3H,2,4,6-3H),4.41(q,J=7.2 Hz,2H,CH2),1.40(t,J=7.2 Hz,3H,CH3).LC-MS(m/z):353.3[M+1].
2.2 目标化合物的杀菌活性
化合物C-1~C-12杀菌试验结果见表2、表3.
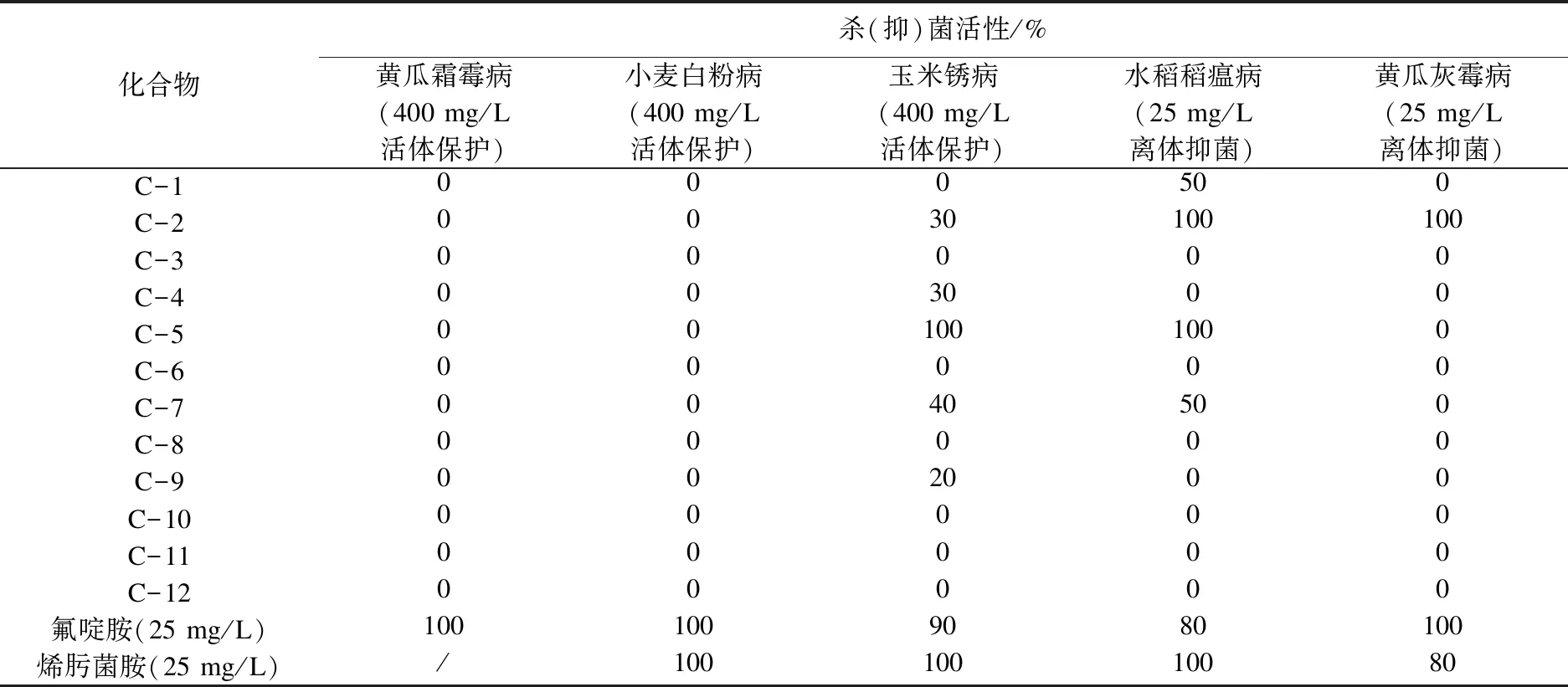
表2 目标化合物的杀(抑)菌活性研究初筛试验Table 2 Primary screening test on bactericidal(inhibitory) activity of target compounds
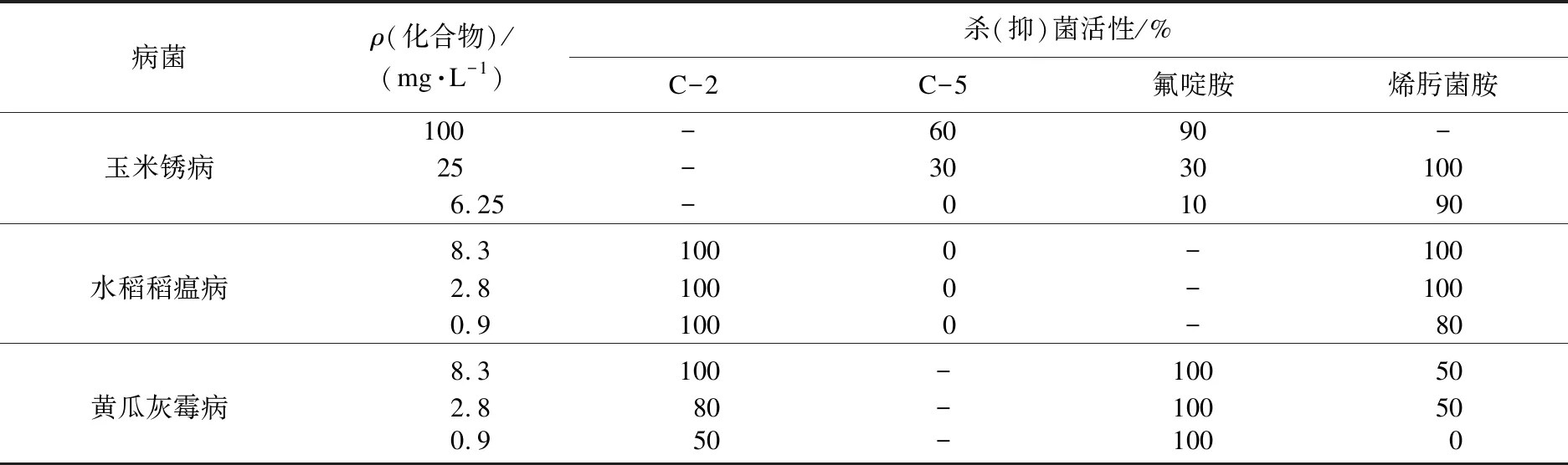
表3 目标化合物的杀(抑)菌活性研究复筛试验Table 3 Rescreening test on bactericidal(inhibitory) activity of target compounds
由表2、表3可以看出:目标化合物C-1~C-12对玉米锈病、水稻稻瘟病、黄瓜灰霉病具有一定的抑菌活性,而对于黄瓜霜霉病、小麦白粉病基本无效;就整体而言,R为脂肪链片段的化合物(C-1~C-7)活性高于R为含芳香族片段的化合物(C-8~C-12);化合物C-2在质量浓度为0.9 mg/L下对水稻稻瘟病的杀菌活性可达100 %,在2.8 mg/L下对黄瓜灰霉病的杀菌活性可达80 %;化合物C-5在质量浓度为400 mg/L和25 mg/L下分别对玉米锈病和水稻稻瘟病的杀菌活性均可达到100 %;然而当试验剂量进一步降低后,化合物C-5对玉米锈病和水稻稻瘟病基本无效.
3 结 论
综合以上杀菌活性测试结果分析,目标化合物C-1~C-12中含芳香族片段的化合物活性较差,推测可能的原因是芳香族片段空间位阻大,与靶点结合度差,无法进入到作用位点;而含脂肪链片段的化合物活性相对较好,尤其是化合物C-2具有明显优良的杀菌活性,推测应是三氟甲基基团起到了关键作用。化合物C-2可作为先导化合物进行深入研究,例如可以进一步考察引入多个氟原子,以期待发现具有更高杀菌活性的异噻唑酰胺类化合物.

