正阳县花生根瘤菌遗传多样性及其共生特性研究
张俊杰,彭姗姗,余辉,李硕,杨超,尚益民
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450002;2.正阳县花生研究所,河南 正阳 463600)
随着生态农业的深入发展,传统农业生产方式向着节能、减排的环境友好型农业生产方式转变[1-2]。施用有机肥可以维持农作物的产量和土壤肥力,同时改善长期施用化肥造成的土壤板结及环境恶化等问题[3]。土壤中氮元素主要通过生物固氮方式获得。生物固氮对改善土壤营养状况、解决农业和能源的可持续发展问题起着十分重要的作用[4]。花生(ArachishypogaeaL.)是全世界主要的粮食作物之一,也是蛋白质和油脂的重要来源,具有较高的经济价值[5]。与其他豆科植物一样,花生能与土壤中的根瘤菌建立互利共生的关系。豆科植物可以从空气中吸收大部分氮,而花生以共生固氮方式能获得其总氮需求量的55%[6-8]。因此,筛选高效的花生根瘤菌是促进根瘤菌作为土壤菌剂以及减少化学肥料使用的关键[9]。此外,花生的基因型、根瘤菌株和环境条件对于氮固定效率的影响很大[10-13],这种可变性与共生菌和宿主植物的识别能力相关[14-16],反映出宿主复杂的进化历史以及共生体为适应特定的宿主和地理区域发生的共生基因水平转移[17-18]。
目前,有关花生根瘤菌多样性的研究较多,并报道了一些共生根瘤菌种群[19-21]。然而,河南省花生根瘤菌多样性尚未得到系统调查,仅在其他省份研究的同时涉及到少数菌株,并被鉴定为慢生根瘤菌属(Bradyrhizobium)[22-23]。河南省花生种植面积居中国首位,而河南省正阳县又多次被评为“全国花生种植第一大县”[24]。目前,正阳县与中国工程院院士张新友团队合作,引入优质高产抗病品种远杂9102,大面积种植,产量显著提高[25]。因此,对当地共生根瘤菌种群的分布以及能与当地花生品种建立高效共生关系的花生根瘤菌进行研究就十分重要。本研究选取从河南省正阳县土壤分离出的花生根瘤菌作为研究对象,通过对该地区共生根瘤菌的捕捉和鉴定,调查遗传多样性,对于该地区高效优良花生根瘤菌菌种的选育以及提高花生产量意义重大。
1 材料与方法
1.1 材料与试剂
供试花生种子为远杂9102,由河南省农业科学院棉花油料作物研究所提供。供试土壤取自河南省正阳县陡沟镇周湾村的潮土(ZA)和水稻土(ZB),其中潮土取自小麦和花生轮作模式的农田,水稻土取自小麦和水稻轮作模式的农田。试剂均购自天津市科密欧化学试剂有限公司,分析纯。
1.2 采样点土壤理化性质的测定
采样点的土壤经过粉碎过2 mm筛,收集约100 g土壤样品。理化性质的测定委托河南省百恩信技术检测公司完成。利用SPASS v16.0数据分析软件分析测定结果。
1.3 花生根瘤菌的捕捉与分离
花生种子在无菌条件下用体积分数95%乙醇处理30 s,质量分数0.2%的升汞消毒5 min,无菌水清洗7~8次,保持暗培养环境,28 ℃培育至种子萌发后加入植物低氮营养液,蛭石拌匀,间歇灭菌。采用双层钵装置种植花生,上层钵体中装入无菌蛭石并移种发芽种子,下层钵体中储水,中间靠纱布条连接,为植株生长提供水分。栽种完成后将其置于人工气候培养箱(杭州汇尔仪器设备有限公司,RIH-1000B),生长45 d,将花生根部取出,剪下根瘤进行消毒处理。逐个捣碎根瘤,在YMA固体培养基(配方见文献[26])上“Z”字形画线,28 ℃恒温培养箱中暗培养,直至长出单菌落。
1.4 花生根瘤菌DNA的提取
参照TEREFEWORK[27]的标准方法,在TY液体培养基(配方见文献[27])上接种菌株单菌落,28 ℃培养7 d,使用台式离心机(上海安亭科学仪器厂,TGL-16G)12 000 r·min-1离心1 min收集菌体,经异硫氰酸胍(GUTC,北京索莱宝有限公司,分析纯)裂解,硅藻土吸附,最后用双蒸水溶解,获得供试菌株的基因组,再经琼脂糖凝胶电泳检测,检测通过的样品于-20 ℃保存。
1.5 16S-23S rRNA基因间隔区段的PCR-RFLP
IGS PCR扩增使用引物IGS 1490/132′[28],由上海生工生物工程股份有限公司合成。PCR产物用琼脂糖凝胶电泳检测,于-20 ℃保存。
IGS PCR产物选用3 种限制性内切酶(MspⅠ、AluⅠ和HaeⅢ,上海生工生物工程股份有限公司)进行酶切[28]。所有酶切产物用琼脂糖凝胶检测,用DNI 凝胶成像系统(DNI bio-imaging system,MiniBIS Pro)记录酶切结果,对大于100 bp的酶切条带标注后进行分析,根据酶切条带的数量及大小分别进行分型。
1.6 代表菌株16S rRNA 的序列测定和系统发育分析
参照张俊杰[28]的方法,根据捕捉分离的花生根瘤菌IGS分型结果,结合2个采样地点的分布情况挑选代表菌株,以采样点代号和数字命名,然后使用引物P1/P6进行16S rRNA基因扩增[28]。所有代表菌株的PCR产物通过琼脂糖凝胶检测,由上海生工生物工程股份有限公司完成测序。将经DNAMAN软件拼接后完整的16S rRNA序列与GenBank数据库中同源序列进行比对,选择相似性较高的同源序列,保存FASTA格式在文本文档中。选用MEGA 7.0软件的Clustal W功能进行序列比对,构建Maximum Like hood(ML)系统发育树。
1.7 代表菌株持家基因和共生基因PCR扩增测序和系统发育分析
所有供试代表菌株进行持家基因(recA、atpD、glnII)和共生基因(nodA、nifH)的 PCR扩增[28],recAPCR使用引物recA41F/640R;atpD PCR使用引物atpD225F/782R;glnIIPCR使用引物glnII12F/689R;nodAPCR使用引物nodA-1/-2[29];nifHPCR使用引物nifHF/R。所有代表菌株的PCR产物通过琼脂糖凝胶检测,然后由上海生工生物工程股份有限公司完成测序。按照方法1.5,用MEGA 7.0对测序结果进行系统发育分析。在物种进化过程中,几乎所有的基因都在一定程度上发生了水平转移,单个基因的系统发育不能反映物种的系统发育,因此对持家基因进行多位点序列分析(multi locus sequence analysis,MLSA),并在相似性97%水平上进行分类鉴定[30-31]。
1.8 代表菌株回接验证及共生效率检测
将发芽2~3 cm的种子,在无菌条件下移植到灭菌蛭石中,接种代表菌株菌液1 mL(OD600=0.8),共计11株代表菌株。每种菌液接种3盆植株,不接种菌液的3盆植株为对照组,共计种植36盆,最后用封口膜封口,在光照气候箱中生长45 d(初花期)。在收获期对植物的结瘤数目、叶片叶绿素含量、地上部干质量和地下部干质量、株高度、根长度等相关数据进行收集[32],用于评估代表菌株共生效率。
2 结果与分析
2.1 土壤理化性质分析
2种不同土壤类型样品的理化性质测定结果如表1所示。2种土壤除了在总盐含量上没有构成显著性差异外,其余各个理化因子均构成显著性差异,并且ZA中的有机质、总氮、速效钾含量和pH值均低于ZB,而ZA的有效磷含量明显高于ZB,这表明2种类型土壤理化因子差异明显。

表1 采样点的土壤基本理化性质Table 1 Basic physiochemical properties of soils from different sampling sites
2.2 根瘤菌的分离、纯化及保藏
随机选取表面完整且呈粉红色的根瘤进行根瘤菌的分离,共计分离得到67株能与花生共生的根瘤菌菌株,分离菌株在YMA固体培养基上以28 ℃培养7~10 d后,形成2~4 mm的单菌落,并采用3次画线的方式对其进行纯化。将所得菌株暂时保存在YMA斜面上,同时取对数期菌液与体积分数50%甘油混合长期保存于-80 ℃冰箱中。
2.3 供试菌株IGS PCR-RFLP结果与分析
根据1.5方法,对所有供试菌株酶切图谱的分析,67株花生供试菌株被分为9种IGS类型,选取其中11株作为代表菌株,结果见表2。IGS 1和2类型为主导类群,共计包含40株供试菌株,占所有供试菌株的59.70%;IGS 3和4类型共计包含12株供试菌株,在ZA和ZB均有分布;IGS 5、6、7和9类型共计13株供试菌株,仅在ZA中发现;IGS 8类型中仅包含2株供试菌株,且仅在ZB中发现。

表2 花生根瘤菌的具体分型及地理分布结果Table 2 Grouping results and geographic distribution of the Bradyrhizobium isolates associated with Arachis hypogaea L.
2.4 16S rRNA的测序及系统发育分析
根据方法1.6对代表菌株进行16S rRNA 测序,并利用Mega 7.0 软件,选用T92+G+I模型对代表菌株进行ML系统发育树的构建与分析,结果如图1所示。9株代表菌株分布在1个大的进化枝中,其序列相似性范围为99.5%~100%,与慢生根瘤菌属已知种模式菌株广东慢生根瘤菌(B.guangdongense) CCBAU 51649T、广州慢生根瘤菌(B.guangzhouense) CCBAU 51670T、赣州慢生根瘤菌(B.ganzhouense) RITF806T、硝基还原慢生根瘤菌(B.nitroreducens) TSA1T和B.cytisiCTAW11T的序列相似性在99.5%~100%之间,与该属其他已知种群模式菌株的序列相似性均≥96.2%,与根瘤菌属模式菌株葡萄根瘤菌(R.lusitanum) P1-7T的相似性 ≤ 88.1 %,所以供试菌株被鉴定属于慢生根瘤菌属。

图1 基于代表菌株16S rRNA序列的系统发育树Fig.1 The phylogenetic tree of 16S rDNA gene sequences of the representatives
2.5 持家基因recA、atpD和glnII的多位点序列分析
根据方法1.7对代表菌株的持家基因recA、atpD和glnII进行多位点序列分析,并利用Mega 7.0 软件,选用GTR+G+I模型进行ML聚树及系统发育分析,结果如图2所示。11个代表菌株在recA(350 bp)、atpD(428 bp)和glnII(441 bp)串联序列的系统发育分析中,序列相似性在97%的水平上可以划分为7个簇(Cluster),如表3所示,其序列相似性在为92.3%~98.7%。Cluster 1中ZA2、ZB7、ZB16和ZB30与已知模式菌株广东慢生根瘤菌CCBAU 51649T聚为1个分支,其序列相似性为98.6%~100%,因此该分支的代表菌株可以被鉴定为广东慢生根瘤菌。Cluster 2中代表菌株ZA22和ZB15单独聚为1个分支,与已知模式菌株的序列相似性 ≤ 94.9%。Cluster 3包含1株代表菌株,与已知模式菌株广州慢生根瘤菌 CCBAU 51670T的序列相似性为96.7 %。Cluster 4、5、6和7中都仅包含1株代表菌株,与已知模式菌株的序列相似性均 ≤ 97.0%。由此,Cluster 2、3、4、5、6和7为5个疑似新种群:Bradyrhizobiumgensp.Ⅰ、Bradyrhizobiumgensp.Ⅱ、Bradyrhizobiumgensp.Ⅲ、Bradyrhizobiumgensp.Ⅳ、Bradyrhizobiumgensp.Ⅴ和Bradyrhizobiumgensp.Ⅵ。

图2 代表菌株的持家基因合并序列(recA-atpD-glnII)MLSA系统发育树Fig.2 The phylogenetic tree of MLSA based on concatenated sequences of recA-atpD-glnII
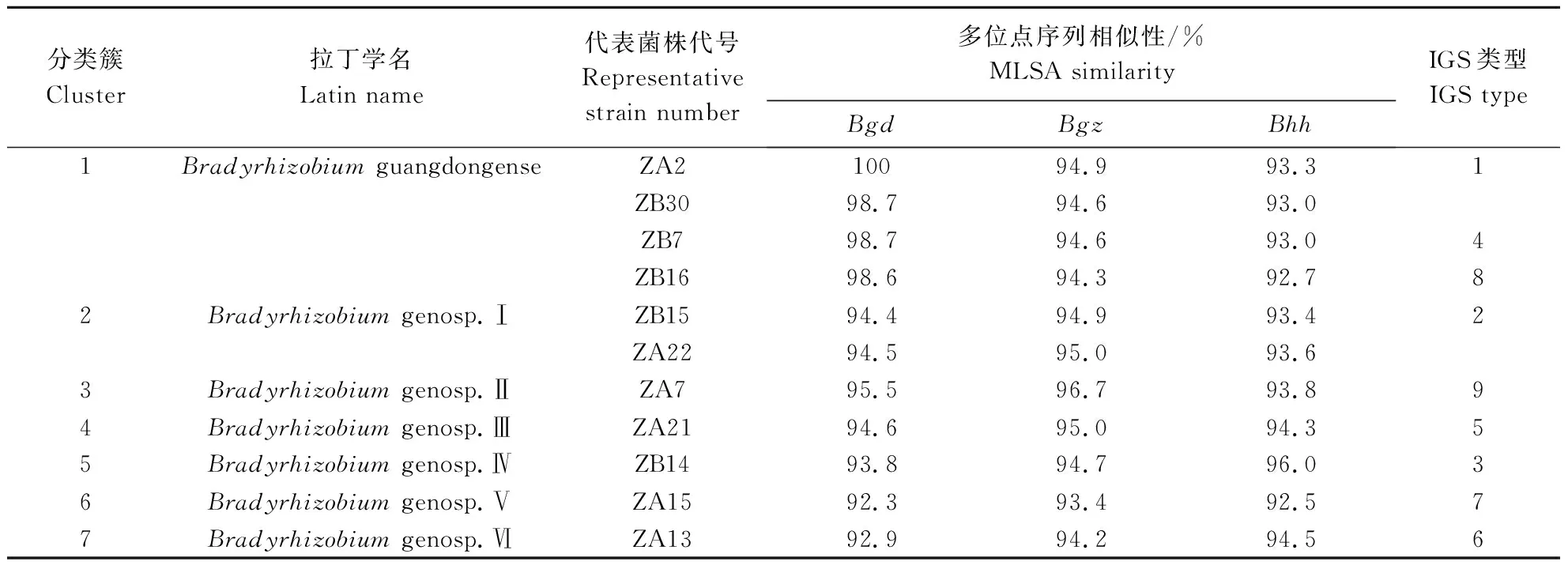
表3 花生根瘤菌的分类学地位Table 3 The taxonomic status of the Bradyrhizobium isolates associated with Arachis hypogaea L.
2.6 共生基因nifH和nodA的系统发育分析
根据方法1.7,对代表菌株的共生基因nifH和nodA进行系统发育分析,利用Mega 7.0 软件,分别选用模型T92+G和T92+I进行ML聚类分析,结果如图3和图4所示。在nifH系统发育树中,除ZA7外的所有代表菌株与广东慢生根瘤菌CCBAU 51649T和广州慢生根瘤菌 CCBAU 51670T聚为1个分支,其序列相似性为100 %。代表菌株ZA7单独与硝基还原慢生根瘤菌 TSA1T聚为1个小的分支,其序列相似性为95.3%,遗传距离较远。但是代表菌株在nodA的系统发育树中,所有代表菌株与广州慢生根瘤菌 CCBAU 51670T、广西慢生根瘤菌(B.guangxiense) CCBAU 53363T和广东慢生根瘤菌 CCBAU 51649T聚为1个独立的分支,序列相似性为100%,其宿主均为花生,并且在回接验证试验中所有的代表菌株均能与花生共生结瘤。

图3 代表菌株共生基因nifH的系统发育树Fig.3 Phylogenetic tree of symbiotic gene nifH of the representatives

图4 代表菌株共生基因nodA的系统发育树Fig.4 Phylogenetic tree of symbiotic gene nodA of the representatives
2.7 代表菌株回接结瘤效果验证及共生效果检验结果
根据IGS-RFLP的结果,挑选11株代表菌株进行回接验证及共生效果的数据采集,回接验证所用花生品种为远杂9102。未接种的对照组(CK)不结瘤,所有代表菌株均能与花生共生结瘤(图5-A)。与对照组相比,花生在接种分离菌株后,植株叶片叶绿素含量、地上部干质量和地下部干质量、株高度、根长度均有所提高,并与对照组构成显著差异。接种ZB30的处理组叶绿素含量最高,为47.37(图5-B),地上部干质量也表现出相同的情况(图5-C),有4株代表菌株接种的花生植株的地上部干质量与对照组相比增加1倍以上,其中接种ZB30的处理组地上部干质量是CK组的2.7倍。接种菌株后的花生植株的地下部干质量差异较大,其中接种ZB30的花生植株地下部干质量为2.30 g,显著高于其他各处理组(图5-D)。所有代表菌株接种的花生植株在株高度和根长度方面也表现出不同程度的差异(图5-E,图5-F)。
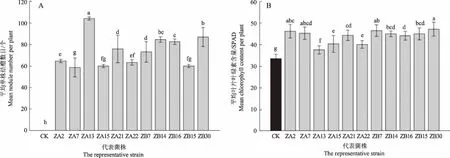
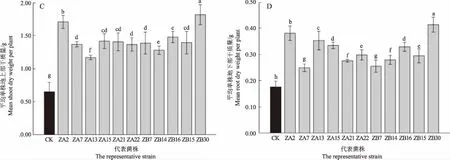
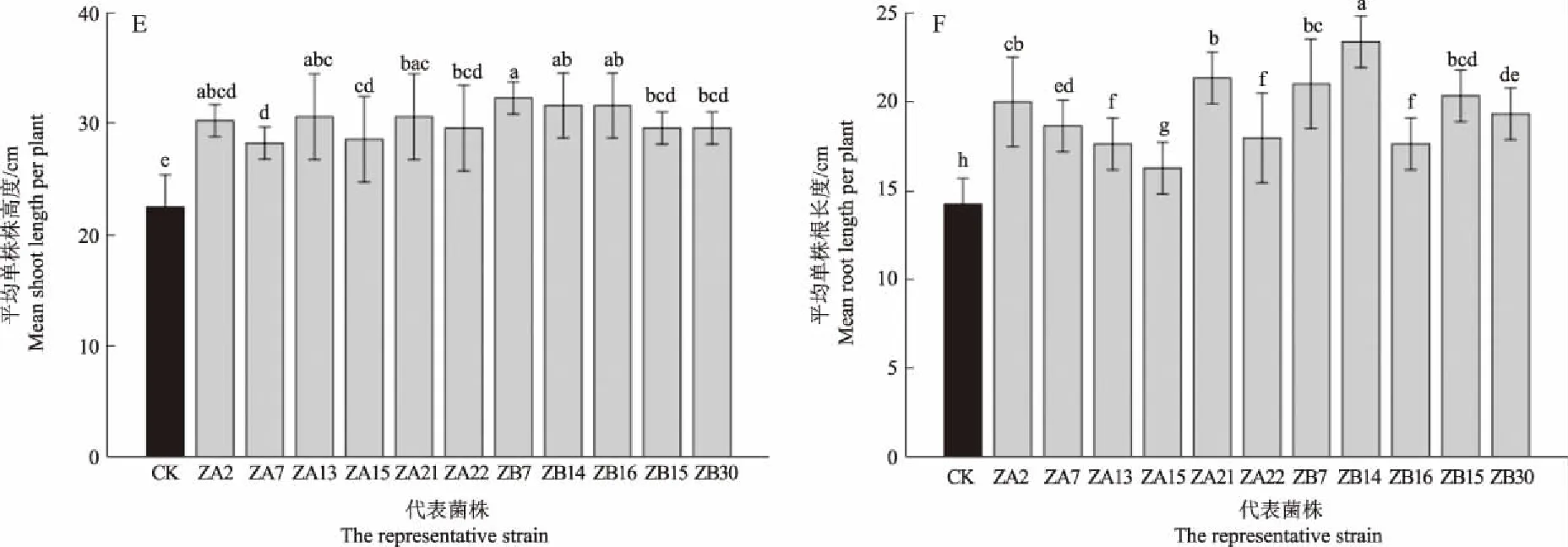
注:不同字母表示P<0.05时显著差异。Note: Different letters are indicated significantly different at P<0.05.
3 结论与讨论
本研究首次对河南省正阳县陡沟镇周湾村花生根瘤菌的多样性进行了研究,为当地花生的种植选育匹配高效的根瘤菌种提供指导。本研究共分离获得67株花生根瘤菌菌株,通过IGS PCR-RFLP、16S rRNA,持家基因(recA、atpD、glnII)以及共生基因(nodA和nifH)基因的系统发育分析对所有供试菌株进行遗传多样性研究。首先,通过IGS PCR-RFLP 把所有供试菌株分为11种IGS类型,表明了该地区的花生根瘤菌菌株具有较高的遗传多样性,其次通过对供试菌株的16S rRNA测序及系统发育分析表明了所有供试菌株为慢生根瘤菌属,进而通过MLSA(recA-atpD-glnII)分析表明,所有供试菌株可以被鉴定为广东慢生根瘤菌和6个同属的疑似新种群。在回接试验中,所有代表菌株均能与花生植株共生结瘤,各项指标均有显著提升。师尚礼等[33]通过采集农田中的花生根瘤进行分离鉴定,发现仅有慢生根瘤菌属和根瘤菌属能与花生有效结瘤,表明慢生根瘤菌属是花生主要的共生体[18,34]。陈静瑜等[35]通过对广东省花生根瘤菌的遗传多样性研究,发现216株分离菌株分别属于高效固氮慢生根瘤菌(B.diazoefficiens)、圆明慢生根瘤菌(B.yuanmingense)、花生慢生根瘤菌(B.arachidis)、广东慢生根瘤菌、广西慢生根瘤菌、B.iriomotense和辽宁慢生根瘤菌(B.liaoningense)以及14株疑似慢生根瘤菌的新种群。
根瘤菌是革兰氏阴性菌,在土壤中广泛存在。吴忠梅等[25]研究表明,根瘤菌可能会受到宿主植物和环境的影响,经过长期的演变和进化,形成表型和基因型的高度多样性。李智燕等[36]的研究表明,一般苜蓿根瘤菌在中性或中碱性的土壤中结瘤固氮效果最好,而在酸性土壤中效果较差。刘鹏等[37]研究表明,根瘤菌在偏酸性的土壤中,能正常结瘤固氮并促进花生植株生长,说明花生根瘤菌具有较好的适应酸性土壤的能力。本研究中采集的土壤经过检测是酸性和中性偏酸,捕获的根瘤菌经过分析具有多种IGS类型,表明花生根瘤菌能较好地适应酸性土壤,这与东北地区中性偏酸土壤环境中主要存在慢生根瘤菌属的种群的研究结果相一致[35]。本研究中ZA潮土和ZB水稻土均发现了独有的IGS类型,推测是土壤采样点为小麦/水稻和花生的轮作种植模式导致的,即物种丰富度与采样点的作物种植历史和土壤类型有关,这与NKOT等[38]和YANG等研究结果一致[39]。

