载锰活性氧化铝对地下水除氟机理研究
由 昆,范维利,傅金祥,高禹佳,高连松
(沈阳建筑大学市政与环境工程学院,辽宁 沈阳 110168)
氟是人体生命活动所需的微量元素,适量摄入具有一定益处[1],若长期超标摄入则有可能导致氟中毒[2]。在我国,高氟地下水分布范围非常广泛,特别是一些农村地区由于经济环境条件有限,无法采用常规改水措施防氟,且一些除氟设施并未正常投入使用[3]。目前,在工程实践中,多用沉淀法[4]、膜分离法、吸附法等对地下水进行除氟。沉淀法是向水中投加的化学药剂与氟离子反应生产沉淀而被去除。混凝法除氟成本低廉、操作简便,但投药量较大,且沉淀时间较长。纳滤、反渗透等膜分离方法[5]是以压力、浓度差等为驱动力,将氟化物通过选择透过膜分离的过滤方法,除氟效果一般在50%~98%,效果稳定、管理简单,但价格偏贵,且使用过程中膜容易被污染和堵塞,产水率低,不适用于农村。吸附法[6-9]主要通过吸附剂与含氟溶液接触,利用固、液相分配系数的差异,氟离子通过物理、化学作用附着于吸附剂上,从而达到除氟的效果。吸附剂吸附饱和后可使用再生液对其进行再生,恢复其除氟能力。该方法由于操作简便、成本低廉等优势被广泛使用,但常规吸附剂平衡吸附容量较低,因此笔者研究旨在提高传统吸附剂的除氟性能。近年来,相关研究证明锰矿对氟离子具有很强的吸附性能[10-11]。其中γ型MnOOH吸附性能比其他锰砂更好一些[11]。笔者对活性氧化铝(Activated Alumina,AA)进行改性;通过扫描电子显微镜(SEM)和X射线衍射(XRD)分析其结构和性能特征;通过吸附动力学试验和吸附热力学试验来探究其除氟机理。
1 试 验
1.1 主要材料
活性氧化铝(AA);Al2(SO4)3;MnSO4;30%的H2O2;C12H8N2,C2H4O2,NaF,(NH4)2Fe(SO4)2·6H2O,HCl,NH3H2O,CH3COONH4,NH2OH·HCl,NaOH,HNO3均为分析纯。
1.2 吸附剂的制备和材料表征分析
载锰活性氧化铝(MnOOH@AA)制备:将Al2(SO4)3活化后的100 g活性氧化铝加入 MnSO4溶液中,并缓慢加入10.2 mL的过氧化氢,在95 ℃条件下,加入0.2 mol/L的氨水150 mL,加热搅拌6 h后,在颗粒表面会生成碱式氧化锰(MnOOH)的棕褐色沉淀。
材料表征:采用X射线衍射仪(X-Ray Diffractomer,XRD)和扫描电子显微镜(Scanning electron microscope,SEM)测定分析改性前和改性后活性氧化铝的形貌和结构等。
1.3 水质检测项目与方法
根据《生活饮用水标准检验方法》(GB/T 5750—2006)进行氟化物、总铁、pH水质指标分析。检测指标及分析方法如表1所示。

表1 检测指标及分析方法Table 1 Experimental items and methods
1.4 吸附试验
1.4.1 吸附动力学分析
在铁离子质量浓度为2 mg/L时,分别模拟5 mg/L和2 mg/L氟化物水样。为保证在一定温度下,向锥形瓶中加入MnOOH@AA,在pH为4,120 r/min条件下,定时测定上清液中氟化物质量浓度,建立不同氟化物浓度的MnOOH@AA吸附动力学模型。试验总历时74 h,共取样13次,误差较小,不影响试验结果准确性。
1.4.2 吸附等温线分析
在铁离子质量浓度为2 mg/L,氟化物质量浓度为2 mg/L、5 mg/L、8 mg/L、11 mg/L、15 mg/L的水样,检测120 r/min振荡吸附12 h后,25 ℃、35 ℃、45 ℃条件下上清液中氟化物浓度,分析MnOOH@AA除氟机理。
2 结果与分析
2.1 载锰活性氧化铝的表征
2.1.1 XRD分析
图1为载锰活性氧化铝的XRD 对比图。可以看出,改性后颗粒结构变化较大。峰值的强度变化说明改性后产生了新物相,18.7°、26.4°、36.6°和55.2°附近的衍射峰强度显著增强,通过载锰活性氧化铝XRD谱线与粉末衍射数据库的对比,可知锰的氢氧化物和氧化物的特征峰即为增强的衍射峰,说明锰的氧化物成功附着在活性氧化铝表面,改性后有更多的吸附位点和更好的吸附效果。
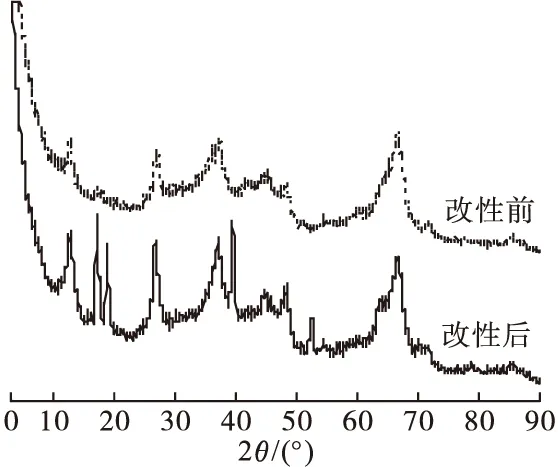
图1 改性前后活性氧化铝的XRD图Fig.1 XRD image of AA and MnOOH@AA
2.1.2 SEM分析
图2为改性前后活性氧化铝的SEM图。

图2 SEM图像分析Fig.2 Scanning electron microscope image of AA and MnOOH@AA
从图2可以看出,改性前后活性氧化铝表面形貌变化明显,MnOOH@AA表面出现不规则的、凸起的刺状结构,表面变得更加的粗糙。这说明MnOOH@AA表面具有更多附位点,增强了对氟离子的吸附能力[12]。经静态吸附试验对比分析可得,改性后除氟效果比改性前增强70%。
2.2 吸附动力学模型分析
2.2.1 准一级动力学和准二级动力学模型拟合分析
尽管原水氟化物质量浓度不同,但吸附速率曲线变化趋势基本相似。吸附过程整体可分为快速吸附、慢速吸附和平衡阶段[13]。图3为动力学拟合结果。氟化物初始质量浓度为2 mg/L的准一级动力学和准二级动力学R2值为0.917 6和0.997 6;而初始质量浓度为5 mg/L的准一级动力学和准二级动力学R2值为0.878 6和0.999 5。通过回归系数对比,发现载锰活性氧化铝对氟离子的吸附过程更符合准二级动力学模型,因此该过程以化学吸附为主。在溶液中化学反应过程为MnOOH发生表面羟基化。酸性条件下,由于OH-与F-的水合半径相近,F-与R-(Al2O3)n·Mn(OH)2发生置换反应,从而去除溶液中的氟离子。
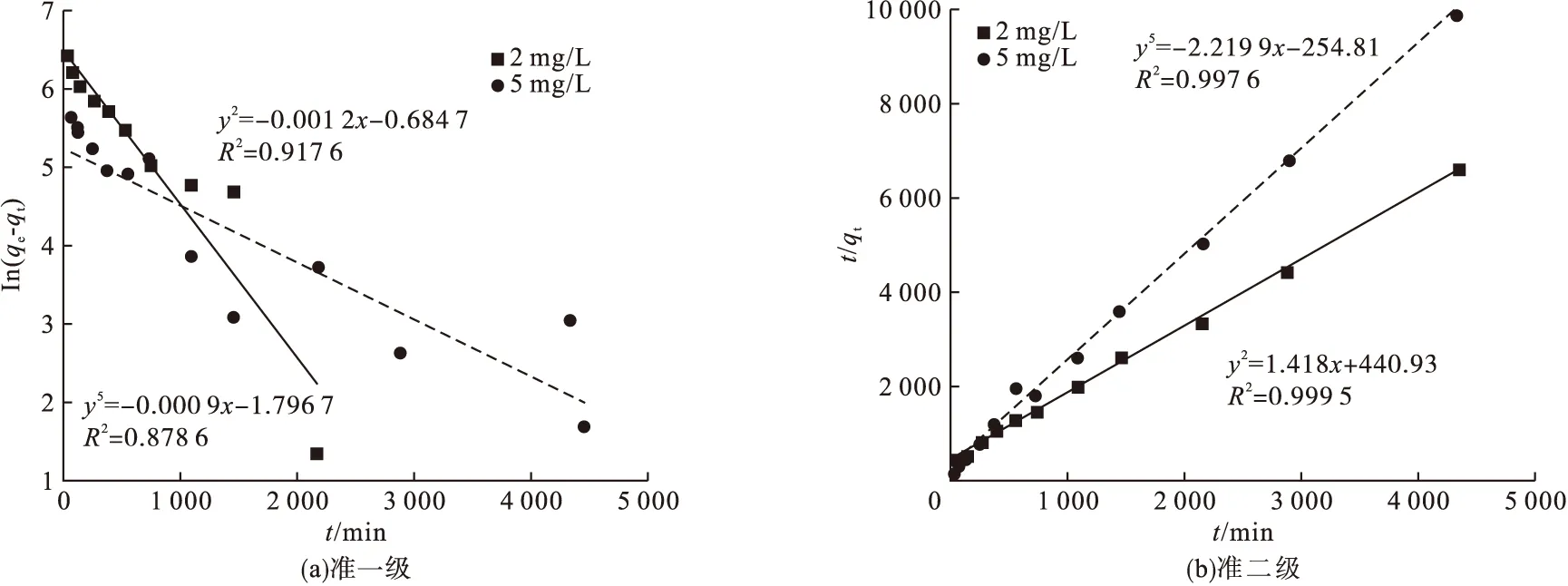
图3 动力学的试验数据拟合分析Fig.3 Fitting curve for kinetics
由准二级动力学拟合系数可知,氟化物初始质量浓度为2 mg/L时,吸附速率常数为0.019 3,吸附量为0.705 mg/g;初始质量浓度为5 mg/L的吸附速率常数为0.004 6,吸附量为0.45 mg/g。由此可知,当氟化物浓度越低时,吸附位点的竞争越小,在较短的时间内能达到吸附平衡[14]。因此,初始氟化物浓度越小,吸附速率常数越大。
2.2.2 颗粒内扩散模型拟合分析
载锰活性氧化铝对氟离子的吸附过程主要分为3个步骤:①氟离子从溶液中迁移到载锰活性氧化铝颗粒表面的过程,即外部扩散;②氟离子由载锰活性氧化铝颗粒得外表面向微孔中的内表面扩散,即内部扩散;③氟离子被吸附在载锰活性氧化铝颗粒的活性位点上,即化学吸附。通常情况下,化学吸附的速率很快,反应速率主要由外部扩散和内部扩散决定。
通过qt对t0.5作图,可得载锰活性氧化铝吸附氟离子的颗粒内扩散模型拟合曲线(见图4)。
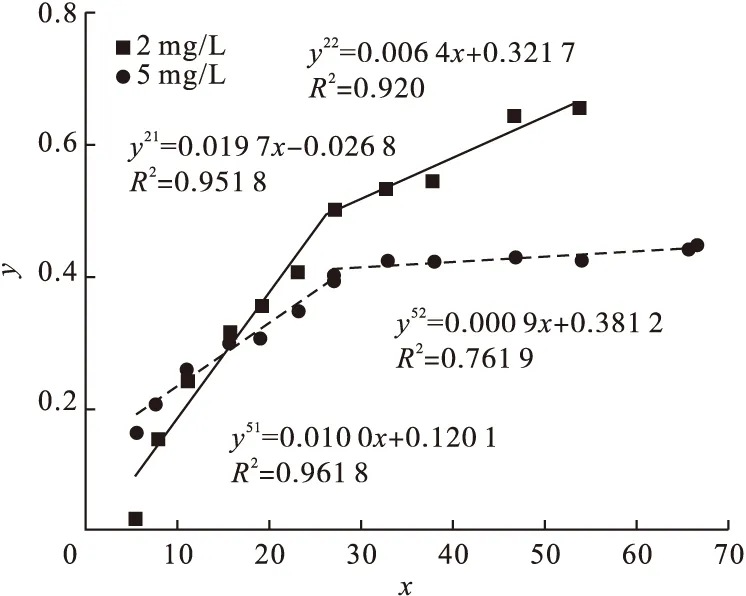
图4 颗粒内扩散的拟合Fig.4 Fitting curve of intraparticle diffusion
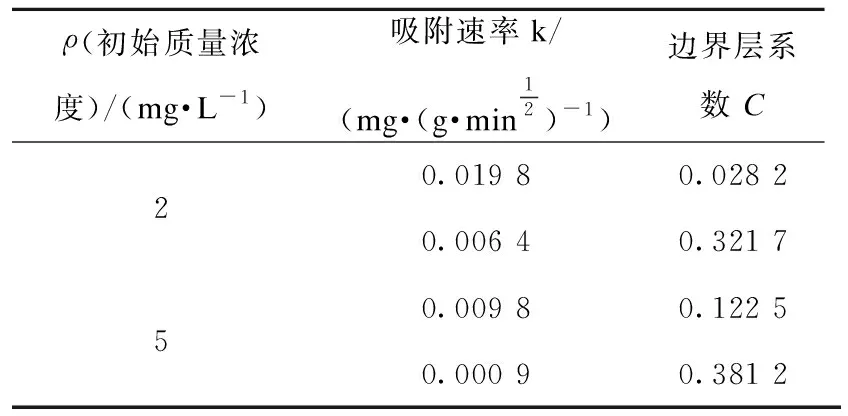
表2 颗粒内扩散模型拟合参数Table 2 Fitting parameters of intraparticle diffusion model
由表2中颗粒内扩散模型拟合数据可得,边界层系数C21(0.028 2)
2.3 吸附热力学模型分析
不同氟离子质量浓度的原水在25 ℃、35 ℃、45 ℃下吸附等温线变化趋势基本一致。吸附量随着初始氟化物的增加而增大。当水中氟化物浓度较大时,MnOOH@AA内外溶液氟离子质量浓度梯度增加,扩散过程速度加快,促进吸附的发生[17]。在吸附达到平衡时,温度越高平衡吸附量越大。
2.3.1 载锰活性氧化铝对氟离子吸附等温模型拟合
采用Langmuir模型和Freundlich模型对载锰活性氧化铝对氟离子的吸附过程进行拟合(见图5)
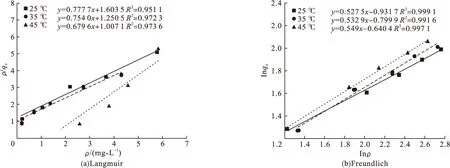
图5 吸附等温方程拟合曲线Fig.5 Langmuir and Freundlich adsorption isotherm equation fitting curve
从图5可知,Langmuir模型的相关性R2均在0.9以上,可以描述载锰活性氧化铝对氟离子的吸附过程。但相较于Langmuir模型,Freundlich模型在25 ℃、35 ℃、45 ℃时,R2值分别为0.999 1、0.991 6及0.997 1,说明和Langmuir模型相比较,Freundlich模型显著性更好,能更好地说明MnOOH@AA对氟化物的吸附过程,MnOOH@AA对氟化物的吸附是多层吸附为主。
Freundlich方程中25 ℃、35 ℃、45 ℃时1/n值分别为0.527 5,0.532 9,0.549 7,均正在0~1,说明MnOOH@AA具有优先吸附氟化物的能力,当进水氟化物浓度较低时,吸附效果也较好。由25 ℃、35 ℃、45 ℃时吸附平衡常数KF(0.393 9,0.449 4,0.527 1)可知,温度越高,KF越大,说明温度升高有利于MnOOH@AA对氟化物的吸附。
Langmuir模型温度分别为25 ℃、35 ℃、45 ℃时,相关系数R2为0.951 1~0.973 6,与Freundlich模型相比,拟合度偏低。Langmuir模型中的吸附平衡常数KL可以表示载锰活性氧化铝对氟离子的亲和力,随着温度的升高KL逐渐升高,由0.485升高到0.675,表明吸附过程主要以化学吸附为主[17]。
2.3.2 载锰活性氧化铝对氟离子吸附热力学参数计算
根据范特霍夫方程可计算25 ℃、35 ℃、45 ℃热力学常数,计算MnOOH@AA、吸附自由能△G、吸附焓△H、吸附熵△S,通过△G、△H、△S计算,识别吸附过程为放热反应还是吸热反应,判断反应是否为自发进行[18],所得热力学参数详如表3所示。从表3中可知,温度升高,吸附自由能(ΔG)逐渐减小,表明温度升高有利于吸附反应进行。不同温度条件下吸附自由能均小于零,说明MnOOH@AA对氟化物的吸附过程是自发进行的[19]。
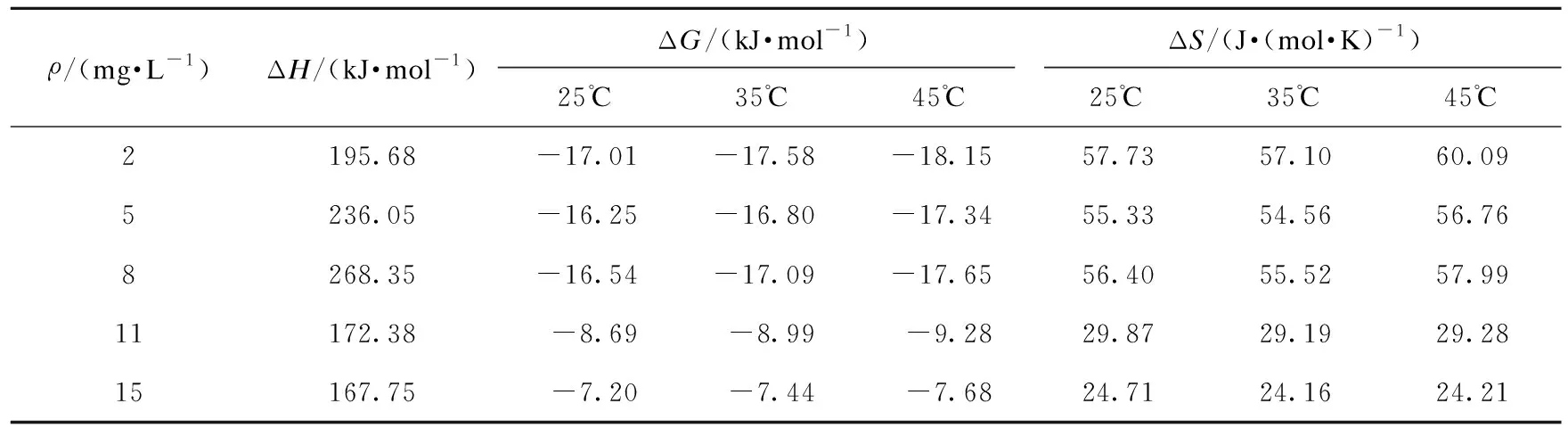
表3 载锰活性氧化铝对氟离子吸附热力学参数Table 3 MnOOH@AA’s thermodynamic parameters
一般物理吸附的ΔH≤20 kJ/mol,化学吸附的ΔH>100 kJ/mol。同时温度升高有利于离子交换发生。从表3可知,载锰活性氧化铝对氟离子的吸附焓(ΔH)均大于零,说明MnOOH@AA对氟化物吸附过程是吸热反应,化学吸附是主要的反应[19]。
吸附熵△S>0,表明MnOOH@AA吸附氟化物的过程是熵增的过程,有序性在反应的过程中减小,固液面混乱度增大[20]。
在吸附反应开始时,氟化物与MnOOH@AA发生化学反应,吸收的热量最大,随着吸附到MnOOH@AA颗粒上的氟离子增多,能发生化学反应的吸附位点数量越来越少,后期的氟离子只能被吸附到能量较低的位点上,这时吸附的热量减少[19]。
3 结 论
(1)MnOOH@AA表面附着锰氧化物后,吸附位点增加,增强了AA对氟化物的吸附能力。使得MnOOH@AA除氟效果比改性前提高了70%。
(2)准二级动力学模型的回归系数为0.997 6和0.999 5,更适于描述载锰活性氧化铝对氟离子的吸附动力学。载锰活性氧化铝除氟吸附过程以化学吸附为主。颗粒内扩散主要控制着吸附速率。
(3)吸附过程均可用Langmuir模型和Freundlich模型描述。但Freundlich模型显著性更强,多层化学吸附是吸附的主要过程为。吸附过程是自发进行的吸热反应。

