海假交替单胞菌(Pseudoalterom onas marina)鞭毛蛋白对生物被膜形成及厚壳贻贝附着的影响
蔡雨珊,张秀坤,竹攸汀,3,杨金龙,3,梁箫,3*
(1.上海海洋大学国家海洋生物科学国际联合研究中心,上海201306;2.上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海201306;3.南方海洋科学与工程广东省实验室(广州),广东广州511458)
1 引言
厚壳贻贝(Mytilus coruscus),作为东海重要的海产经济贝类和大型海洋污损生物[1],具备较高的适应外界环境和生存繁殖的能力。与大多数的海洋无脊椎动物相同,厚壳贻贝的生活史中包括浮游生活和底栖附着两部分。通常情况下,在变态发育前以浮游方式生存,后通过寻找合适的基质进行附着,变态发育为稚贝,并最终成长为成贝[2]。在底栖附着阶段,当遇到不利于贻贝生长生活的情况时,贻贝便将已形成的足丝切断,离开原附着基质,找寻更优的基质,通过形成新足丝再次附着[3],这一过程即为二次附着。
影响厚壳贻贝稚贝附着的因素很多,已有研究发现[3−4],无论是自然生物被膜还是单一细菌形成的生物被膜,对厚壳贻贝稚贝的附着都具有不同程度的诱导活性。在厚壳贻贝生长发育过程中的幼虫、稚贝阶段,不同的海洋细菌形成的生物被膜所起到的作用也存在差异[5−6]。例如,细菌的一些胞外产物如纤维素[7]、脓黑素[8]的过量表达会显著降低厚壳贻贝幼虫的附着变态率。生物被膜作为一种广泛存在的生命模式,在动态演替的过程中,其细菌密度、膜厚、群落结构及胞外产物的种类、含量等都对贻贝的附着有一定影响。
鞭毛作为原核生物的运动器官,不仅影响着其运动能力,还参与很多微生物的生理活动过程,如生物被膜的形成[9]。而作为构成细菌鞭毛主要物质的鞭毛蛋白,也是细菌生物被膜重要的胞外产物。已有研究发现[10],一定浓度的鞭毛蛋白可以直接诱导厚壳贻贝幼虫的附着变态,鞭毛合成蛋白fliP基因的缺失会导致鞭毛结构和运动性丧失,生物被膜上胞外产物的含量发生改变,从而间接降低了幼虫的附着变态率。鞭毛蛋白对厚壳贻贝稚贝的二次附着的作用尚未可知。为了探究这一问题,本研究通过采用酸解超速离心法获得了海假交替单胞菌的鞭毛蛋白提取物,检测了其对生物被膜生物学特性的影响。同时,使用琼脂糖作为中间介质测定了提取的鞭毛蛋白对厚壳贻贝稚贝附着的作用,旨在为探究细菌鞭毛蛋白与厚壳贻贝附着互作机制提供理论依据。
2 材料与方法
2.1 材料
2.1.1 厚壳贻贝稚贝、海洋细菌、鞭毛蛋白
本研究所用到的厚壳贻贝稚贝(壳长为(0.64±0.018 )mm;壳高为(0.44 ±0.015 )mm)由浙江省嵊泗县东海贻贝科技创新服务有限公司提供。稚贝首先进行为期1周的暂养,暂养水温为18℃,充氧气,用湛江等鞭金藻进行喂食,每天换水1次。所用的海假交替单胞菌(Pseudoalteromonasmarina)是从自然的生物被膜上得到,存于−80℃冰箱,在液体培养基(Zobell 2216E)中培养,设定温度为25℃。所用的鞭毛蛋白通过酸解超速离心法从P.marina菌体中获得。
2.1.2 主要试剂和仪器
Zobell2216E液体培养基、琼脂糖、硫酸铵、BCA试剂盒、无菌玻璃载玻片(以上均购自生工生物工程(上海)股份有限公司)、奥林巴斯显微镜、冷冻离心机(5810 R,eppendorf)、恒温摇床(ZWYR-2012)。
2.2 方法
2.2.1 鞭毛蛋白的提取
鞭毛蛋白的提取参考Ibrahim等[11]介绍的方法,具体步骤是:将P.marina菌种接种于含有Zobell 2216E液体培养基(1 000 m L)的摇瓶中,在温度为25℃,80 r/m in条件下振荡培养18 h,再以4 000 r/m in的转速离心15m in,收集细菌沉淀,用灭菌海水洗涤沉淀3次,目的是洗去菌体胞外产物。用灭菌的生理盐水溶解细菌后滴加HCl(1 mol/L),使溶液pH调节为2.0。在常温下进行磁力搅拌,离心(5 000 g,30min)后取上清,再次离心(100 000 g,lh),保留上清,滴加NaOH(1 mol/L)使上清pH达到7.2,依据上清体积来添加(NH4)2SO4,调节上清浓度,使浓度达2.67 mol/L。添加的(NH4)2SO4通过搅拌溶解,4℃保存溶液至过夜,4℃、15 000 g条件下离心15m in,弃上清,将沉淀放入5m L灭菌蒸馏水中使其完全溶解。再将溶解液加到准备好的透析袋中,处理2 h。准备灭菌的蒸馏水,加入活性炭(约20 g),将透析袋放置其中,4℃条件下搅拌18 h。最后将提取出来的鞭毛蛋白于−20℃条件下保存。
2.2.2 鞭毛蛋白SDS-PAGE及其浓度的测定
电泳载体为浓缩胶和分离胶(浓缩胶在上,分离胶在下),染色液为考马斯亮蓝,参照文献[12]进行操作。通过BCA法检测鞭毛蛋白浓度,依据试剂盒说明书进行测定。
2.2.3 鞭毛蛋白质谱分析鉴定
提取的鞭毛蛋白质谱分析鉴定由上海易算生物科技有限公司完成。详细流程如下:
(1)将浓缩胶用水冲洗干净后,切下被浓缩聚集的样品条带,切成1mm见方的小片,装于EP管内。加入适当体积的纯乙腈干胶后,再加入约50μL DTT溶液(浓度为10mmol/L,溶于100mmol/L碳酸氢铵中)将干胶粒全部覆盖。于56℃下反应半小时,冷却至室温后加入纯乙腈干胶,弃去所有溶剂。随后加入约50 μL IAA溶液(浓度为55 mmol/L,溶于100 mmol/L碳酸氢铵中)将干胶粒覆盖,在37℃下于黑暗中反应10m in,冷却至室温后加入纯乙腈干胶,弃去所有溶剂。胶粒上的考马斯亮蓝染色剂用50%乙腈、50%100mmol/L碳酸氢铵溶液除去。脱色后加入纯乙腈干胶,弃去样品管中的溶剂,之后加入足够体积的胰酶溶液(浓度为13 ng/μL,溶于含10%乙腈的10 mmol/L碳酸氢铵溶液中)进行过夜酶解。酶解完毕,依次加入含0.1 %甲酸的5 0%乙腈溶液,含0.1 %甲酸的80%乙腈溶液以及纯乙腈溶液将肽段从胶粒从萃取出来,合并后冻干。
(2)将再次溶于水中的样品通过nano-HPLC-MS/MS进行分析。质谱仪可选定模式工作,在MS和MS/MS采集间自主转变。
(3)串联质谱图通过PEAKSStudio X分析。蛋白卡值为−10lgP≥20;肽段卡值为−10lgP≥20。
(4)氨基酸序列比对所用到的原始数据由P.marina基因组[13]查找到的细菌菌体鞭毛外部结构相关的10个基因(包括1-fliC,2-fliC,3-fliC,4-fliC,fliD,flgL,flgK,flgE,fliK,flgD)在NCBI数据库中得到。
2.2.4 鞭毛蛋白对厚壳贻贝稚贝附着实验
将鞭毛蛋白与0.4%的琼脂糖凝胶溶液(短暂冷却至室温)混合,为了获得鞭毛蛋白对稚贝附着影响的合适浓度,本实验设计了鞭毛蛋白浓度梯度实验,即调整鞭毛蛋白终浓度为0.01 mg/L、0.1 mg/L、1.0 mg/L、10mg/L和20 mg/L。在超净工作台内,把鞭毛蛋白与琼脂糖凝胶溶液混合液等量、均匀地滴加在无菌载玻片上至完全覆盖载玻片(每张载玻片含1 m L混合液),无菌条件下室温冷凝。玻璃培养皿经高温灭菌冷却后,放入处理后的载玻片,再慢慢加入20 m L灭菌海水和10只稚贝,然后将其放入恒温的18℃无光照培养室中,记录12 h、24 h、48 h时稚贝在载玻片上的附着率。每个实验浓度分别设置9个平行组,对照组为无菌空载玻片和涂有单一成分的琼脂糖凝胶,也分别设置9个平行组。参照杨金龙等[14]的计算方法进行附着率的计算,并判定诱导能力的高低。
2.2.5 单一细菌生物被膜形成
参照杨金龙等[14]的方法制备生物被膜,首先,取−80℃保存的P.marina菌种进行划线,25℃培养过夜,挑选单一菌落到液体培养基中(收集菌体用2216E液体培养基),在25℃条件下震荡培养2 d。菌体用灭菌海水重复重悬离心(3 500 r/min离心15 min)后洗3次,最后用50m L灭菌海水悬浮菌体,计算出细菌密度。将菌液转移至无菌含有载玻片(38mm×26mm)的培养皿中,加入灭菌海水定容至20 m L,并调整菌液终密度(1.0×108cells/m L)。18℃条件下避光培养2 d,使菌体附着于载玻片上,实验空白对照组和该菌株的初始密度下分别设置9个平行。
2.2.6P.marina与鞭毛蛋白共同形成生物被膜
取无菌载玻片,先放入经高温灭菌后的培养皿中,加入一定量的清洗后的菌体悬浮液和鞭毛蛋白溶液,最后加入适量的灭菌海水定容至20m L,调整后使该株细菌的初始密度为1.0×108cells/m L,鞭毛蛋白的终浓度为10 mg/L,实验组和空白对照组均设置9个平行,18℃恒温条件下避光培养2 d。
2.2.7 鞭毛蛋白处理P.marina生物被膜
P.marina单一生物被膜形成后,将形成生物被膜的载玻片在灭菌海水中轻轻润洗3次,然后放入无菌的玻璃培养皿中,加入适量的灭菌海水定容至20 m L,并加入鞭毛蛋白调整终浓度为10mg/L,本处理实验设置9个平行组,18℃恒温条件下避光处理2 h。
2.2.8 处理后的生物被膜稚贝附着实验
将P.marina单一生物被膜和经过鞭毛蛋白以2种方式处理后的生物被膜的载玻片放入经高温灭菌后的玻璃培养皿中,皿中加入灭菌海水(20m L)、稚贝(10只),于18℃避光培养后,分别记录在6 h、12 h、24 h、48 h时的附着只数,设置平行实验9组;无生物被膜的灭菌玻璃载玻片为对照组。参照文献[14]的计算方法进行附着率的计算,并判定诱导能力的高低。
2.2.9 生物被膜上细菌密度计数
将生物被膜用甲醛溶液(5%)处理24 h,吖啶橙(0.1%)染色5 m in后,将染色后的被膜在显微镜下观察,找出任意10个视野进行统计,设置3个平行,从而确定出生物被膜上细菌的最终密度,有关计算公式参照文献[14]。
2.2.10 生物被膜共聚焦扫描
将生物被膜用甲醛溶液(5%)浸泡24 h,遮光条件下用碘化丙啶(浓度为5μg/m L)进行染色,再使用莱卡激光共聚焦扫描显微镜(CLSM)在630×放大倍率下进行观察拍摄。每组生物被膜分别选取3个载玻片,每个载玻片上拍摄3个视野,即每组载玻片共扫描拍摄9个视野进行成像观察及胞外产物生物量数据比较分析。
2.2.11 生物被膜胞外α-多糖、β-多糖、蛋白、脂类染色实验
用相对应的染料分别对生物被膜进行胞外产物染色,处理后在莱卡激光共聚焦扫描显微镜下进行拍照成像,方法参考文献[15]。
2.2.12 数据处理
使用JMP软件(版本10.0.0)进行差异性分析,生物被膜上α-多糖、β-多糖、蛋白和脂类含量图片处理使用ImageJ软件。
3 结果与分析
3.1 鞭毛蛋白的提取及浓度的测定
本研究采用酸解超速离心法提取鞭毛蛋白,BCA法测得鞭毛蛋白浓度为0.926 mg/m L,于4℃保存。
3.2 鞭毛蛋白SDS-PAGE结果验证和质谱分析鉴定
本实验SDS-PAGE中鞭毛提取物的上样量为5μg,蛋白凝胶结果显示出A、B两条蛋白条带,凝胶成像软件系统分析A、B蛋白分子量分别约35 kDa和27 kDa (图1)。

图1 鞭毛蛋白SDS-PAGE结果Fig.1 The SDS-PAGE of flagellin
提取的蛋白通过质谱分析鉴定,结果如表1 所示。蛋白条带A的氨基酸序列与fliC基因在NCBI数据库翻译得到的氨基酸序列相似度最高达61%,与另外几个fliC蛋白亚基的氨基酸序列相似度分别为56%和55%;蛋白条带B的氨基酸序列与fliC基因的氨基酸序列相似度达42%和39%。SDS-PAGE及质谱鉴定结果表明,酸解超速离心法所获得的蛋白为P.marina的fliC鞭毛蛋白混合物。

表1 P.marina细菌鞭毛蛋白质谱分析鉴定结果Table1 Themassspectrometry identification of flagellin extracted from P.marina
3.3 鞭毛蛋白对稚贝附着的影响
不同浓度下的鞭毛蛋白在不同时间段内对稚贝附着的影响无明显差异,选取培养时间为12 h的处理组为研究对象,结果见图2。与空白组和涂有单一成分的琼脂糖凝胶的稚贝诱导活性相比,滴加浓度为10mg/L、20mg/L的鞭毛蛋白的琼脂糖凝胶载玻片对稚贝的附着的诱导活性显著增加(p<0.05),且实验中稚贝无死亡情况。
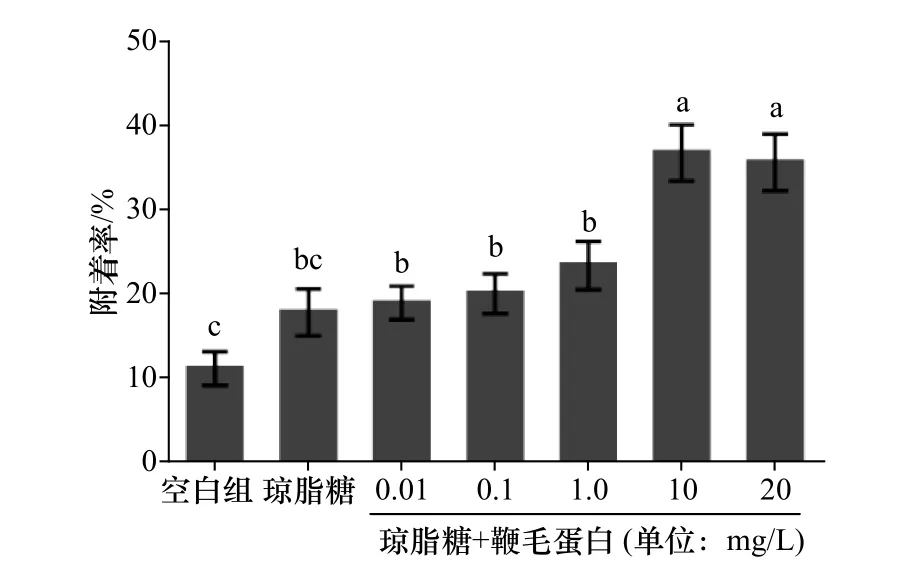
图2 鞭毛蛋白对稚贝附着的影响Fig.2 Effectsof settlement of M.coruscus plantigradeson the flagellin
3.4 鞭毛蛋白和P. marina共同形成的生物被膜及鞭毛蛋白处理P.marina细菌生物被膜对稚贝附着的影响
选取对稚贝附着率较高的鞭毛蛋白(10mg/L)与P.marina共同形成生物被膜和添加了相同浓度鞭毛蛋白2 h后的P.marina生物被膜,与单一细菌生物被膜对厚壳贻贝稚贝附着率相比,结果表明,2种方式均能显著提高厚壳贻贝稚贝的诱导活性,且这2种处理方式对稚贝附着的影响无明显差异(p>0.05)(图3 A)。
通过对生物被膜上细菌密度的计数与分析发现,与单一细菌生物被膜相比较,鞭毛蛋白与P.marina共同形成生物被膜上细菌密度显著增大(p<0.05),而用鞭毛蛋白处理的细菌生物被膜细菌密度无变化(图3 B)。
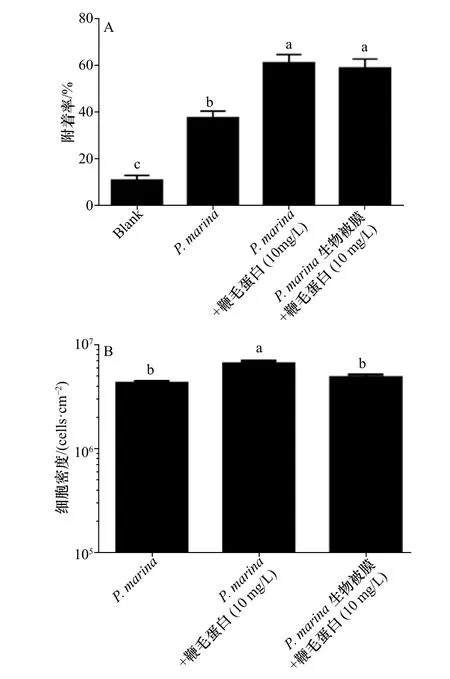
图3 不同处理方式形成的生物被膜对稚贝附着的影响及细菌密度的分析Fig.3 Influence of biofilms formed by different treatments on the settlement of plantigradesand the analysisof bacterialdensity
3.5 鞭毛蛋白对P.marina生物被膜上细菌分布状态和生物被膜膜厚的影响
鞭毛蛋白与P.marina共同形成生物被膜和鞭毛蛋白处理P.marina细菌生物被膜后生物被膜上细菌分布状态。P.marina单一生物被膜上细菌分布均匀,呈单个菌体状态(图4 A),与对照组P.marina单一生物被膜相比较,鞭毛蛋白与P.marina共同形成生物被膜上细菌菌体聚集程度较高,细菌菌体聚集成堆,使膜厚增加,细菌密度增大(图4 B);而鞭毛蛋白处理的P.marina细菌生物被膜上细菌分布状态和膜厚无明显变化(图4 C)。
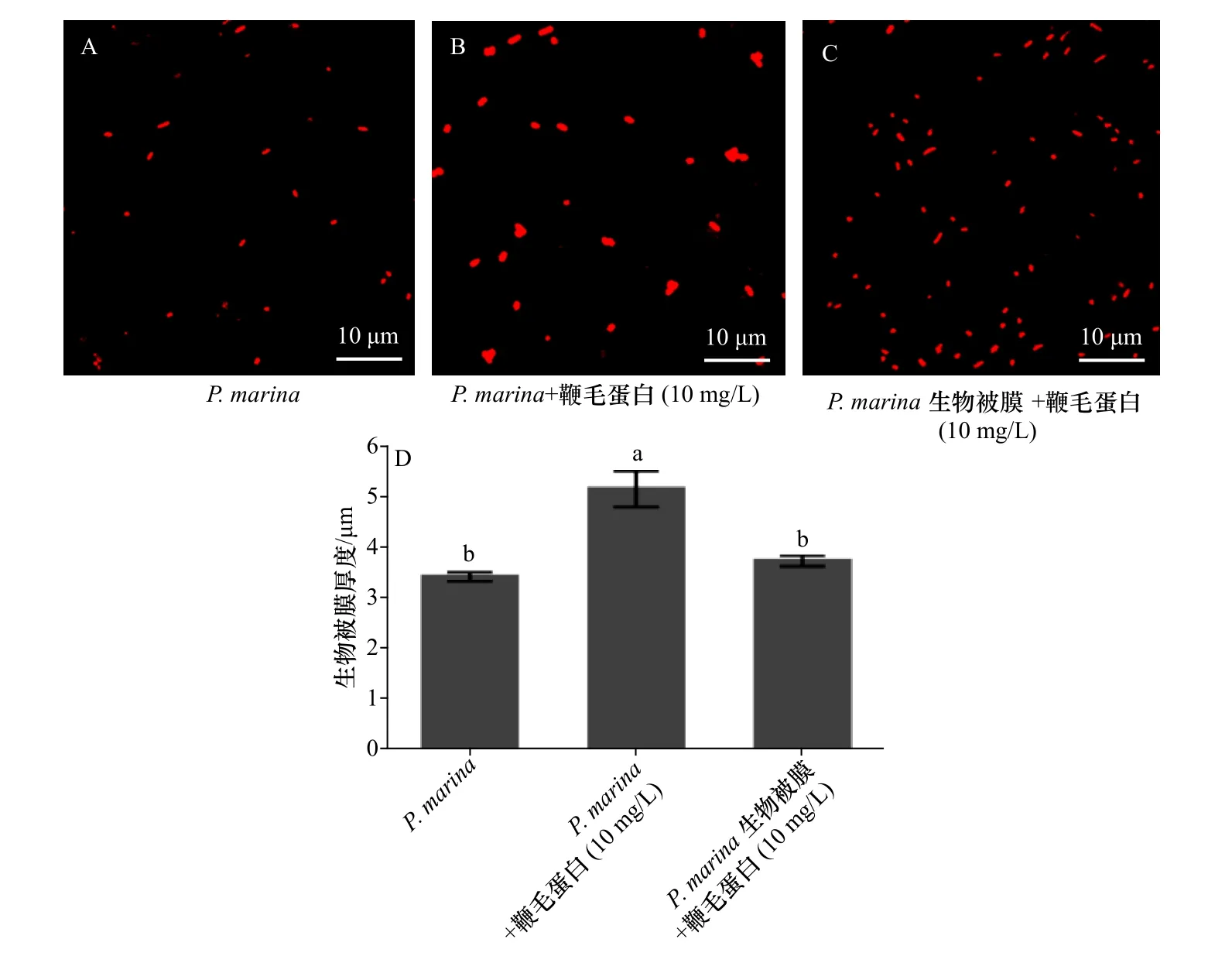
图4 激光共聚焦扫描显微镜下鞭毛蛋白对P.marina 生物被膜上细菌分布与聚集状态的影响以及鞭毛蛋白对P.marina生物被膜膜厚膜厚的影响Fig.4 Effect of flagellin on the distribution and aggregation of bacteria on P.marina biofilm by laser confocal scanning microscopy and the effect of flagellin on thickness of P.marina biofilm
3.6 鞭毛蛋白对P. marina 生物被膜上α-多糖、β-多糖、蛋白和脂类含量的影响及差异分析
P.marina单一生物被膜、鞭毛蛋白与P.marina共同形成生物被膜和鞭毛蛋白处理P.marina细菌生物被膜后胞外产物中的α-多糖、β-多糖、蛋白和脂类含量染色结果及含量差异性分析结果如图5 A和图5 B所示。对于α-多糖含量变化的比较,相比较P.marina单一生物被膜,鞭毛蛋白与P.marina共同形成生物被膜上α-多糖含量呈显著性增加(p<0.05),鞭毛蛋白处理P.marina细菌生物被膜上α-多糖含量无显著性变化,而鞭毛蛋白与P.marina共同形成生物被膜与鞭毛蛋白处理P.marina细菌生物被膜相比较,二者膜上α-多糖含量无显著性差异;对于β-多糖含量变化的比较,相比较P.marina单一生物被膜,鞭毛蛋白与P.marina共同形成生物被膜上β-多糖含量呈显著性增加(p<0.05),而鞭毛蛋白处理P.marina细菌生物被膜上β-多糖含量无变化,相比较鞭毛蛋白处理P.marina细菌生物被膜,鞭毛蛋白与P.marina共同形成生物被膜胞外β-多糖含量呈显著性增加(p<0.05);对于蛋白含量变化的比较,相比较P.marina单一生物被膜,鞭毛蛋白与P.marina共同形成生物被膜和鞭毛蛋白处理P.marina细菌生物被膜这2种方式,其胞外蛋白含量呈极其显著性增加(p<0.01),而这2种方式比较其胞外蛋白含量无显著性变化;对于脂类含量变化的比较,相比较P.marina单一生物被膜,鞭毛蛋白与P.marina共同形成生物被膜上脂类含量呈显著性增加,而鞭毛蛋白处理P.marina细菌生物被膜上脂类含量无显著变化,与鞭毛蛋白处理P.marina细菌生物被膜相比,鞭毛蛋白与P.marina共同形成生物被膜上胞外脂类含量呈显著性增加(p<0.05)。

图5 胞外产物含量Fig.5 The extracellular polymeric substance
4 结论与讨论
在海洋中生活着许多微生物,其形成的生物被膜可以影响海洋无脊椎动物幼虫附着变态[16]。根据Yang等[6]的研究发现,被膜上胞外产物如多糖、蛋白、脂类能够促进厚壳贻贝稚贝的附着,胞外产物含量的变化会对厚壳贻贝稚贝的附着造成影响。本实验选取了对厚壳贻贝稚贝附着具有较高诱导活性的海洋细菌P.marina,采用酸解超速离心法提取P.marina的鞭毛蛋白,探究了鞭毛蛋白是直接影响海洋无脊椎动物附着,或是通过调控细菌生物被膜在形成过程中的生物量和胞外产物以及生物被膜这些生物学特性的改变来影响海洋无脊椎动物附着。
4.1 提取的鞭毛蛋白对稚贝附着的影响
SDS-PAGE蛋白凝胶结果显示出两条蛋白条带,大小分别约35 kDa和27 kDa,与在P.marina基因组[13]中查到的鞭毛蛋白基因fliC条带相吻合(鞭毛蛋白基因fliC有4个亚型,其中3个亚型对应的蛋白分子量大小均为34 kDa左右,另一个亚型对应的蛋白分子量为27.21 kDa)。证明本研究所提取到的鞭毛蛋白为P.marina的fliC鞭毛蛋白混合物。而颜成英等[17]从鼠伤寒沙门氏菌中所提取的鞭毛蛋白只有单一条带,分子量大小为57 kDa,推测可能是由于菌株结构不同而产生了差异。
实验发现,把P.marina鞭毛蛋白与0.4%的琼脂糖溶液混合滴加到玻璃载玻片冷凝后可形成混合凝胶,当添加的鞭毛蛋白终浓度大于10mg/L时,能显著促进厚壳贻贝稚贝的附着。将涂有单一成分的琼脂糖凝胶组与空白对照组相比,发现二者对稚贝的诱导活性无显著差异(p>0.05)。这表明,琼脂糖作为一种载体,自身对稚贝附着是没有影响的,是一种理想的实验材料,将鞭毛蛋白与琼脂糖凝胶混合的这一实验方法具有可行性与普适性。
之前有研究表明[10],细菌鞭毛蛋白可以诱导厚壳贻贝幼虫的附着变态,当鞭毛蛋白浓度为1mg/L时,诱导活性最高,且当把鞭毛蛋白回补到缺失鞭毛蛋白基因的突变菌中后,其对幼虫附着的诱导活性可恢复到与野生菌同样的效果。随着加入的鞭毛蛋白浓度增高,厚壳贻贝幼虫出现了死亡情况。推测可能由于鞭毛蛋白也是一种毒力因子,显现出致病性,过量的鞭毛蛋白加剧了对幼虫的黏附与侵袭,导致了幼虫的死亡。在本实验中,当加入的鞭毛蛋白浓度高达到20mg/L时,稚贝仍无死亡情况。我们推测,可能是厚壳贻贝的幼虫与稚贝对鞭毛蛋白毒力的抗性不同所导致。这也进一步表明,虽然鞭毛蛋白可以调控厚壳贻贝的幼虫、稚贝的附着,且这种调控作用具有浓度依赖性,但其作用的机制存在差异。
4.2 鞭毛蛋白对生物被膜形成的影响
细菌鞭毛作为运动器官,具有运动性和趋化性,对后续生物被膜形成及宿主与环境间信号传导也有重要的影响[18]。本研究通过分析被膜的生物学特性发现,与野生型单一生物被膜相比,鞭毛蛋白与细菌共同形成的被膜上细菌生物量明显升高,细菌聚集成堆,以致于膜上细菌密度增大,膜厚增加;而将鞭毛蛋白滴加到已形成的生物被膜上室温静置1~2 h后,其膜上细菌密度、膜厚均无显著性变化。根据Pratt和Kolter[19]所提出的膜形成初始模型来看,可能是由于鞭毛蛋白在与细菌共同形成被膜的过程中,其介导的运动性与趋化性使细菌可以更快到达附着基质表面,同时使游离的细胞不断聚集。成膜过程中,鞭毛蛋白也进一步协助细菌扩散,从而促进了膜长延伸、膜厚增加。而将鞭毛蛋白滴加到已形成的被膜上的短暂处理,未能达到上述作用。但在Kim等[20]构建的关于Yersinia enterocolitica突变体研究中发现,运动性与生物被膜的形成二者间并非一个绝对的正比关系。推测运动性在被膜的形成中起重要作用但不是决定性作用。也有研究表明[7,21−22],纤维素、多糖、蛋白等胞外产物对被膜的形成也具有重要影响。
本研究通过与单一的被膜相比,发现鞭毛蛋白与细菌共同形成的生物被膜上多糖、蛋白、脂的含量都有显著增加,而滴加鞭毛蛋白溶液处理的生物被膜上多糖和脂质均无显著性变化,仅胞外蛋白含量显著性增加。我们推测,增加的蛋白可能仅是实验中添加的鞭毛蛋白而非其他胞外蛋白产物。这一结果表明,鞭毛蛋白不仅对生物被膜的形成起促进作用,还可以提高其生物学特性;而将鞭毛蛋白滴加到已形成的生物被膜上并不会改变被膜的生物学特性。这对于后续选择性培养人工被膜和胞外产物的定量有一定指导意义。
4.3 鞭毛蛋白处理后的生物被膜对稚贝附着的影响
鞭毛蛋白处理后的生物被膜除了胞外产物及生物学特性发生了变化外,其功能性也随之改变。在进行稚贝附着实验时,本研究发现鞭毛蛋白无论是在生物被膜形成前或形成后加入对稚贝的诱导活性均显著提高,稚贝附着率高达60%。表明这2种不同的处理方式都可提高厚壳贻贝稚贝的附着。
但是通过共聚焦图像分析发现,鞭毛蛋白与P.marina共同形成的被膜,其胞外多糖、脂的含量都明显高于将鞭毛蛋白滴加到已形成的被膜上。推测鞭毛蛋白也参与调控了被膜形成的过程,促进了胞外产物的分泌。而胞外多糖、蛋白等含量的增加也进一步促进了稚贝的附着。
对在已形成的被膜上添加鞭毛蛋白的分析发现,其胞外产物仅有蛋白含量增加,推测是由于添加了鞭毛蛋白,从而引起稚贝的附着率的随之升高。这一结果也间接证明了细菌鞭毛蛋白具有直接调控厚壳贻贝稚贝附着的作用。
之前的研究表明,很多胞外产物可以调控海洋无脊椎动物的附着变态,如纤维素处理后的生物被膜胞外多糖、脂含量减少,对厚壳贻贝幼虫附着变态的诱导活性降低[23];P.marina鞭毛蛋白fliP缺失的突变菌所形成的生物被膜胞外β-多糖减少,使厚壳贻贝幼虫的附着变态率降低[10]。在本研究中,鞭毛蛋白在与P.marina共同形成被膜的过程中,除了使胞外多糖含量上升,还进一步调控了胞外脂质的增加,进而影响厚壳贻贝稚贝的二次附着。推测可能在厚壳贻贝生长发育过程中幼虫和稚贝的2种附着机理之间存在差异,关于其中具体的调控机制还需要进一步的研究。
综上所述,从广泛存在于海洋环境中的P.marina中提取的鞭毛蛋白可以直接促进厚壳贻贝稚贝的附着,也能通过改变生物被膜的形成及生物学特性,间接影响稚贝附着。在厚壳贻贝附着过程中,鞭毛蛋白通过调控多糖、脂等不同的胞外产物来影响厚壳贻贝稚贝的二次附着。从附着结果来看,不同方式添加的鞭毛蛋白对稚贝附着具有同样作用,但对内在的生物被膜的形成与胞外产物的分泌还是有不同的影响。这也表明,厚壳贻贝的附着受多种因素调控,不是单一因素决定,胞外产物在生长发育的不同阶段发挥不同作用,在与宿主信息交流、物质传递方面可能存在逐级调控关系。本研究的结果为探索厚壳贻贝稚贝附着的调控机制提供了一定的理论依据,为解决海洋污损问题,改善无脊椎动物与海洋环境关系以及研究海洋微生物与其宿主的相互作用提供新的研究思路。

