福建北部海域海地瓜(Acaudina m olpadioides)的性腺发育研究
郑碧琪,鲁超,刘炜*,郭玉臣,黄文,程宏,林婧
( 1.宁德海洋环境监测中心站,福建宁德352100;2.自然资源部海洋生态监测与修复技术重点实验室,上海201206)
1 引言
海地瓜(Acaudinamolpadioides)隶属于棘皮动物门(Echinodermata)海参纲(Holothuroidea)芋参目(Molpadida)尻参科(Caudinidae)海地瓜属(Acaudina),雌雄异体,体呈纺锤形,大者体长可达20 cm(图1)。海地瓜广泛分布于我国山东至海南岛以及孟加拉湾、印度尼西亚、菲律宾、澳大利亚、日本等地,幼体阶段浮游生活,成体穴居在潮间带至水深80 m的软泥底中,少数生活在泥沙、沙泥、沙底中[1]。海地瓜作为一种低值海参,营养丰富,为高蛋白低脂肪食品,还含有皂苷、多糖、多肽等多种活性物质,具有巨大的开发潜力和市场价值[2–7]。

图1 海地瓜图Fig.1 The pictureof A.molpadioides
2015年8月,大量海地瓜在某滨海核电厂取水口聚集,导致机组的两台海水循环泵跳闸,反应堆停止运作,给核电运行带来一定的安全隐患[8]。国内外由海洋生物大量聚集导致的核电厂取水系统安全事件常见报道,如水母、毛虾、鱼群、藻类等[9–11],但是由海地瓜导致的核电厂安全事件属于首次,因此海地瓜这一物种引起了有关方面的高度重视。
目前,国内外对海地瓜的研究工作主要集中在营养成分、活性物质等方面[2−7],对其繁殖生物学相关研究基本空白。本研究运用组织学方法对海地瓜性腺发育特征进行观察并划分发育阶段,同时选择性腺指数、性腺长度、生殖管直径3个指标对海地瓜性腺进行形态学观察。根据长期的组织学和形态学观察结果,本文总结了海地瓜的性腺发育特征及其周年变化规律,并进一步探究其精卵排放类型、性别比、生殖周期、繁殖季节等内容,以期丰富海地瓜这一物种的繁殖生物学基础资料。这些研究结果不仅可以为海地瓜的养殖繁育、高值化开发利用提供理论参考,还可以为滨海核电厂邻近海域的海地瓜异常聚集灾害防控工作提供科学指导。
2 材料与方法
2.1 材料
海地瓜样本为野外采集,使用阿氏拖网采自福建北部近岸海域的沉积物中。于2018年1−12月,每月采样1次,每月样本数量为10~35只,个体的体壁重量为10~20 g,样本带回实验室观察、解剖、分析等。
2.2 方法
2.2.1 性腺形态学观察与数据统计
解剖海地瓜,观察其性腺特征。剥离性腺和体壁,用吸水纸将性腺和体壁表面水分吸干后用电子天平分别称量湿重,用以计算性腺指数(GI,性腺指数=性腺湿重÷体壁湿重×100)。用游标卡尺测量生殖管汇合处到生殖管游离端的长度,每个性腺在不同位置测量10次后取平均值代表该性腺长度。在Olympus SZX16显微镜下用目镜测微尺测量有代表性的10根生殖管的直径,取平均值后代表该性腺的生殖管直径。将每月所有样本的性腺指数、性腺长度、生殖管直径分别取平均值,以此表征该月海地瓜性腺指标值,整理1−12月各项性腺指标值,并绘制折线图。
2.2.2 性腺组织切片制作、性腺分期与数据统计
将上述称重、测量完毕的海地瓜性腺逐一编码后分别置于Bouin氏液中固定,然后委托福州金域医学检验所有限公司制作组织切片(HE染色),切片制作完成后送回本实验室,在Olympus BX 43显微镜下观察拍照,并参考廖玉麟[1]、Ramofafia等[13]描述的海参性腺发育特征进行性腺发育分期。个体发育时期鉴定以性腺切片中占切片面积50%以上的性细胞发育时相为准。统计每月样本中不同发育时期的个体数占当月样本总数的百分比,并绘制柱形图。
2.2.3 雌雄性别比例统计
通过对各性腺样本进行组织学和形态学观察,判断雌雄,记录各样本的性别,分别统计雌雄个体数量,计算海地瓜的性别比例。
3 结果
3.1 海地瓜的性腺形态特征、性别比例
海地瓜雌雄性腺均由许多分枝状的生殖管构成,在基部连成一簇,位于身体前部体腔;生殖管一端封闭,另一端汇合成一总管,开口于触手稍后方的生殖孔;生殖管长短不均一,长度通常为2~5 cm(图1 c,图2 a)。雌雄性腺在不同的发育阶段呈现不同的颜色,如成熟精巢为淡黄色(图2 b),成熟卵巢为粉橘色(图2 c)。
本研究在福建北部近岸海域共采集海地瓜样本222只,通过性腺观察,可明确性别的个体为197只,其中雌性94只、雄性103只,性别比例接近1∶1。
3.2 海地瓜性腺发育分期
根据性腺组织切片观察结果,海地瓜雌雄性腺的发育均可划分为6个时期,即休止期(I)、发育早期(II)、增长期(III)、成熟期(IV)、部分排放期(V)和排空期(VI)。
3.2.1 雄性性腺(精巢)发育分期
休止期(I):生殖管呈橙黄色,直径为0.8~1.0mm,生殖管壁厚,生殖上皮几乎不可见精原细胞和精母细胞(图3 a)。
发育早期(II):生殖管呈橙黄色,直径为1.0~1.2mm,生殖管壁厚,生殖上皮可见少量精原细胞和精母细胞(图3 b,图3 c)。
增长期(III):生殖管呈黄色,直径增大,为1.2~1.4 mm,生殖管腔明显,管壁富有弹性。生殖上皮明显褶皱,往腔中延伸。生殖上皮附着大量精原细胞(直径为3.5~4.0μm)和精母细胞(直径约3.0μm),生殖管腔中出现成熟精子(图3 d,图3 e)。
成熟期(IV):生殖管呈淡黄色(图2 b),直径显著增大,可达1.6~2.0mm。生殖管腔中密布成熟的精子(直径约1.5 μm)。此时生殖管壁很薄,生殖上皮褶皱基本消失,其上附着少量精母细胞(图3 f,图3 g)。
部分排放期(V):生殖管收缩,直径显著变小,为0.6 ~1.0 mm,生殖上皮重新出现褶皱,生殖管腔中的精子密度明显变少,生殖上皮依然附着精母细胞(图3 h)。
排空期(VI):生殖管极度收缩退化,直径很小,约0.3 mm,生殖管腔排空,有极少数精子残留,生殖上皮几乎没有精母细胞附着(图3 i)。
3.2.2 雌性性腺(卵巢)发育分期
休止期(I):生殖管呈橙黄色,直径为0.8 ~1.0 mm,生殖管壁厚,生殖上皮几乎不可见卵原细胞和卵母细胞(图4 a)。
发育早期(II):生殖管呈橙黄色,直径为1.0 ~1.2 mm,生殖管壁厚。生殖上皮可见少量卵原细胞(直径约20μm)和卵黄发生前的卵母细胞(直径为50~80μm),呈嗜碱性,HE染色呈蓝紫色(图4 b)。
增长期(III):生殖管呈淡黄色,直径增大,约1.5 mm。生殖管腔中出现卵黄发生期卵母细胞(直径约120μm)和成熟卵细胞(直径约200μm),HE染色呈红色。生殖上皮附近是卵原细胞及卵黄发生前的卵母细胞群(图4 c)。
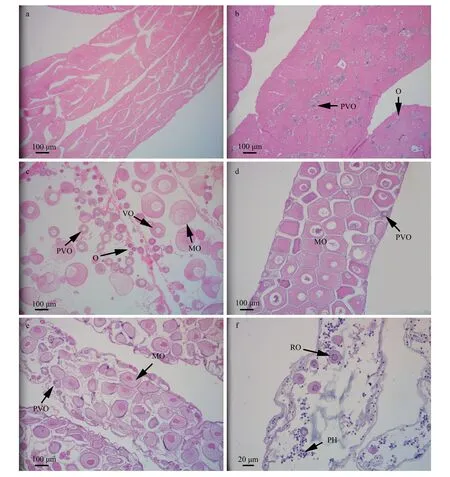
图4 海地瓜卵巢不同发育阶段的组织结构特征Fig.4 Histological featuresof A.molpadioides ovary at different stages
成熟期(IV):生殖管呈粉橘色(图2 c),管粗,直径可达1.8 ~2.0 mm,管壁透明富有弹性。管内充满成熟卵细胞,直径可达200μm,几乎肉眼可见。由于卵细胞体积大、数量多,在有限的管腔中互相挤压,其形状呈不规则多边形。生殖上皮附着少量卵黄发生前卵母细胞(图4 d)。
部分排放期(V):生殖管呈淡粉色,收缩变细,直径为0.6 ~1.0 mm。大部分卵细胞已经排放,管腔中卵细胞数量明显变少。生殖上皮附着有卵黄发生前卵母细胞。此时管腔中出现吞噬细胞(图4 e)。
排空期(VI):生殖管呈黄色,变得空瘪,直径仅约0.3 mm,长度也明显收缩。管腔中的卵细胞几乎全部排放,仅余极少量卵母细胞,此时残留的性细胞正在崩坏。管腔中可见吞噬细胞。管腔中还有残留的块状物,为性细胞的崩坏产物(图4 f)。
3.3 海地瓜性腺组织学周年观察结果
海地瓜性腺组织学的周年观察结果如图5 所示,每个月份的雌雄海地瓜所处的发育时期是一致的,说明同一时期雌雄海地瓜性腺发育程度基本同步。休止期(I)个体出现在8−10月,发育早期(II)个体出现在11月至翌年3月,增长期(III)个体出现在4−5月,成熟期(IV)个体仅出现在5月,部分排放期(V)个体出现在5−8月,排空期(VI)个体出现在6−9月。总体上看,海地瓜性腺组织的发育有时间规律性,呈一定的季节相关性。
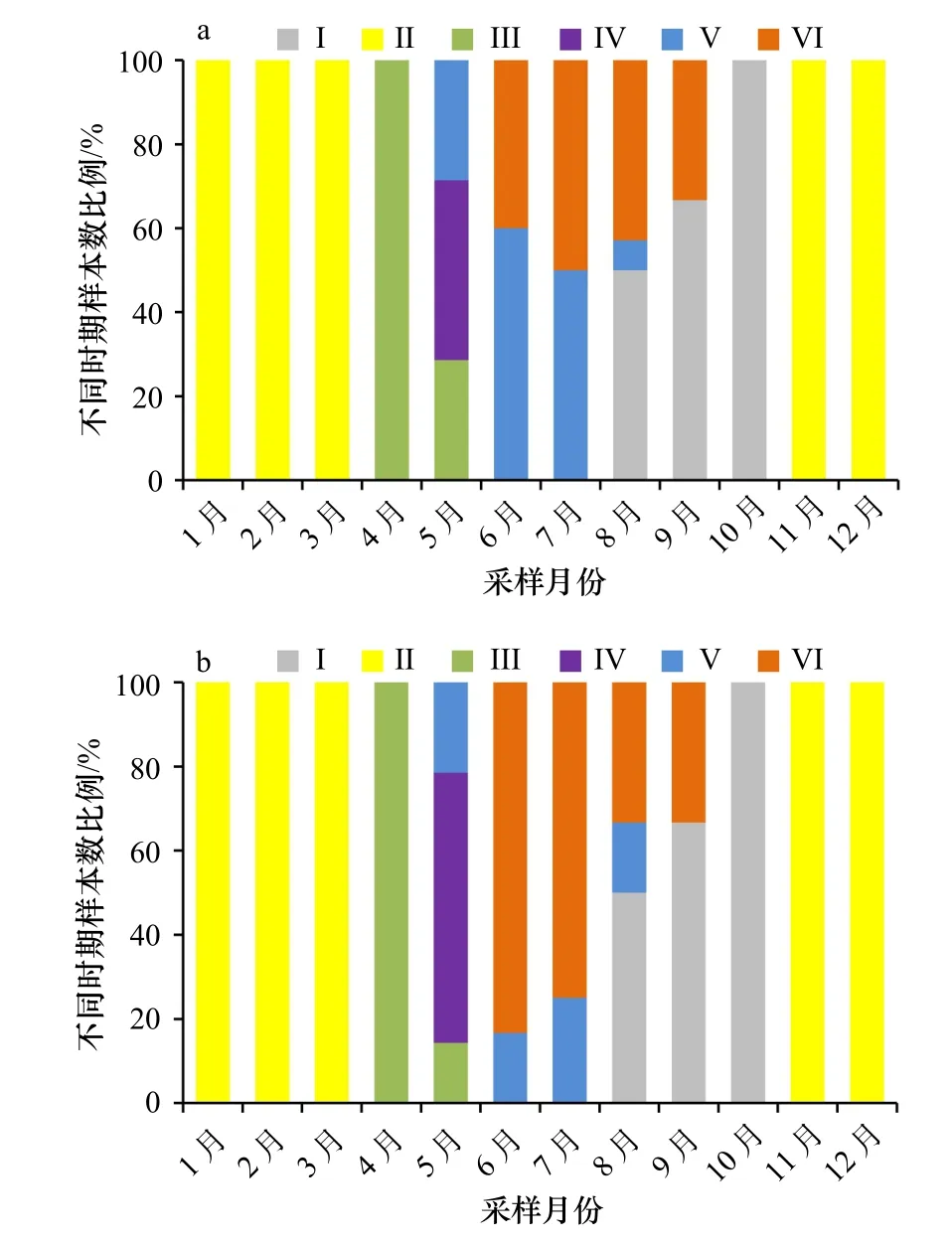
图5 海地瓜精巢(a)和卵巢(b)发育的周年变化Fig.5 Annual variation of testis (a)and ovary (b)development in A.molpadioides
3.4 海地瓜性腺形态学周年观察结果
由于海地瓜精巢和卵巢的外在形态一样(都是由分枝状的生殖管构成),并且其组织发育基本同步(图5),因此精巢和卵巢在形态上的周年变化也大致同步,故不对雌雄形态学各指标值(性腺指数、性腺长度、生殖管直径)分别统计。1−12月海地瓜的形态变化统计结果如图6 所示,各指标值的周年变化趋势有一定的相似性。
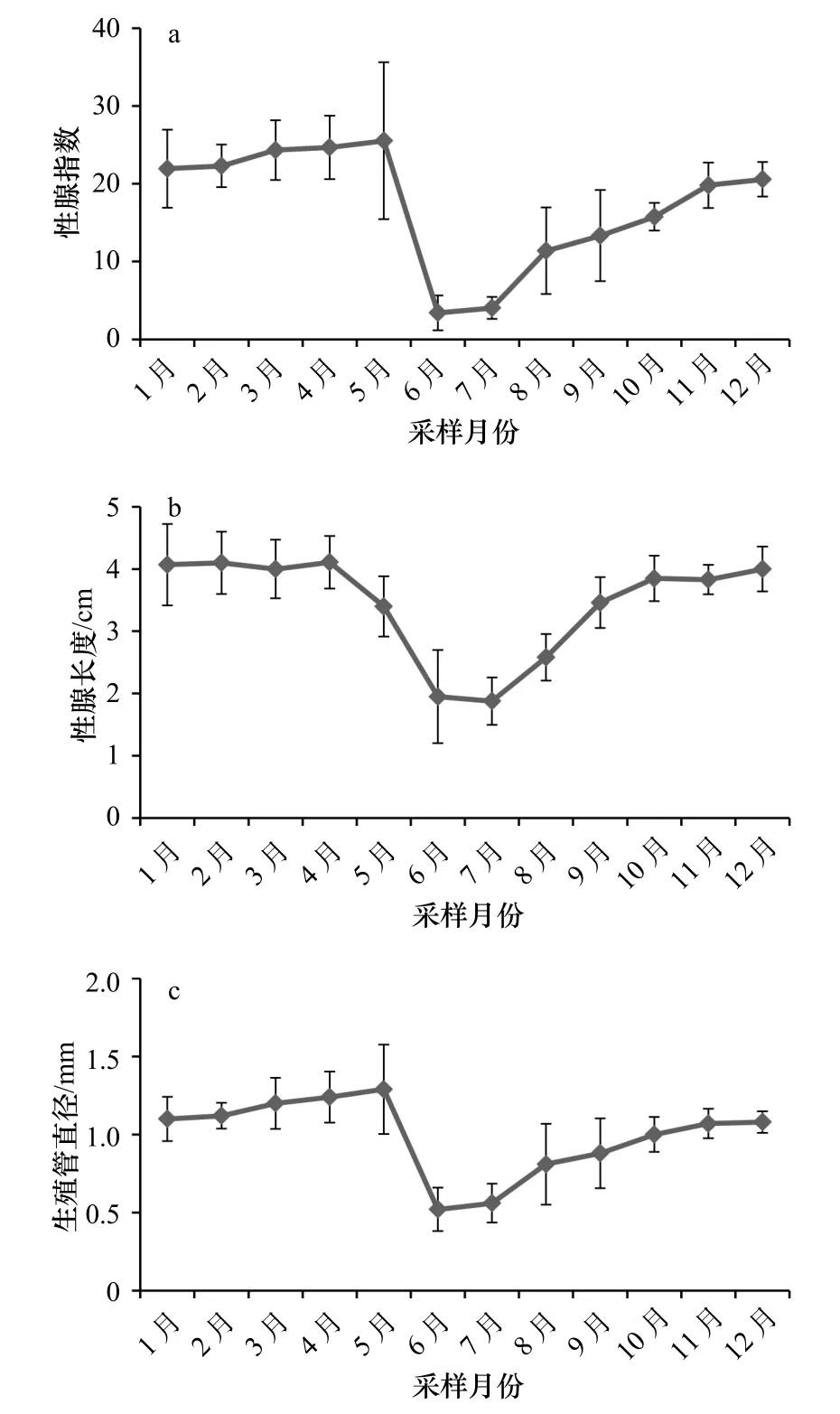
图6 海地瓜性腺形态的周年变化Fig.6 Annualvariation of gonadal morphology in A.molpadioides
海地瓜性腺指数的全年平均值为17.3,最高值出现在5月,低值出现在6月和7月。5月海地瓜性腺指数平均值为25.5 ,指数范围为9.2 ~42.9 ,跨度较大;6月、7月海地瓜性腺指数平均值分别为3.4 、4.0 ,指数范围为0.8 ~10.6 。6月是海地瓜性腺指数变化的拐点,该月性腺指数骤降至最低值,7月持续走低,8月起性腺指数有明显回升并在之后的月份里稳定上升直至翌年5月。
海地瓜性腺长度的全年平均值为3.4 cm。10月至翌年4月性腺长度较为稳定,在4 cm左右,5月性腺长度有一定下降,6月、7月性腺长度降至最低值,8月、9月性腺长度逐渐升高。5月海地瓜性腺长度平均值为3.4 cm,长度范围为1.8 ~4.1 cm;6月、7月性腺长度平均值为分别为2.0 cm、1.9 cm,长度范围为1.0 ~4.0 cm。
海地瓜生殖管直径的全年平均值为1.0 mm,最大值出现在5月,低值出现在6月、7月,8月起生殖管直径逐渐回升直至翌年5月。5月海地瓜生殖管直径平均值为1.29 mm,直径范围为0.6 ~2.0 mm;6月、7月样本的生殖管直径平均值分别为0.52 mm、0.56 mm,直径范围为0.3 ~0.8 mm。
4 讨论
4.1 海地瓜的性别比
统计海地瓜样本的雌雄个体数量,雄性103只、雌性94只,结果显示海地瓜性别比例接近1∶1。许多学者的统计表明大多数海参雌雄比例基本接近1∶1,如Ramofafia等[13]报道所罗门群岛糙海参(Holothuria scabra)的雄参428只、雌参414只;杨学明等[14]统计海南岛糙海参的雄参66只、雌参62只,尖塔海参(Holothuria spinifera)的雄参96只、雌参86只[15],Psolus fabricii的雄参595只、雌参607只[16]。Cameron和Fankboner[17]认为,海参雌雄比1∶1有助于增加卵子受精的几率。
4.2 海地瓜性腺发育的组织结构特征
从性腺发育的全过程看,海地瓜性腺发育在精/卵原细胞、精/卵母细胞、配子数量、生殖管壁厚度、生殖上皮等方面发生了一系列显著变化。在性腺发育的早期阶段,少量的精原细胞和卵原细胞出现并附着在生殖上皮上;中期阶段(成熟期)精子和卵细胞的数量达到最大,充满生殖管腔;后期阶段随着配子排放,生殖管腔变空。在整个性腺发育过程中,生殖管壁逐渐变薄,生殖上皮褶皱出现、消失又重现。可见海地瓜性腺在不同发育阶段变化显著,利用上述特征的变化可判断海地瓜个体性腺发育所处的阶段以及群体的发育水平。
在增长期(III),海地瓜精巢生殖管上皮发生明显的褶皱且往管腔中延伸(图3 d),在糙海参[18]和黄乳海参(Holothuria fuscogilva)[19]的增长期精巢中也有这样的形态。Cameron和Fankboner[17]认为,生殖管上皮褶皱的作用是增大精子发生的面积,Giese等[20]也发现褶皱的生殖管上皮有利于管壁的上皮细胞从血液中吸收更多的营养物质供给精母细胞发育。笔者同意上述观点。在海地瓜精巢发育成熟之前,精子的发育、增殖需要通过生殖上皮从血液中摄取大量营养物质,当精子发育完成后,不再需要褶皱的生殖上皮提供营养,褶皱减少或消失,性腺进入成熟期。
在海地瓜卵巢发育的部分排放期(V )和排空期(VI)出现吞噬细胞。吞噬细胞是卵巢发育晚期的显著特征,其作用是吞噬并分解残留的卵细胞,将其营养物质供给位于生殖上皮附近正在发育的卵母细胞。在糙海参[18]、P. fabricii[16]和Stichopusmollis[21]这3种海参的卵巢发育中也有类似情况,说明吞噬细胞的存在可能是海参纲物种卵巢发育过程中的一种普遍现象。
4.3 海地瓜的精卵排放类型
在大多数海地瓜性腺组织切片中观察到一个切片中同时存在多个发育阶段的性细胞,特别是处于增长期(III)、成熟期(IV)和部分排放期(V)的性腺切片中,除了精/卵细胞外,还有精/卵母细胞同时存在,因此推测海地瓜性腺发育模式为非同步发育,配子分批成熟。此外,处于部分排放期(V)的性腺说明海地瓜配子呈现部分排放现象,这种情况也见于对其他海参的报道,如糙海参[14]、黄乳海参[19]、仿刺参(Apostichopus japonicus)[22]。廖玉麟[1]认为,海参并不是一次把生殖细胞都排放掉,而是间断排放。可见海地瓜属于多次排精卵类型。
4.4 海地瓜性腺发育的周年变化规律
《中国动物志:棘皮动物门(海参纲)》中对海参生殖的相关描述为,海参的生殖过程大体上相似,先是精卵排放,后是生殖管的破坏,再是在生殖腺基部的生长带长出新管[1]。结合图5 和图6 中海地瓜性腺组织学和形态学的周年观察结果,本文推测,海地瓜性腺发育的周年变化规律如下:5月大多数海地瓜性成熟,并开始分别排放精子和卵细胞,配子排放持续到8月结束。精卵排放过程中同时伴随着生殖管的自体破坏,然后长出新管,性腺开始新一轮发育。8−10月新的生殖管逐渐生长,11月新的生殖细胞开始生成并发育,至翌年3月性腺基本还处于发育早期阶段,4月性腺进入增长期,生殖细胞发育迅速,至5月大量生殖细胞成熟,即性腺成熟。如此循环往复,海地瓜完成一轮又一轮生殖繁育活动。并由此可知,海地瓜生殖为明显的周年生殖类型,即生殖周期为1年,同样大连沿海的仿刺参[23]以及澳大利亚的糙海参[24]其生殖周期也为1年。
4.5 海地瓜的繁殖季节
根据海地瓜性腺发育的周年变化,可知海地瓜性腺成熟时间在5月,并且在5−8月进行了配子排放,因此本研究推断,海地瓜的繁殖期在5−8月(夏季)。Thorson[25]提出热带海洋无脊椎动物随着纬度增高,其繁殖规律由持续性产卵变成季节性产卵的假说。以糙海参为例,所罗门群岛(9°S)的糙海参能够全年产卵繁殖[13];海南岛(18° N)的糙海参种群在全年绝大部分时间均可繁殖,繁殖盛期为5−8月(夏季)及12月至翌年2月(冬季)[14];新喀里多尼亚(21°S)的糙海参的繁殖期在每年夏季和冬季,即一年2次[26];澳大利亚(27°S)的糙海参繁殖期为每年1次,每年集中在夏季产卵[24]。可见不同纬度栖息地的糙海参的繁殖期不尽相同,其繁殖规律呈明显的地域性特点,符合Thorson[25]的假说。本研究的海地瓜样本采自福建北部近岸海域(27° N),其繁殖期为一年1次,集中在5−8月(夏季)。那么其他纬度地区的海地瓜的繁殖时间如何,则有待进一步研究。

