三种食用菌多糖及其复合多糖功能性评价研究
张博华,张 明,范 祺,王崇队,杨立风,孟晓峰,马 超
(中华全国供销合作总社济南果品研究院,山东济南 250014)
食用菌多糖是存在于食用菌中的重要活性分子,是一类具有免疫调节[1]、抗氧化[2]、抗肿瘤[3]、降血糖[4]、抑菌[5]等独特生理活性的天然大分子化合物。大球盖菇(Stropharia rugoso-annulata),别名皱环球盖菇、酒红色球盖菇或斐氏球盖菇,是一种珍稀的食用菌。大球盖菇口感极佳,颜色诱人,富含多种对人体有益的矿物质、蛋白质、维生素以及多糖[6],其提取的大球盖菇多糖对增强机体免疫力有非常重要的作用,大球盖菇多糖具有抗氧化作用,并对病毒肿瘤等疾病有有效作用[7]。金针菇被称为益智菇,金针菇多糖是金针菇中主要生物活性成分,具有抗氧化等多种生物活性[8]。香菇多糖(lentinan,LNT)是从香菇子实体中浸提得到的一种含支链分子的多糖,它的主要成分是β-(1→3)-D-葡聚糖,是具有抗氧化等生物活性的大分子物质[9]。
近年来,人们越来越多地认识到食用菌多糖的多种功能,其在食品工业、发酵工业及医药卫生产业上的应用也越来越广泛。中国食用真菌种类繁多,具有很大的研究空间[10]。近年来,食用菌多糖也正由单独应用研究向多糖与多糖间的协同效应研究转变[11]。本研究结合食用菌多糖在抗氧化方面的应用,以大球盖菇、金针菇、香菇为原料,提取其多糖,对食用菌单一多糖及其组成的复合多糖抗氧化活性与体外降血糖作用进行评价,以期为食用菌资源的利用、多糖产品的开发提供理论依据。
1 材料与方法
1.1 原料与仪器
1.1.1 原料
大球盖菇、金针菇、香菇,均购于山东恒宝食品集团有限公司。
1.1.2 试剂与仪器
无水乙醇、水杨酸、磷酸二氢钠、磷酸氢二钠、铁氰化钾、H2O2、三氯乙酸,分析纯,国药集团化学试剂有限公司提供;DPPH,麦克林试剂有限公司提供。
SHA-B 双功能水浴恒温振荡器,江苏杰瑞尔电器有限公司;N-1100 旋转蒸发仪,EYELA 公司;FC 酶标仪,Thermo 公司仪器有限公司;BG2-240 电热鼓风干燥箱,上海博讯医疗生物仪器股份有限公司;KQ-250B 型超声波清洗器,昆山市超声仪器有限公司;TDL-5A 低速大容量多管离心机,上海安亭科学仪器厂;KDM 型调温电热套,山东鄄城华鲁电热仪器有限公司。
1.2 方法
1.2.1 三种食用菌多糖的制备
(1)三种食用菌粗多糖提取
分别取大球盖菇、金针菇、香菇的干制品打粉过60目筛,将粉碎后的物料用超声辅助热水浸提法提取,于90 ℃水中提取3 h,冷却后于5 000 r/min 条件下离心5 min,取上清液进行减压浓缩至固形物含量为8%左右,将浓缩液、无水乙醇按照体积比1∶4 比例混合,混匀,密封,静置过夜后抽滤,絮状物即为粗多糖,将其冻干称量质量后备用[12]。将三种多糖分别配置成2 mg/mL 的水溶液作为三种多糖溶液备用。将三种提取冻干后所得的多糖按照质量比1∶1∶1 的比例混合后,制成2 mg/mL 的水溶液作为复合多糖溶液备用。
(2)Sevage 法脱蛋白制取澄清多糖溶液
取粗多糖干品,用少量水溶解,按比例加入Sevage试剂(V样品∶V氯仿∶V正丁醇=100∶20∶4),密封后超声处理15 min,4 000 r/min 离心15 min,收集上清液,除去底层的有机溶剂和中间的变性蛋白。再次加入Sevage 试剂,重复4~6 次至无白色沉淀为止,得到澄清的多糖溶液[13]。
1.2.2 食用菌多糖抗氧化活性分析
(1)DPPH·清除能力测定
准确称取DPPH 标准品2.56 mg,用无水乙醇定容至100 mL,使其浓度为6.5×105mol/L。样品管中分别加入0.5mL、2 mg/mL 样品溶液、2.5 mLDPPH,避光反应30 min,0.5 mL 蒸馏水和2.5 mL 乙醇混匀做零管,于515 nm 处测定吸光度A样品。蒸馏水代替样品溶液按上述处理测定吸光度为A空白,用无水乙醇乙醇代替DPPH 按上述处理测定吸光度为A对照,DPPH·自由基清除率按照公式(1)计算得出[14]。
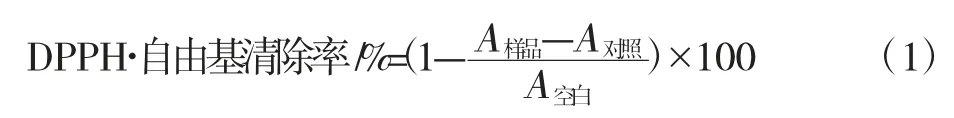
(2)·OH 清除能力测定
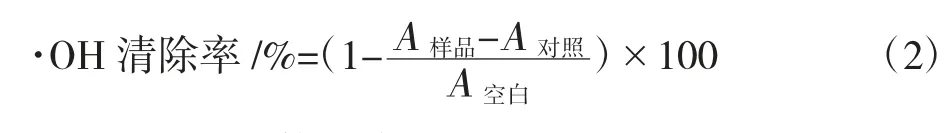
FeSO4和H2O2反应生成·OH,后者能够氧化水杨酸,其产物在510 nm 处有吸光值,吸光值大小与·OH 成正比。样品管内依次加入0.2 mL、2 mg/mL 样品溶液,1 mL、0.15 mmol/L 的FeSO4,1 mL、6 mmol/L H2O2,0.4 mL、2 mmol/L 的水杨酸和0.4 mL 蒸馏水。37 ℃水浴1 h,冷却后以蒸馏水调零,于510 nm 处测定其吸光度为A样品,蒸馏水代替水杨酸按上述处理测定吸光度为A对照,用蒸馏水代替样品溶液测得A空白,以Vc 作为阳性对照按上述处理测定吸光度,·OH 清除率按照公式(2)计算得出[15]。
1.2.3 食用菌多糖体外降血糖作用研究
(1)体外α-葡萄糖苷酶活性抑制作用研究
取400 μL、2 mg/mL 的样品溶液加入到96 孔板中,然后加入400 μL、100 U/mL 的α-葡萄糖苷酶,混匀,37℃孵育10 min,加入200 μL、7.5 mmol/L PNPG,用柠檬酸溶液调至pH 4 左右,37 ℃孵育30 min,最后加入1 mol/L Na2CO3溶液1.5 mL 结束反应,于410 nm 波长下测定其吸光度[16]。
(2)体外α-淀粉酶活性抑制作用研究
取多只试管,分别加入1.5 mL、8 mg/mLα-淀粉酶溶液、50 μL PBS 缓冲液(pH 6.1)、50 μL 柠檬酸缓冲液(pH 5.6),依次加入300 μL 质量浓度为2 mg/mL 的样品溶液,涡旋混匀,于37 ℃水浴中孵育10 min,分别加入100 μL、1%淀粉溶液,涡旋混匀,于37 ℃水浴中恒温30 min,加入375 μL DNS 试剂,涡旋混匀,100 ℃沸水浴中加热10 min,冷却至室温,与蒸馏水按照1∶4 稀释混匀,分别于473 nm 波长处测定其吸光度[17]。
1.3 数据处理
采用Origin 8.0 等分析软件对数据进行分析,试验结果均为3 次试验的平均值。
2 结果与分析
2.1 食用菌多糖的制备
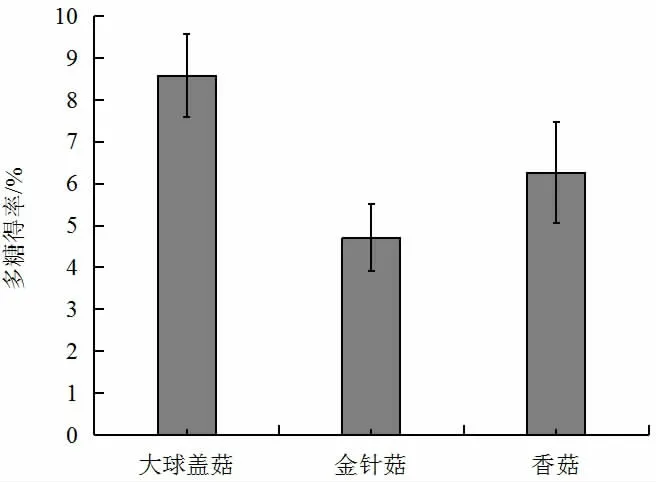
图1 三种食用菌多糖得率Fig.1 Extraction rate of polysaccharides from three edible fungi
通过上述1.2.1 的提取方法进行三种食用菌多糖,大球盖菇多糖得率为8.58%、金针菇多糖得率为4.71%、香菇多糖得率为6.26%。
2.2 食用菌多糖抗氧化活性研究
2.2.1 DPPH·清除能力
DPPH 是一种稳定的在517 nm 处有强吸光度的氮中心自由基,它可与自由基清除剂电子配对而使吸光度下降,下降程度与电子数量成正比,故而被广泛用于食用菌等多糖抗氧化活性的检测[18]。三种食用菌多糖及复合多糖的DPPH 自由基清除率见图2。
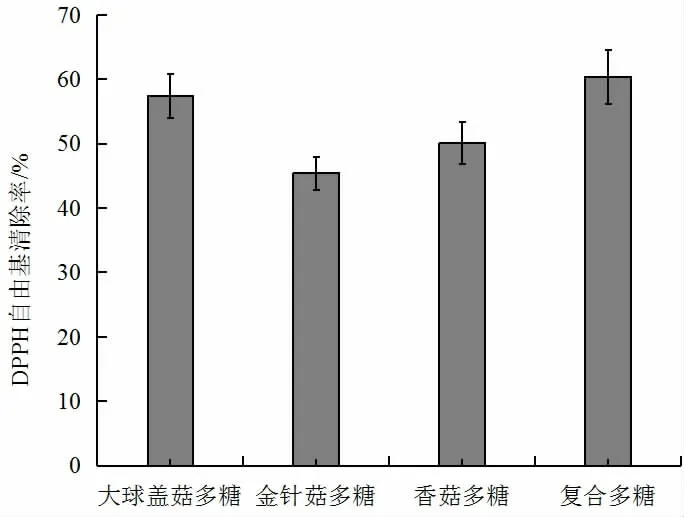
图2 三种食用菌多糖及复合多糖DPPH 自由基清除率Fig.2 DPPH radical scavenging capacity of three kinds of edible fungus polysaccharides and compound polysaccharides
由图2 可知,三种食用菌多糖均具有一定的DPPH自由基的清除能力,当多糖浓度为2 mg/mL 时,复合食用菌多糖对DPPH 自由基的清除率为60.4%,明显高于其他三种单一多糖,是金针菇多糖清除率的1.33 倍。同时,大球盖菇多糖的DPPH 自由基的清除率最高为57.44%,优于香菇多糖50.1%。张志超等[19]在试验中也得出结论,四种食用菌多糖浓度在2.5 mg/mL 时,复合食用菌多糖(猴头菇多糖∶平菇多糖∶香菇多糖∶杏鲍菇多糖=1∶1∶1∶1)的DPPH·清除能力远高于单一品种多糖的清除能力。
2.2.2 ·OH 清除能力
羟基自由基具有较强的氧化活性,可造成生物体的过氧化损伤,通常被认为是有害自由基,·OH 清除能力广泛用于评价样品抗氧化能力[20]。三种食用菌多糖及复合多糖·OH 清除率见图3。
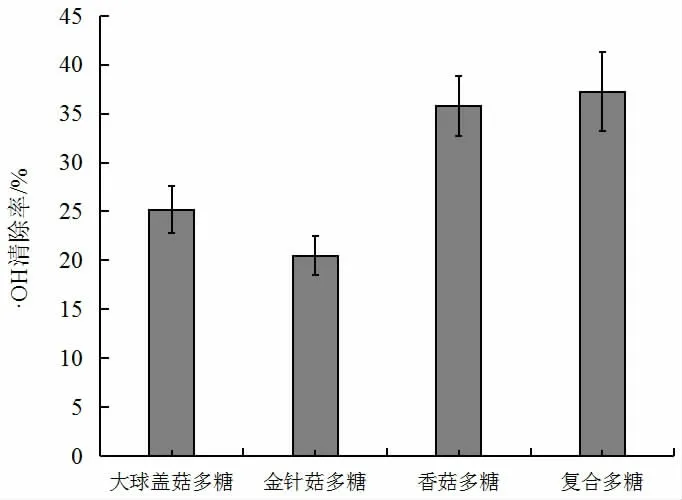
图3 三种食用菌多糖及复合多糖·OH 清除率Fig.3 ·OH radical scavenging capacity of three kinds of edible fungus polysaccharides and compound polysaccharides
由图3 可知,当多糖浓度为2 mg/mL 时,大球盖菇多糖、金针菇多糖、香菇多糖均具有一定的·OH 清除能力,其·OH 清除能力为香菇多糖的>大球盖菇多糖>金针菇多糖。复合食用菌多糖的·OH 清除率为37.26%,是金针菇多糖的1.18 倍,说明复合多糖的·OH 清除率优于单一食用菌多糖,李俊丽等[21]认为原因在于多糖链是大分子长链,在氢键的作用下当溶液中存在2 种或者几种不同多糖的大分子长链时,会导致不同多糖链之间产生相容性,从而引起构象的改变,在这个过程中,多糖的C—H链快速与·OH 发生反应而结合成水,大大减少了·OH 自由基在体系中的量,这对复合食用菌多糖的开发利用具有极其重要的指导意义。倪焱等[22]对两种常用食用菌平菇与香菇与金针菇的多糖化合物通过复配,并研究了其抗氧化活性,发现当平菇多糖与金针菇多糖浓度为0.2 mg/mL,配比为1∶1 时,·OH 清除率比单一的金针菇多糖、平菇多糖分别高18.0%、32.6%。且随着浓度的上升,清除率也在逐渐增加,浓度1.0 mg/mL 达到最高,为92.2%,比金针菇多糖高出了24.0%。
2.2.3 还原能力
抗氧化产品通过还原作用释放电子来清除自由基,还原力与抗氧化性能成正比,故而还原能力可作为评价样品抗氧化性能的指标。采用铁氰化钾来测定样品还原力,样品与Fe3+反应生成Fe2+,在700 nm 处后者含量与吸光度值呈正相关[23]。三种食用菌多糖及复合多糖还原力见图4。

图4 三种食用菌多糖及复合多糖还原力分析Fig.4 Total reducing power of three kinds of edible fungus polysaccharides and compound polysaccharides
如图4 所示,大球盖菇多糖、金针菇多糖、香菇多糖均具有一定的还原力,且金针菇多糖>大球盖菇多糖>香菇多糖。而复合多糖的还原力最强,是香菇多糖的1.55倍。张志超等[19]研究表明四种食用菌多糖猴头菇多糖、平菇多糖、香菇多糖、杏鲍菇多糖按照1∶1∶1∶1 复配后,在浓度为2.5~10 mg/mL 时复合食用菌多糖的还原力高于单一品种多糖的还原力。
2.3 食用菌多糖体外降血糖作用研究
2.3.1 不同食用菌多糖对α-葡萄糖苷酶活性的抑制率
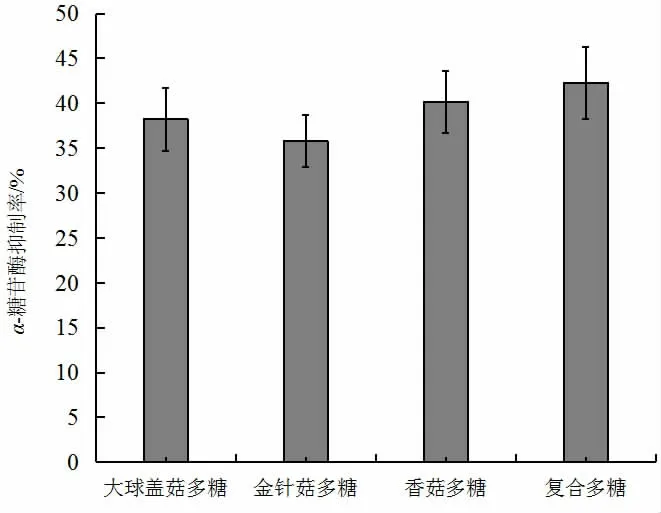
图5 三种食用菌多糖及复合多糖对α-糖苷酶抑制率的分析Fig.5 α-glycosidase inhibitory ability of polysaccharides three kinds of edible fungus polysaccharides and compound polysaccharides
在Ⅱ型糖尿病治疗的早期,我国糖尿病防治指南推荐的一线药物是α-葡萄糖苷酶抑制剂。它是以延缓肠道碳水化合物吸收而达到降低餐后高血糖的口服降糖药,其作用特点是在糖消化的最后一步抑制双糖降解为单糖[24]。在多糖浓度为2 mg/mL 食用菌多糖对α-糖苷酶抑制作用结果见图6,由图6 可知,三种单一食用菌多糖均有一定的α-糖苷酶抑制作用,且α-糖苷酶抑制率为香菇多糖>大球盖菇多糖>金针菇多糖。复合食用菌多糖的α-糖苷酶抑制率是金针菇多糖的1.18 倍,均大于单一品种的食用菌多糖,呈现一定的多糖协同作用。
2.3.2 不同食用菌老茎多糖对α-淀粉酶的抑制率研究
α-淀粉酶抑制剂能延缓食物淀粉在肠道中的消化,抑制餐后血糖水平的升高,其作用机制是通过抑制胃肠道内唾液、胰淀粉酶活性,从而起到降低糖尿病患者餐后高血糖、高血脂作用,有利于Ⅱ型糖尿病患者的饮食治疗[25]。在多糖浓度为2 mg/mL 食用菌多糖对α-淀粉酶抑制作用结果见图6,由图可知,三种单一食用菌多糖均有一定的α-淀粉酶抑制作用,且α-淀粉酶抑制率为香菇多糖>大球盖菇多糖>金针菇多糖。复合食用菌多糖的α-淀粉酶抑制率是金针菇多糖的1.2 倍,大于单一品种的食用菌多糖,呈现一定的多糖协同作用。
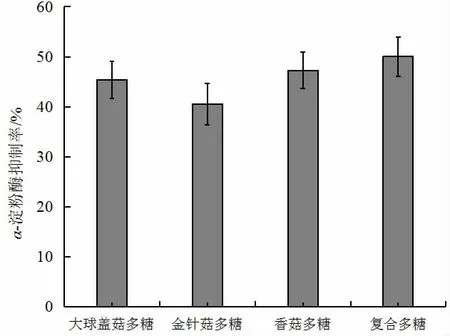
图6 三种食用菌多糖及复合多糖对α-淀粉酶抑制率的分析Fig.6 α-amylase inhibitory ability of polysaccharides three kinds of edible fungus polysaccharides and compound polysaccharides
3 讨论
大球盖菇、金针菇和香菇都有很厚的真菌细胞壁,直接用热水浸提效果有限,而使用超声波辅助进行处理,既可以进行物理破壁又不会破坏多糖的生物活性。多糖提取率最高,大球盖菇、金针菇、香菇三种食用菌多糖的提取率分别为8.58%、4.71%、6.26%。
三种真菌多糖均具有抗氧化和降血糖的作用,复合多糖的抗氧化能力与降血糖能力均优于单一品种多糖。多糖是长链大分子化合物,在氢键的作用下当溶液中存在2 种或者几种不同多糖的大分子长链时,会导致不同多糖链之间产生相容性,从而引起构象的改变,进而引发反应,提高了抗氧化活性。复合食用菌多糖浓度均为2 mg/mL 时,复合多糖的DPPH 清除率、羟自由基清除率、还原力分别达到60.4%、37.26%与0.31,实验表明复合多糖可表现出良好的正协同性。同时以α-糖苷酶抑制率和α-淀粉酶抑制率来表征多糖的体外降血糖作用,结果显示复合多糖的降血糖能力也优于单一品种多糖,复合食用菌多糖浓度为2 mg/mL 时,α-糖苷酶抑制率和α-淀粉酶抑制率分别为42.26%和50.01%。食用菌菌丝多糖抗氧化活性不同,表明不同食用菌中含有的多糖种类不同,以致抗氧化能力不同。复合多糖中存在多种多糖,不同多糖结合不同自由基的能力不同。一种真菌多糖通常只对某一种生理效应有作用,一些真菌多糖复合使用时,呈现协同作用。

