骨髓增生异常综合征患者基因突变及临床特征分析
杨保晴,张子恺,吴 昊,陈毓华,梁爱斌,傅建非
(同济大学附属同济医院血液科,上海 200065)
骨髓增生异常综合征(myelodysplastic syndro-mes,MDS)是一组起源于骨髓造血干/祖细胞的恶性克隆性疾病,其特征是骨髓的一系或多系病态造血,外周血细胞减少及急性髓系白血病(acute mye-loid leukemia,AML)转化等[1]。随着二代测序(next generation sequencing,NGS)技术的发展,越来越多在MDS中具有病理意义的基因突变被确定[2]。这些分子指标对患者的疾病诊断、危险分层、预后评估和指导个体化治疗等具有重要的临床意义。然而,不同中心关于MDS基因的突变特征及其与临床特征关系的报道不尽相同。本研究分析了同济大学附属同济医院血液科62例MDS患者的基因突变谱及染色体核型、临床特征、实验室检查结果、MDS亚型、IPSS-R积分等指标,并探讨了基因突变对上述指标的影响。
1 资料与方法
1.1 一般资料
依据《骨髓增生异常综合征中国诊断与治疗指南》(2019年版)标准,经骨髓形态学、免疫分型、细胞遗传学、分子生物学和骨髓活检等检查明确诊断的62例初发MDS患者纳入本研究。其中MDS伴单系病态造血(MDS with single lineage dysplasia,MDS-SLD)3例,MDS伴多系病态造血(MDS with multilineage dysplasia,MDS-MLD)32例,MDS伴环形铁粒幼细胞(MDS with ring sideroblasts,MDS-RS)7例,MDS伴单纯5q-1例,MDS伴原始细胞增多 Ⅰ 型(MDS with excess blasts subtype 1,MDS-EB-1)10例,MDS伴原始细胞增多 Ⅱ 型(MDS with excess blasts subtype 2,MDS-EB-2)9例,无MDS不能分类型(unclassifiable MDS,MDS-U)。
1.2 方法
1.2.1 标本收集 抽取初诊MDS患者的骨髓血5 mL,EDTA抗凝,采用Ficoll密度梯度离心法获得单个核细胞,应用Qiagen公司DNA提取试剂盒提取基因组DNA,置-70 ℃冰箱备用。
1.2.2 NGS测序 所测基因均为与MDS相关、突变率高、较为热门的34种基因。构建34个MDS相关的基因文库。通过Ion Ampliseq多重PCR扩展技术,一次性抓取待检测的所有基因,并将构建好的文库用Life Technologies平台Ion Proton半导体测序仪进行检测。NGS扩增子平均基因覆盖率达99%,平均测序深度1 000X,90%以上的序列可以与靶标区目的序列比对上,靶标区碱基覆盖度较均一。致病性突变位点选择主要根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南、专家共识、单核苷酸形态性数据库(database of Single Nucleotide Polymorphism,dbSNP)、肿瘤中体细胞突变目录(Catalogue of Somatic Mutations in Cancer,COSMIC)等数据库及参考文献报道确定,均为已明确与MDS发病及预后相关的基因。34个高频基因为ASXL1,BCOR,BCORL1,CALR,CBL,CEBPA,CSF3R,DNMT3A,ETNK1,ETV6,EZH2,FLT3,IDH1,IDH2,JAK2,KIT,KRAS,MPL,NF1,NPM1,NRAS,PHF6,PIGA,PTPN11,RUNX1,SETBP1,SF3B1,SRSF2,STAG2,TET2,TP53,U2AF1,WT1,ZRSR2。
1.2.3 染色体核型分析 采用常规G显带技术进行染色体核型分析。取患者初诊时骨髓悬液2~4 mL,常规无菌细胞培养24~72 h,加入秋水仙碱在37 ℃培养箱孵育20~30 min,使细胞分裂静止在中期,使用固定液(甲醇∶冰醋酸=3∶1)固定,滴片并烘干玻片,常规G显带,染色体核型分析参考《人类细胞基因组学国际命名体制(ISCN2016)》进行描述。
1.3 统计学处理
所有数据均采用SPSS 21软件进行统计分析。计数资料采用卡方检验或Fisher确切概率法分析,计量资料采用秩和检验或t检验分析,基因型频率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 NGS测序结果
本研究的62例初诊MDS患者中,共有52例患者至少携带1种基因突变,阳性率为83.87%,最多的同时携带6种基因突变。其中仅携带1种基因突变的有27.42%(17/62),同时携带2种、3种、4种、5种、6种基因突变的患者分别为27.42%(17/62)、14.52%(9/62)、8.06%(5/62)、3.23%(2/62)、3.23%(2/62)。34种检测基因中各基因突变发生率见图1,其中IDH2、MPL、NF1、NPM1、CSF3R、FLT3、ETNK1、PIGA未检测到突变,突变率最高的是TET2和DNMT3A基因,分别为19.35%和17.74%,其次为ASXL1基因(突变率16.13%)。突变率大于10%的基因还包括EZH2、SF3B1、U2AF1和TP53基因。从突变基因类型看表观遗传相关基因突变是MDS中最易受累的,有59.68%(37/62)的患者具有一种或多种表观遗传相关基因突变。其他如RNA剪接因子相关基因的突变发生率也较高。
2.2 临床特征与基因突变的相关性分析
62例患者中男性40例,女性22例,年龄跨度为28~88岁,平均年龄为64.56±14.82岁,中位年龄为67.50岁,其中≥60岁47例,占75.81%。62例患者的MDS亚型分布见图2,有32例患者核型异常。各亚型中,MDS-EB型基因突变最高,为(2.21±1.47)个。进一步根据NGS测序情况把62例患者分为NGS突变阳性组和NGS突变阴性组,比较两组间的临床特征,包括MDS亚型、血常规、核型、铁蛋白、LDH、血清铁、骨髓原始细胞比例、国际预后评分(IPSS-R)等指标,见表1。统计结果显示,NGS突变阴性组的白细胞总数及中性粒细胞数均明显高于NGS突变阳性组,差异有统计学意义(P=0.022 4、P=0.043 8),而在其他方面的差异均无统计学意义。

图2 62例患者的MDS亚型分布Fig.2 The distribution of MDS subtypes in 62 patients
2.3 DNMT3A基因突变与临床特征的相关性分析
62例MDS患者中共检测到11例患者发生DNMT3A突变,阳性检出率为17.7%(11/62)。所有患者均为杂合型突变,突变类型主要为移码突变(1例,c.2193_2195del,p.Phe732del)和点突变(10例)。DNMT3A突变组和DNMT3A非突变组之间的年龄、性别、MDS亚型、血常规、血清铁、铁蛋白以及核型方面无显著差异。但DNMT3A突变组骨髓原始细胞比例、IPSS-R评分均低于DNMT3A非突变组,差异有统计学意义(P=0.018、P=0.016 9),见表2。本研究进一步比较了DNMT3A突变组和NGS阴性组在上述临床指标的差异,统计分析显示,DNMT3A突变组在LDH>250 U/L的发生率及IPSS-R评分方面均明显低于NGS阴性组,差异有统计学意义(P=0.038 3、P=0.022 7)。这11例患者中有7例患者均合并其他基因突变,从合并突变类型看,仍然是表观遗传调控因子的比例最高。合并突变阳性的患者的平均年龄明显低于合并突变阴性的患者,差异有统计学意义(P=0.036)。

表2 DNMT3A突变组和DNMT3A非突变组患者临床资料比较Tab.2 Clinical data of DNMT3A mutation group and DNMT3A non-mutation group
2.4 TET2基因突变与临床特征的相关性分析
62例MDS患者中共检测到12例患者发生TET2突变,阳性检出率为19.4%(12/62),是本研究中突变比率最高的基因。所有患者均为杂合型突变,突变类型主要为:移码突变1例[c.4105_4108 del TCAG(p.Ser1369GlyfsTer78)];点突变11例。12例TET2突变患者中有10例患者均合并其他基因突变,从合并突变类型看,仍然是表观遗传调控因子的比例最高。
TET2突变组和TET2非突变组之间在年龄、性别、亚型、白细胞计数、血小板计数、血清铁、铁蛋白、LDH、骨髓原始细胞数方面无明显差别,但TET2突变组的血红蛋白计数要明显高于TET2非突变组(P=0.035 7),TET2突变组异常核型发生率和IPSS-R评分要显著低于TET2非突变组(P=0.040、P=0.044),见表3。进一步比较TET2突变组和NGS阴性组在上述临床指标的差异,统计分析显示TET2突变组的血红蛋白计数同样要明显高于NGS阴性组(P=0.035),而TET2突变组的异常核型发生率要显著低于NGS阴性组(P=0.035)。

表3 TET2突变组和TET2非突变组患者临床资料比较Tab.3 Clinical data of TET2 mutation group and TET2 non-mutation group
2.5 TP53基因突变与临床特征的相关性分析
62例MDS患者中共检测到9例患者发生TP53突变,突变率为14.5%(9/62)。除1例患者为纯合突变,其他均为杂合型突变,此纯合突变为移码突变[214_215 del CCinsGG(p.Pro72Gly)],其他均为点突变。9例TP53突变阳性患者有6例合并其他基因突变,合并突变主要涉及表观遗传调控基因。
TP53突变组和TP53非突变组患者在年龄、性别、亚型、白细胞计数、血红蛋白、血清铁、铁蛋白、LDH、骨髓原始细胞数、IPSS-R等方面差异无统计学意义(P>0.05)。TP53突变组血小板计数及血清铁水平明显低于TP53非突变组(P=0.023、P=0.003),而LDH水平和IPSS-R明显高于TP53非突变组(P=0.001、P=0.002),见表4。进一步比较了TP53突变组和NGS阴性组在上述临床指标的差异,统计分析显示TP53突变组血小板计数、白细胞计数及血清铁水平均明显低于NGS阴性组(P=0.026、P=0.046、P=0.023)。
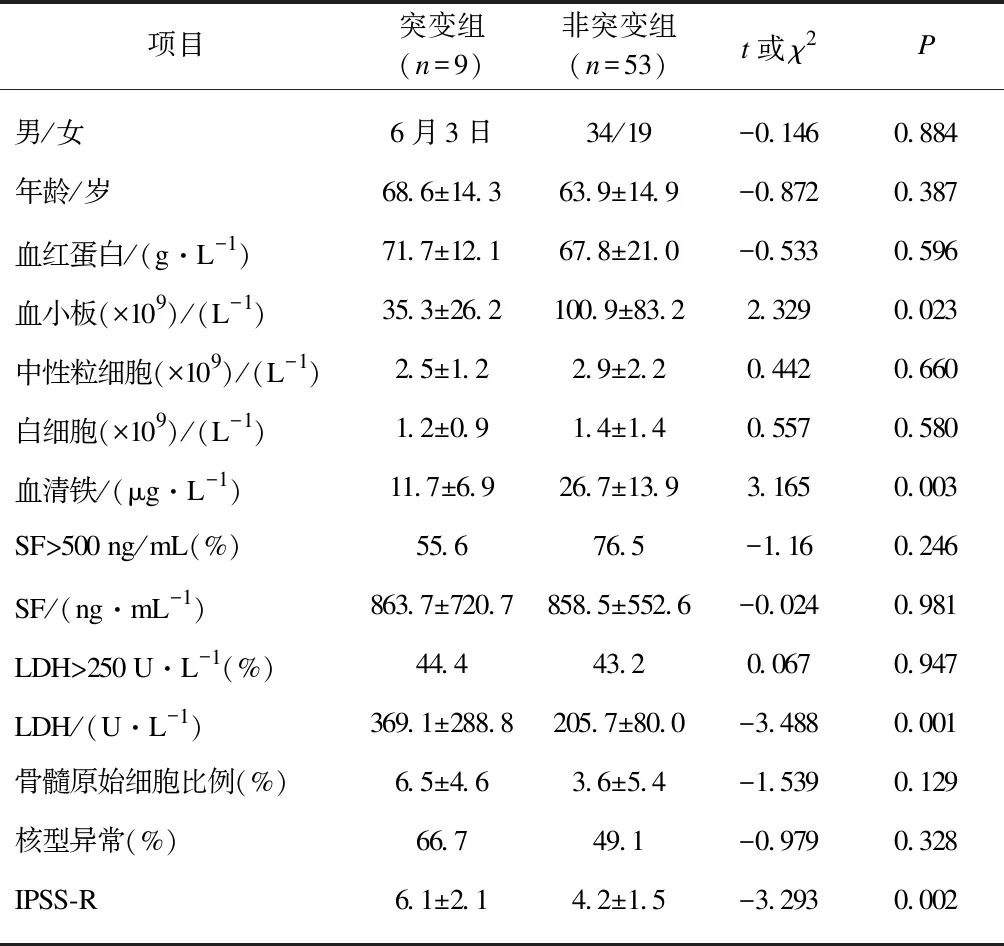
表4 TP53突变组和TP53非突变组患者临床资料比较Tab.4 Clinical dataof TP53 mutation group and TP53 non-mutation group
3 讨 论
MDS是一组高度异质性疾病。原发性MDS中基因突变的检出率近90%,对MDS的治疗及预后评估有重要价值。在本研究中,83.87%的患者可检测到至少一种基因突变,29.03%(18例)的患者可检测到3种以上基因突变,突变频率最高的基因是表观遗传相关基因,突变组的白细胞总数及中性粒细胞数均明显低于非突变组,说明基因突变加重了骨髓衰竭的程度,与国内外报道一致。
TET2基因和DNMT3A基因都是表观遗传相关的重要基因。TET2突变与正常核型相关,但TET2基因突变的预后意义尚存在一定争议。TET2基因突变在本研究的样本中发生率最高,TET2突变组的血红蛋白水平明显高于TET2非突变组及NGS阴性组,而异常核型发生率显著低于TET2非突变组及NGS阴性组。有研究表明,在MDS发生的较早阶段,基因突变率低,表观遗传基因较RNA剪切因子较早发生[1]。Kosmider等[3]观察到TET2突变是MDS中的常见分子事件,并且是预后良好的独立预测因子,各种分化谱系亦提示TET2突变发生在疾病发展的早期[4]。本研究结果证实了这些观点,TET2基因突变组具有更良性的临床特征。本样本中TET2突变位点均不相同,其中33.3%突变位点位于TET2基因的BOX1保守结构域,包括错义突变和移码突变,导致正常的氨基酸编码提前终止。DNA甲基化特异性抑制剂在MDS治疗中,TET2突变阳性组疗效较无基因突变组显著[5-6]。另一项研究鉴定了213例接受阿扎胞苷或地西他滨治疗的MDS患者中40个基因的突变[6],当排除ASXL1突变和TET2低频率突变的患者时,这种改善反应更加明显(P=0.009)。这些研究均证实了DNA甲基化特异性抑制剂在该类基因突变阳性患者中的疗效。而TET2基因BOX1保守结构域的高频突变也提示此结构域有可能成为新的治疗靶点。
越来越多的研究[7-10]证实了DNMT3A在MDS发病中的作用,但是不同研究对DNMT3A基因突变发生频率的报道差异较大(2.6%~20.2%)。在本研究中,DNMT3A突变发生率仅次于TET2,为17.7%。1例患者检测到的移码突变致使第732位编码氨基酸发生丢失,与不良预后相关,该突变既往在MDS患者有过报道[11]。1例患者检测到错义突变c.2645G>A(p.Arg882His),为DNMT3A基因的热点突变,该突变可降低酶的催化活性及其与DNA的亲和力,可能与髓系恶性转化有一定的相关性[12]。部分突变(c.1978T>Cp.Tyr660His,c.1969G>Ap.Val657Met,c.2146G>Ap.Val716Ile,c.1916T>G p.Leu639Arg)在淋巴瘤、AML患者有报道,但未见在MDS患者的报道,临床意义不明确[13-15]。DNMT3A基因突变是急性髓系白血病的不良预后因素[12],但其在MDS中DNMT3A突变与临床表现的相关性报道不一[7,16]。尚无研究揭示DNMT3A突变对生存的显著影响,甚至有研究出现DNMT3A突变的患者接受异基因HSCT的患者比未接受异基因HSCT的患者具有更好OS(P=0.038)[17]。本研究中DNMT3A突变组骨髓原始细胞比例、IPSS-R评分均低于DNMT3A非突变组,DNMT3A突变组在LDH>250 U/L的发生率及IPSS-R评分方面均明显低于NGS阴性组,提示DNMT3A突变并没有导致更严重的临床表现和AML转化倾向,与Bejar等[6]的报道一致。本研究中11例DNMT3A突变阳性患者中有7例患者均合并其他基因突变,包括SF3B1等其他基因突变的存在可能削弱了DNMT3A突变对疾病严重度的负性影响,还需要进一步的前瞻性研究、更大的样本量证实这一点。
TP53基因编码的P53蛋白具有多种靶基因,很多都与细胞凋亡或细胞周期调控过程有关,通过与这些基因内部或上游的P53反应元件相结合的方式反式激活这些基因的转录,促进细胞死亡或生长停滞。在原发MDS中TP53基因突变发生率为5%~10%[12],本研究中TP53突变发生率达14.5%,可能与本课题62例患者的年龄较大(平均年龄、中位年龄均高于国内既往报道的数据)有关。报道显示TP53基因突变多发生在老年MDS患者中,年轻患者相对少见[18]。9例TP53突变阳性患者中,有1例为纯合突变,其余均为杂合突变。突变频率均高于40%,突变位点涉及TP53基因编码蛋白的DNA Binding结构域(如c.716A>Gp.Asn239Ser),四聚体化结构域(如c.1009C>Tp.Arg337Cys)等突变热点,通过影响基因的正常剪切,降低转录活性,氨基酸编码提前终止等方式影响基因正常功能。其中c.218T>C(p.Val73Ala)突变暂未检索到与恶性血液疾病的相关报道。本研究显示,TP53突变组在血小板计数、白细胞计数、LDH、IPSS-R等临床特征方面差于TP53非突变组,提示了TP53突变患者的骨髓衰竭程度,疾病危险度分组均更差于TP53非突变患者,提示TP53突变患者预后不良。在11例仅携带1种基因突变的患者中,有3例患者仅携带TP53突变,亦说明TP53单基因突变亦具有较强的致病性。TP53靶向药物Eprenetapopt已在骨髓增生异常综合征患者中显示了良好的抗肿瘤活性。TP53突变的MDS患者对Eprenetapopt和阿扎胞苷的联合治疗耐受性良好,可产生较高的临床反应率和分子缓解率[19]。更多TP53靶向药物可能被研制出,有望改善MDS患者的预后。
综上所述,本研究说明MDS患者基因突变发生率高,不同的基因突变与不同的临床特征相关,深入研究MDS患者基因突变与临床特征、疾病预后、个体化治疗等方面的相关性具有重要意义。

