红豆草组织培养及植株再生体系的优化
康红霞, 朱永红, 赵 萌, 贾 姝, 伍国强
(兰州理工大学生命科学与工程学院, 甘肃 兰州 730050)
红豆草(OnobrychisviciifoliaScop.)是一种多年生、异花授粉的四倍体豆科牧草,又名驴食草,原产于欧洲和前苏联亚洲部分,在中国新疆天山和阿尔泰山北麓有野生种分布。20世纪50年代以来,我国先后从前苏联、匈牙利等国家引进红豆草,最初主要在甘肃省中部干旱半干旱区推广种植,随后在青海、宁夏等省(区)也有大量栽培。红豆草根系发达,根部有根瘤,有生物固氮能力,可提高土壤肥力[1];营养丰富,含有大量缩合单宁,牲畜喜食且不得膨胀病,被誉为“牧草皇后”[2]。但由于红豆草对盐碱环境较为敏感,其产量和品质无法满足草地畜牧业日益增加的需求[3-5]。因此,需要通过生物技术等手段来改良红豆草的抗逆性。
红豆草组织培养体系的研究开展较早,上世纪80年代张谦和郑国锠[6]以子叶、下胚轴和根为外植体诱导出愈伤组织,并获得少量再生植株。此后,国内外学者对红豆草再生体系做了较多的研究[7-13]。然而,由于红豆草外植体(真叶、上胚轴、下胚轴等)很难形成愈伤组织,即使少量外植体能形成愈伤组织,也很难分化和生根[13],限制了红豆草的遗传改良和分子育种进程。因此,建立和优化红豆草的高效组织培养及植株再生体系仍具有重要的现实意义。正交设计是一种高效、快速和经济的试验方法[14],不但可以优化培养基,还可以确定再生体系中各阶段的主因素。张龙等[15]采用正交试验法对豆科牧草柱花草(Stylosanthesguianensis)愈伤组织的诱导和分化培养基进行优化研究,建立了高效的组织培养体系。目前,利用正交设计法建立和优化红豆草的高效组培及植株再生体系却鲜有报道。
因此,本研究采用正交试验设计法,探究不同激素组合的培养基对红豆草愈伤组织诱导及分化的影响,以期建立一种高效的组培及植株再生体系,为红豆草的遗传改良和生物育种奠定可靠基础。
1 材料与方法
1.1 试验材料
试验材料为‘甘肃’红豆草(O.viciifoliaScop. ‘Gansu’),种子购自兰州农丰种苗科技有限公司,产地为甘肃省静宁县,采集时间为2015年8月。
兴趣是最好的老师。教师可以从培养学生的朗读兴趣入手,激发学生的阅读兴趣,使其主动地、积极地去探求知识。激发兴趣,关键是根据课文的特点和学生的实际,充分运用适合儿童心理特征的教学手段,导之以趣。例如采用精心设计导言、创设情境、看图导入等教学方式,激发学生朗读课文的兴趣。
1.2 试验方法
采用Excel软件对所测数据进行统计分析,用平均值和标准误表示测定结果。用SPSS 17.0对结果进行方差分析和极差分析。
新一轮数学课程改革强调数学课程的出发点是学生全面、持续、和谐地发展,这就要求教师在教学中不仅需要遵循学生学习数学的普遍规律,还需要关注学生的特殊性.“由于学生所处的文化环境、家庭背景和自身思维方式的不同,学生的数学学习活动应当是一个生动活泼的、主动的和富有个性的过程”.
外植体愈伤组织诱导率(%)=
(产生愈伤组织的外植体数/接种的外植体数)
×100%。
通过方差分析可知(表3),以上胚轴和下胚轴为外植体诱导愈伤组织时,NAA对红豆草愈伤组织的诱导作用存在极显著差异(P<0.01),其他2种激素的影响较小;以真叶为外植体时,NAA对红豆草愈伤组织的诱导作用存在显著性差异(P<0.05)。3个影响因素的主次关系是:NAA>ZT>6-BA。由表4可知,Kn为该因素在n水平下所产生的平均效应值(在此处为愈伤组织的诱导率);R为该因素在不同水平下的极差,即该因素在不同水平下的最大值与最小值之差|Xmax-Xmix|,R的大小反映了该因素对试验结果的影响大小。极差分析结果表明,3种植物激素对红豆草上胚轴、真叶和下胚轴3种外植体愈伤组织诱导率的作用效果不同,其中NAA的影响最大,其次为ZT和6-BA。水平优选后可得出诱导红豆草上胚轴产生愈伤组织的最佳浓度组合为 0.2 mg·L-16-BA+2.5 mg·L-1NAA+1.0 mg·L-1ZT;诱导红豆草真叶产生愈伤组织的最佳浓度组合为1.0 mg·L-16-BA+2.5 mg·L-1NAA+2.5 mg·L-1ZT;诱导红豆草下胚轴产生愈伤组织的最佳浓度组合为1.0 mg·L-16-BA+0.5 mg·L-1NAA+0.2 mg·L-1ZT。

表1 诱导愈伤组织的正交试验设计因素水平Table 1 Factors and levels of orthogonal experiments on callusinduction
由表2可知,25个实验处理组都成功诱导出愈伤组织,但是诱导率却存在明显差异。在无激素添加的MS培养基中愈伤组织诱导率(上胚轴17.50%、真叶12.25%和下胚轴28.00%)明显低于其他添加激素的培养基。其中对红豆草上胚轴愈伤组织诱导效率最高的激素组合是MS+0.5 mg·L-16-BA+2.5 mg·L-1NAA+0.2 mg·L-1ZT,诱导效率高达94.25%;对真叶愈伤组织诱导效率最高的激素组合是MS+0 mg·L-16-BA+1.0 mg·L-1NAA+1.0 mg·L-1ZT,诱导率达到94.5%;对下胚轴愈伤组织诱导效率最高的激素组合是MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA+2.5 mg·L-1ZT,愈伤组织诱导率达91.75%。
1.2.2愈伤组织的诱导 将5~7 d龄的红豆草无菌苗外植体(上胚轴、真叶和下胚轴)接种到愈伤组织诱导培养基上。愈伤组织诱导采用3因素5水平的正交试验设计,以MS为基本培养基,添加细胞分裂素6-BA(0,0.2,0.5,1.0和2.5 mg·L-1)和ZT(0,0.2,0.5,1.0和2.5 mg·L-1)、生长素NAA(0,0.2,0.5,1.0和2.5 mg·L-1)各5水平(表1)。共25组实验,每组重复3次,每个培养皿接种7个外植体。愈伤组织诱导率作为评价指标。黑暗培养3~5 d,待外植体的切痕边缘出现膨大后开始光照培养(16 h·d-1,光照强度1 800 Lx),7 d后开始出现愈伤组织(图1b)。每隔14 d继代一次,30 d后统计愈伤组织诱导率。
其次,高校学生个体的差异性。高校学生人数多,对知识的掌握程度也不同,因此,分析学生教学对象的差异性,了解学生是实施差异教学的关键。学生的层次不同,教师在选择思想政治教育的方法也要因人而异。
1.3 数据分析
1.2.1无菌苗培养 选取籽粒饱满、大小均匀的种子,剥去种荚后,剔除破损、发霉和发黑的种子,将挑选出的色泽光亮的种子在冰箱4℃冷藏1 d。用蒸馏水清洗后,在超净工作台上先用75%乙醇震荡消毒30~60 s,再用3% NaClO溶液消毒8~14 min,无菌水清洗3~5次;然后用无菌滤纸吸干种子表面残余水分后接种于含有MS培养基的培养瓶中,每瓶接种7粒种子,在人工气候培养箱中培养,条件为昼夜温度25℃/18℃,光周期16 h·d-1,光照强度1 800 Lx,光照培养5~7 d,获得无菌苗(图1a)。

图1 红豆草愈伤组织诱导、生根及再生苗Fig.1 Callus induction,rooting culture,and regenerationplant of sainfoin注:a表示实生无菌苗;b表示愈伤组织诱导;c表示不定芽分化;d表示继代培养后的愈伤组织;e表示分离出的长出2~3叶的不定芽苗;f表示生根诱导前生长出3~5叶的不定芽;g表示生根培养;h表示再生植株;i表示再生植株的底部视图和长度测量Note:a is Aseptic seedlings;b is Callus induction;c is Adventitious bud differentiation;d is Isolated Callus after subculture;e is Isolated adventitious shoots with 2~3 leaves;f is Adventitious bud before rooting with 3~5 leaves;g is Rooting culture;h is Regeneration plant;i is Bottom view and length of regenerated plants
2 结果与分析
2.1 外源激素对愈伤组织诱导的影响
1.2.4试管苗生根培养 当不定芽长出3~5片真叶时,将其切下接种到生根培养基中(图1f,g),进行生根诱导。以1/2MS为基本培养基,添加NAA(0,0.5 mg·L-1)和IBA-K(0,0.2 mg·L-1)。每个处理30瓶,重复3次,每瓶接种1个不定芽。15 d后观察生根情况,统计生根率。
1.2.3不定芽诱导 选择质地松软、生长状况良好的愈伤组织,切成约1 cm3的小块,然后接种到不同激素配比的分化培养基中。不定芽诱导采用3因素5水平的正交试验设计,以MS为基本培养基,添加6-BA(0,0.2,0.5,1.0和2.5 mg·L-1)和ZT(0,0.2,0.5,1.0和2.5 mg·L-1)、NAA(0,0.2,0.5,1.0和2.5 mg·L-1)各5水平(表1)。共25组实验,每组重复3次,每瓶接种4块愈伤组织。培养10 d后在一些组织结构比较松散的愈伤组织上出现较深绿色的突出,继续培养3~5 d,这些突出的愈伤组织就会发展成不定芽(图1c-e),然后统计不定芽诱导率。愈伤组织的不定芽诱导率(%) = (产生不定芽的愈伤组织数/接种的愈伤组织数)×100%。
阿里并不知菩萨是做什么的。他只觉得四处花花绿绿人叫马喧的,热闹得好玩。陌生人真是太多了,阿里便不停地跟人说:“我叫阿里。”人们便都望着他笑,笑容友善。阿东点了一炷香,递给阿里,叫他拜菩萨时说:“姆妈要我开心。”
1.2.5炼苗 幼苗生根后继续培养2周,选取根系完整,株高3~4 cm的试管苗(图1 h,i),洗净根部残留的培养基,然后移栽到装有已消毒的蛭石和营养土1∶1体积比例混合的花盆中,将花盆用保鲜膜覆盖。花盆装盘,每隔2 d浇一次水,保持湿润,置于培养室培养3周左右以适应环境,随后逐渐移除保鲜膜直至植株完全暴露到环境中。

表2 不同处理对红豆草愈伤组织诱导和不定芽分化的影响Table 2 Effects of different hormone treatments on callus induced and induction of adventitious bud in callus of sainfoin
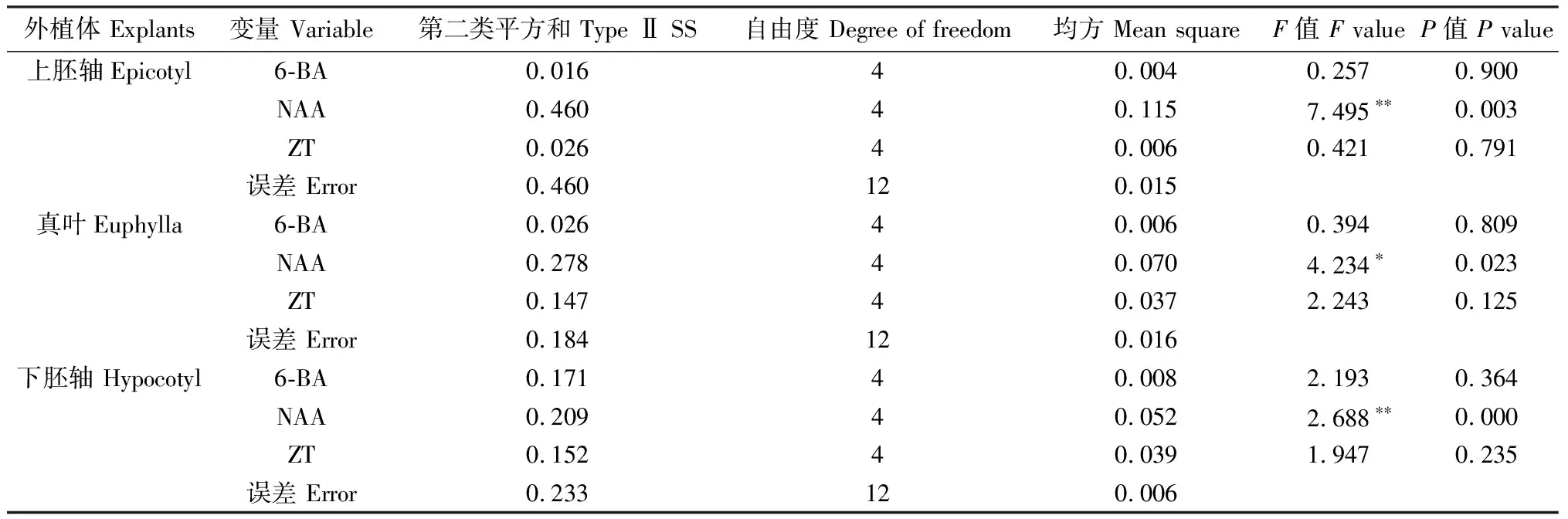
表3 红豆草愈伤组织诱导结果方差分析Table 3 Variance analysis of calls induction results in sainfoin

表4 红豆草组织培养正交试验结果的极差分析Table 4 Range analysis of orthogonal test results intissue culture of sainfoin
2.2 外源激素对愈伤组织分化不定芽的影响
由表2可知,不定芽诱导阶段,在没有添加激素的培养基中不定芽分化率仅5.76%,明显低于添加激素的培养基。方差分析结果表明(表5),NAA,6-BA及ZT对红豆草不定芽分化率的影响无显著性差异。从表4极差分析可知,3种植物激素对红豆草愈伤组织分化不定芽的诱导影响大小顺序为NAA>6-BA>ZT。尽管NAA对不定芽的诱导影响最大,但随着NAA浓度的增加,不定芽的诱导率反而呈逐渐下降趋势,表明高浓度NAA对红豆草不定芽诱导有抑制作用。水平优选后即可得出适宜红豆草不定芽分化的培养基是MS+0.5 mg·L-16-BA+0.5 mg·L-1ZT。

表5 红豆草不定芽分化结果方差分析Table 5 Variance analysis of adventitious bud differentiation results in sainfoin
2.3 不同培养基对生根的影响
愈伤组织分化的不定芽由愈伤组织提供营养物质逐渐长成幼苗,但由于其主要营养物质由愈伤组织提供,故而再生幼苗没有出现根组织。由表6可知,不同处理中的生根率存在差异,在没有添加植物激素的1/2 MS和1/2 MS+0.5 mg·L-1NAA培养基上没有生根。添加0.2 mg·L-1IBA-K的培养基上虽然有根形成,但是生根率很低(5%)。同时添加低浓度的NAA (0.5 mg·L-1)和IBA-K (0.2 mg·L-1)时,培养10 d左右即可形成完整根系,且根长而多(图1 h)。由此可见,本试验中适宜红豆草生根的最佳培养基为1/2 MS+0.5 mg·L-1NAA+0.2 mg·L-1IBA-K,生根率高达45%(表6)。

表6 不同生根培养基上的生根效果Table 6 Rooting effects on the different rooting media
3 讨论与结论
无菌操作是植物组织培养的基本要求[16-18],对种子消毒可以很大程度上降低其染菌率[19]。因此本试验使用乙醇和NaClO溶液对红豆草种子消毒,可以保证外植体具有良好的生理状态。在植物组织培养过程中,植物细胞受到生理、生化等多种因素的影响,其中生长调节剂是最关键的限制因素之一[32]。调节激素种类和水平,可以很大程度上优化组培体系。实践证明,将正交设计应用于植物组织培养,一方面能够用最少的处理得到最佳的组合,另一方面可以确定组织培养各个阶段的关键因素[20]。本研究采用正交设计试验优化红豆草组织培养最佳条件,试图建立一套高效的组培和植株再生体系。
提高红豆草愈伤组织诱导率是优化其再生体系的第一步。细胞分裂素和生长素是愈伤组织诱导及分化过程中最常用的两种激素。细胞分裂素可使植物细胞分裂并诱导芽的萌发和生长[21];生长素可促进植物细胞伸长和根系分化[22]。已有研究表明,NAA和6-BA是诱导红豆草愈伤组织应用最多的外源激素[10-13]。在红豆草愈伤组织诱导过程中3种激素对上胚轴、真叶和下胚轴等外植体的愈伤组织诱导影响大小顺序为:NAA > ZT > 6-BA,说明NAA是红豆草愈伤组织诱导阶段最重要的激素,这与李辉[23]以红豆草下胚轴为外植体研究结果一致。在本研究中,以下胚轴为外植体时低浓度NAA更利于愈伤组织的诱导,这说明不同外植体对NAA的敏感程度不同。6-BA不是愈伤组织诱导过程中的主要因素,对愈伤组织诱导作用较小,一般与其他生长素配合使用,可以提高愈伤组织的质量和诱导率[24]。
行业性质:绝大多数企业位于产业链利润最低的制造环节:超过90%的企业均为生产型企业;占据产业链高端环节的企业很少:总部、研发设计、采购及业务等比例较小,占比最大的采购环节亦仅五分之一左右。
愈伤组织只有转入到生长素含量很低或完全没有生长素的培养基上,才能发育为成熟的体细胞胚并形成植株,而细胞分裂素可以促进愈伤组织向再生植株的方向发展[25-27]。在本研究中,诱导红豆草愈伤组织再分化为不定芽时,适当浓度6-BA对红豆草不定芽分化有促进作用,这可能是由于6-BA能够改善植物细胞内源性生长素和细胞分裂素的比例,调节细胞生理生化状态,有利于愈伤组织的诱导,从而增加分化频率[28]。高浓度ZT使不定芽的诱导率明显提高,与张文学等[29]和刘君等[30]研究结果一致。本研究结果表明,随着NAA浓度增加,不定芽诱导率呈逐渐下降趋势,这与木台塔尔·阿布力克木和杨茁萌[11]对甘肃红豆草组织培养的研究结果一致。在本研究中,红豆草不定芽分化的最佳培养基是MS+0.5 mg·L-16-BA+2.5 mg·L-1ZT。该配方与云雅聪[31]研究蒙农红豆草不定芽诱导培养基配方有一定的差异,体现在NAA的用量上,不添加NAA对甘肃红豆草不定芽诱导有利,说明甘肃红豆草和蒙农红豆草在组织培养过程中对激素的适应能力有差别。
植物组织培养技术应用生产中,试管苗的生根质量是影响其移栽成活率的重要因子。在生根培养中合理添加植物生长激素可以促进根的形成,提高组培苗的生根率[32]。研究表明,IBA诱导形成的不定根细而长,NAA诱导形成的不定根短而粗[33-34]。因此本试验研究了NAA和IBA-K的配合使用对红豆草生根率的影响。结果表明只添加了IBA-K的培养基中虽然有根生成,但生根率低,仅有5%。只添加了NAA的培养基中没有根生成,这与杨茁萌等[10]研究‘顿河’红豆草的结果有一定差异;结论不一致的原因可能是红豆草品种不同,也可能是NAA设置的浓度不同。在本研究中,用1/2MS+0.5 mg·L-1NAA+0.2 mg·L-1IBA-K组合浓度培养的红豆草根系多且发达,与已报道的IBA和NAA能够诱导试管苗生根的结论一致[35-37]。
本研究为红豆草愈伤组织诱导和植株再生提供了一个高效方案,即红豆草愈伤组织诱导培养基以MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA+0.2 mg·L-1ZT为最优;不定芽分化的培养基以MS + 0.5 mg·L-16-BA+2.5 mg·L-1ZT为最优;不定芽转至1/2MS+0.5 mg·L-1NAA+0.2 mg·L-1IBA-K,生根效果最好,生根率为45%。

