一株1-萘酚生产菌的分离、鉴定及培养条件优化
邱程刚,李 康,陶 沙,钱 颖,张阿磊,陈可泉,2,欧阳平凯,2
(1. 南京工业大学 生物与制药工程学院,江苏 南京 211800;2. 国家生化工程技术研究中心,江苏 南京 211800)
1-萘酚是一种重要的平台化学品,可广泛用于染料、药物、杀虫剂、香水和表面活性剂等领域[1-2]。据统计,全球每年1-萘酚的需求量超过4万t[3]。目前,1-萘酚主要由化学氧化催化萘制得(如α-萘磺酸碱熔法、α-萘胺水解法、四氢萘法制萘等)[4],但化学法存在副产物多、反应条件要求苛刻和环境污染严重等问题。因此,开发高效绿色的1-萘酚生产方法尤为重要。生物法由于反应条件温和、专一性强、特异性强,受到越来越多的关注[2,5-9]。
目前,生物法制备1-萘酚主要是以萘为底物,酶法催化合成1-萘酚。例如,在添加外源辅酶NADPH的条件下,Liu等[10]克隆表达的P450酶催化转化萘制备1-萘酚,产量为1.83 mg/L。在添加外源辅酶H2O2的条件下,Martinez等[11]通过克隆表达非特异性单加氧酶(UPO),催化转化萘可制备48 mg/L的1-萘酚。Garikipati等[12]利用异源表达的甲苯邻位单加氧酶(TOM),以萘为底物制备1-萘酚,产量达14.4 mg/L;此外,他们还研究了TOM-Green工艺转化萘得到1-萘酚(86.4 mg/L),在此基础上利用全细胞两相催化,1-萘酚的产量可达1.43 g/L。
自然界中,微生物种类多样,具有生产各种产品的潜力。萘作为一种常规环境污染物,可被自然界中很多微生物氧化为1,2-二羟基萘、龙胆酸及水杨酸等小分子物质,进而被降解[13-16]。然而,直接转化萘合成1-萘酚的研究较少,Inoue等[7]研究发现,野生菌发酵生产1-萘酚,产量为21.23 mg/L。因此,挖掘将萘转化为1-萘酚的天然微生物资源在环境保护和经济方面均具有重要意义。
本研究中,笔者从南京某化工厂污水道中富集、驯化、分离并筛选出1株能转化萘生产1-萘酚的菌株,对其进行了形态学、16S rDNA分子序列和生理生化特性的鉴定,并通过培养条件优化提高萘生产1-萘酚的效率,以期为实现规模化生物法生产1-萘酚奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 药品与设备
蛋白胨、酵母粉、NaCl、NaH2PO4、K2HPO4、萘、FeSO4、N,N-二甲基甲酰胺(DMF)、甲基叔丁基醚(METB)及其他药品均为市售分析纯。
DHZ-LA型恒温振荡器,太仓市强乐实验设备有限公司;SW-CJ-2FD型超净工作台,苏净集团安泰公司;YXQ-LS-50S11型高压蒸汽灭菌锅,上海博迅实业有限公司;FA2004型电子分析天平,上海舜宇恒平科技仪器有限公司;PHS-3C型数字式精密pH计,上海精密科学仪器有限公司;B ̄2 ̄0 ̄4 ̄L ̄E ̄D ̄R型双目生物显微镜,上海比目仪器有限公司;TGL-16M型冷冻高速离心机,湘仪离心机仪器有限公司;752S型分光光度计,上海美普达仪器有限公司,1260型高效液相色谱仪,Agilent公司。
1.1.2 样品采集
从南京某化工厂的排水沟里分别采集到泥水混合物样品6份,编号后保存于4 ℃冰箱待用。
1.1.3 培养基配制
富集培养基(g/L):蛋白胨1.0、NaH2PO4·2H2O 0.7、Na2HPO4·12H2O 0.3、MgSO4·7H2O 0.5、FeSO4·7H2O 0.01。
驯化培养基(g/L):萘0.5、NaH2PO4·2H2O 0.7、Na2HPO4·12H2O 0.3、MgSO4·7H2O 0.5、FeSO4·7H2O 0.01。
分离培养基(g/L):萘0.1、蛋白胨1.0、酵母粉0.5、NaCl 0.5、纯化琼脂20。
1.2 实验方法
1.2.1 1-萘酚生产菌的富集培养
在无菌条件下,将采集到的5 mL样品(充分混匀的泥水混合物)分别加入100 mL富集培养基中,在30 ℃、200 r/min的条件下振荡培养4 d后按5%(体积分数)的接种量转接至新的培养基中,反复传代培养3次,以富集1-萘酚生产菌[17]。
1.2.2 1-萘酚生产菌的驯化培养
取5 mL富集样置于100 mL以萘为唯一碳源的驯化培养基中,在30 ℃、200 r/min的条件下培养4 d 进行驯化,取5 mL的驯化液接种至新鲜驯化培养基中,重复操作直至驯化液中检测到1-萘酚的存在。
1.2.3 1-萘酚生产菌的分离纯化
用无菌水将驯化液按10-1~10-8梯度稀释,取0.2 mL稀释液涂布于分离培养基平板上,30 ℃恒温培养箱培养24 h,在平板上选择不同形态特征的单菌落,重新转接至分离培养基上,直至分离为单菌落。将得到的单菌落接种至驯化培养基中培养4 d 后,检测1-萘酚的存在以验证其具有1-萘酚生产能力。将具有生产1-萘酚性能的菌种划线于固体斜面培养基上,于4 ℃冰箱中保存备用。
1.2.4 1-萘酚生产菌的形态学鉴定
1)菌落形态特征。将1-萘酚生产菌株接种至分离培养基,于30 ℃恒温培养24 h,进行菌落形态观察。
2)菌体细胞形态特征。对菌株进行革兰氏染色鉴定[18],使用100倍油镜观察菌株,若菌株呈紫色,则菌株QCG为革兰氏阳性细菌;若菌株呈红色,则菌株为革兰氏阴性细菌。
1.2.5 1-萘酚生产菌株的生理生化鉴定
参照《蜡样芽孢杆菌生化鉴定条使用说明书(HBIG07-1)》中的方法,用生理生化条(海博生物技术有限公司)进行过氧化氢酶、西蒙氏柠檬酸盐、动力、溶菌酶、硝酸盐、乙酰甲基甲醇(VP)试验、明胶、甘露醇、葡萄糖淀粉水解试验,观察反应结果并记录。
1.2.6 基于16S rDNA基因序列的同源性比对和系统发育分析
利用DNA提取试剂盒(擎科生物科技有限公司)提取分离降解菌的总DNA,具体操作参照文献[19]。
1)扩增引物选用16S rDNA的通用引物27F和1492R。引物序列为(27F-5′-A ̄G ̄T ̄T ̄G ̄A ̄T ̄C ̄M ̄T ̄G ̄G ̄C ̄T ̄C ̄A ̄G-3′,1492R-5′-G ̄G ̄T ̄T ̄A ̄C ̄C ̄T ̄T ̄G ̄T ̄T ̄A ̄C ̄G ̄A ̄C ̄T ̄T-3′-2)。PCR反应体系及循环条件PCR反应体系(25 μL):基因组DNA模板0.5 μL,10×扩增缓冲液(含Mg2+)2.5 μL,dNTP(各2.5 mmol/L)1 μL,Taq酶0.2 μL,上下游引物各0.5 μL。
2)16S rDNA的PCR扩增。PCR反应循环条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30个循环,最后72 ℃继续延伸5 min。PCR产物经琼脂糖凝胶电泳检测鉴定正确后,再用纯化试剂盒纯化收集,送擎科生物科技有限公司进行16S rDNA测序。
3)序列的系统发育分析与同源性比对。将所得分离降解菌的序列输入NCBI的BLAST数据库(http:∥www.ncbi.mlm.nih.gov/blast/Blast.cgi)进行同源序列的检索,从检索的结果中选择14个相似度最高的序列作为参考序列并以其他不同种属或种的菌株作为外群,使用MEGA7.0软件对所测序列和所选序列进行比对,同时剪去不整齐的碱基并在序列间插入适当空格,以达到最大同源性。最后使用该软件以邻接法(Neighbor-Joinning法)构建QCG菌株与其亲缘关系较近菌属的系统发育树。
1.2.7 全细胞催化体系及液相方法的建立
1)全细胞催化条件。选用30 mL玻璃离心管,反应体积为2 mL,包含0.1 mL的3 g/L的萘-DMF溶液、1.9 mL的OD600为40的菌液(磷酸钾缓冲液(PBS),pH 7.2)。全细胞催化条件:温度为30 ℃,转速为200 r/min,反应时间2 h[20]。
2)样品处理。反应结束后,在体系里添加4 mL甲基叔丁基醚(METB)萃取,剧烈涡旋5 min、超声处理20 min、再涡旋1 min,取2 mL上清液置于洁净的玻璃离心管中,减压蒸发溶剂至挥发完全后,再添加1 mL甲醇溶解,剧烈涡旋5 min、超声处理20 min、再涡旋1 min,过膜后使用高效液相色谱(HPLC)检测。
3)HPLC检测方法。1-萘酚采用安捷伦1260系统HPLC分析。色谱柱为Agilent 5 HC-C18 250 mm×4.6 mm柱,紫外检测器。具体条件:进样量为10 μL,波长为272 nm,流速为1 mL/min,柱温为25 ℃,流动相纯水和乙腈。采用梯度洗脱方法,梯度为0 min 50%乙腈、5 min 70%乙腈、10~16 min 90%乙腈。
1-萘酚产率计算公式为Y=X/0.166 6。其中,X为产物1-萘酚的质量浓度(g/L),Y为菌株QCG全细胞催化在2 h的产率(g/g)。
1.2.8 生物量的测定
取一定体积培养液,8 000 r/min离心10 min,用10 mmol/L PBS(pH 7.2)洗涤后用同样体积缓冲液重悬,将该菌悬液分别稀释至不同的浓度(OD600),以PBS作空白对照;将2 mL稀释的菌体离心后烘干至恒质量,精确称质量。以细胞干质量(CDW)为横坐标,OD600为纵坐标,制作标准曲线[21]。
生物量标准曲线为y=0.041x+0.002 6。其中,y为细胞干质量(g);x为细胞生物量(以OD600表示)
1.2.9 培养条件优化
单因素试验:考察接种量、培养时间、温度和装液量的优化,其他条件保持不变,每组设置3个平行样,最后分别取最优条件做全细胞催化。
1)接种量的优化。以0.1%、0.5%、1.0%、1.5%和2.0%的接种量将菌接种于LB培养基中,在pH 7.0、30 ℃、200 r/min、装液量为100 mL(500 mL摇瓶)的条件下培养24 h后离心收菌,用PBS(pH 7.0)洗涤后,加PBS稀释并控制OD600为40,进行全细胞转化。
2)培养时间的优化。以1.0%的接种量将菌接种于LB培养基中,在pH 7.0、30 ℃、200 r/min、装液量为100 mL 的条件下分别培养12、18、24和36 h后离心收菌,用PBS(pH 7.0)洗涤后,加PBS稀释并控制OD600为40,进行全细胞转化。
3)培养温度的优化。以1.0%的接种量将菌接种于LB培养基中,在pH 7.0、30 ℃、200 r/min、装液量为100 mL 的条件下,在不同的温度(22、26、30、34和37 ℃)下培养24 h后离心收菌,用PBS(pH 7.0)洗涤后,加PBS稀释并控制OD600为40,进行全细胞转化。
4)培养容器装液量的优化。以1%的接种量将菌接种于LB培养基中,在pH 7.0、200 r/min、装液量为100 mL条件下,在不同的温度(22、26、30、34和37 ℃)下培养24 h后离心收菌,用PBS(pH 7.0)洗涤后,加PBS稀释并控制OD600为40,进行全细胞转化。
2 结果与讨论
2.1 1-萘酚生产菌株的分离筛选及形态学鉴定
以萘为唯一碳源从南京某化工厂的排污水道水体中通过富集、驯化和分离筛选到了1株能转化萘为1-萘酚的菌株,并命名为QCG,对其在平板上进行培养,再进行染色鉴定,结果见图1。由图1可知,该菌在筛选培养基和30 ℃的条件下培养24 h后呈2~3 mm单菌落、不透明、呈乳白色,易挑取。光学显微镜观察该菌为革兰氏阳性菌,经生物显微镜测定该菌大小约为1.0 μm×4.0 μm,呈短杆状。

图1 菌株QCG的菌落形态及革兰氏染色鉴定Fig.1 Morphological observation and microscopic gram-examination results of strain QCG
2.2 菌株的生理生化特性
通过培养实验发现该菌严格好氧,适应生长温度为10~45 ℃,适宜生长pH为7~10。利用GenⅢ微孔板对该菌生理生化试验,结果见表1。由表1可见,该菌对动力培养基试验、H2O2试验、葡萄糖氧化发酵试验、明胶试验及淀粉水解试验呈阳性。

表1 生理生化鉴定试验
2.3 菌株QCG的分子生物学鉴定
对菌株QCG进行16S rRNA基因测序,并与GenBank中已知序列进行比对,菌株QCG的GenBank ID为MK305199。根据BLAST结果,选择有代表性的菌株,用软件Clustalx 8.0进行序列比对,使用软件MEGA 7.0利用临接法(Neighbor-Joinning)构建系统发育树,结果如图2所示。由图2可知:该菌属蜡样芽孢杆菌,命名为BacilluscereusQCG,该菌株与Bacilluscereus9_julio、BacilluscereusBS1的相似度达99%,是否为同一菌种尚需进一步鉴定。

图2 菌株QCG基于16S rDNA基因序列构建的系统发育树Fig.2 Phylogenetic tree based on partial 16S rDNA gene sequences of QCG and reference strains
2.4 产物1-萘酚的鉴定
为证明菌株QCG能生产1-萘酚,对发酵液采用高效液相色谱-质谱进行分析,结果见图3。由图3可知:1-萘酚标品的保留时间为4.6 min,而发酵转化液在4.6 min出现了同样的吸收峰,说明有目标产物1-萘酚的存在。为了更精确的鉴定,以产物出峰时间段(4.3~4.9 min)的流出液进行质谱分析。ESI+质谱结果显示,出现了荷质比(m/z)为145.065 1(1-萘酚+H)的质谱峰,由此可以确定1-萘酚的存在。
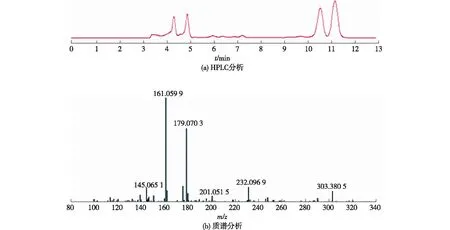
图3 高效液相-质谱联用分析发酵液Fig.3 HPLC-mass spectrometry analysis of fermentation samples
2.5 培养条件对全细胞催化活性的影响
2.5.1 接种量对产率的影响
接种量会影响菌株的1-萘酚产率,因此考察不同的接种量培养的菌株全细胞催化对1-萘酚产率的影响,结果见图4。由图4可知:接种量为1.5%时,1-萘酚产率最高;当接种量小于或大于1.5%时,1-萘酚的产率均呈下降趋势。

图4 接种量对产率的影响Fig.4 Effects of inoculation volume on 1-naphthol yield
2.5.2 培养时间对产率的影响
培养时间短,菌株的关键酶活不足,但培养时间过长,会产生一些次级代谢产物,从而影响菌株的活力[12]。因此,考察不同培养时间对菌株全细胞催化对1-萘酚产率的影响,结果见图5。由图5可知:随着培养时间的延长,1-萘酚产率逐渐增大,在18 h达到峰值;随着时间的进一步延长,1-萘酚的产率出现下降趋势。因此,选取培养18 h作为菌株QCG的最佳培养时间。

图5 培养时间对产率的影响Fig.5 Effects of culture time on 1-naphthol yield
2.5.3 培养温度对产率的影响
温度对微生物的影响是通过影响微生物的代谢系统间接影响菌株活力[12],是微生物催化过程中的一个限制因素。因此考察培养温度对1-萘酚产率的影响,结果见图6。由图6可知:菌株QCG的最佳培养温度是26 ℃,高于或低于26 ℃培养,1-萘酚的产率都降低。这与Inoue等[7]研究的1-萘酚生产菌的发酵最优温度相似。
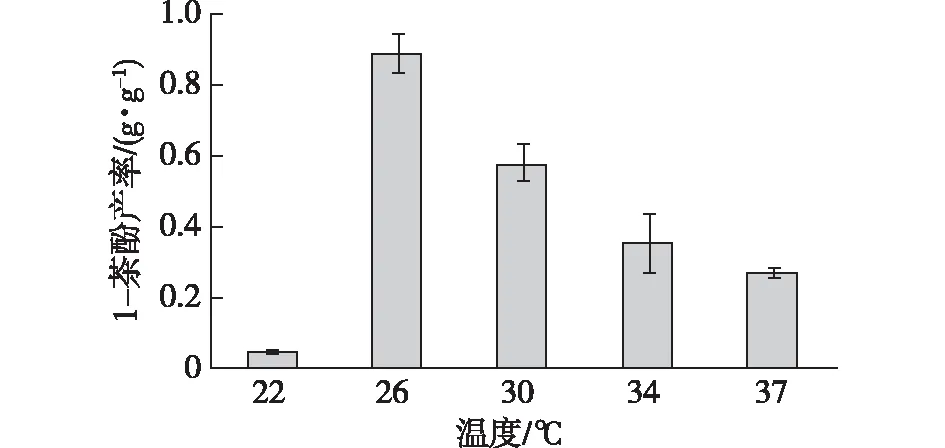
图6 温度对产率的影响Fig.6 Effects of temperature on 1-naphthol yield
2.5.4 培养时的装液量对产率的影响
装液量会影响培养基的溶氧,进而影响菌株的产酶能力。选择5个不同的装液量,研究其对菌株全细胞催化对1-萘酚产率的影响,结果见图7。由图7可知:在500 mL的三角瓶中,当装液量小于80 mL时,1-萘酚的产率随着装液量的增加而提高;当装液量大于80 mL时,产率随着装液量的增加而降低,因此确定最佳的装液量为80 mL(500 mL摇瓶)。这与李文利等[22]研究的结果相似。
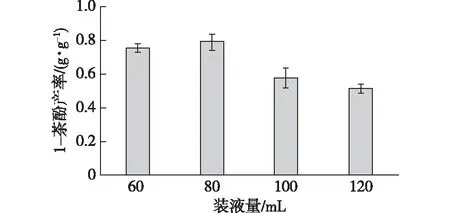
图7 装液量对产率的影响Fig.7 Effects of liquid volume on 1-naphthol yield
最终,初步确定菌株QCG转化萘为1-萘酚的较优条件:接种量为1.5%、培养时间为18 h、培养温度为30 ℃、装瓶量为80 mL(500 mL摇瓶)。 此时,产物1-萘酚质量浓度可达22.23 mg/L,产率为(0.97±0.06) g/g 。
3 结论
通过富集、驯化和分离筛选,从化工厂废水中获得1株可转化萘为1-萘酚的菌株,经形态学观察和分子生物学检测,鉴定为蜡样芽孢杆菌,命名为BacilluscereusQCG。通过高效液相色谱-质谱联用确定了1-萘酚的生成。最终,通过单因素试验优化,菌株QCG转化萘生成1-萘酚的产量可达22.23 mg/L,为生物法转化萘为1-萘酚提供了可能。

