吸附树脂分离蛹虫草发酵液中虫草素
周精卫,王松涛,沈才洪,赵谷林,顾炜炜,刘庆国,吴菁岚,陈 勇,
(1.南京工业大学 国家生化工程技术研究中心,江苏 南京 211800; 2.泸州老窖股份有限公司,四川 泸州 616000;3.国家固态酿造工程技术研究中心,四川 泸州 646000;4.江苏省产业技术研究院,江苏 南京 210032)
虫草素,又称虫草菌素、蛹虫草菌素,是蛹虫草中(尤其是核苷类)主要活性成分,属核苷类新药——嘌呤类生物碱,也是第一个从真菌中分离出来的核苷酸抗生素[1-3],其具有抗肿瘤、抗菌抗病毒、免疫调节、清除自由基等多种药理作用,有良好的临床应用前景[4-7]。目前虫草素的研究成为药物化学中一个极其活跃的领域,但是虫草素在野生冬虫夏草中的含量极微,现在研究所用的虫草素基本都是从蛹虫草中提取的[8-9]。
人工培育蛹虫草的方法主要有:野生蛹虫草菌种的固态、液态深层发酵培养,获得蛹虫草的菌丝体和发酵产物;人工饲养虫草蝙蝠蛾幼虫,再接种蛹虫草菌,在适宜培养条件下培养得到蛹虫草子实体。采用液态培养方式生成的虫草素大部分都分泌到发酵液中,便于后续的分离提取。但发酵液中虫草素的浓度较低,从中分离提取的难度大,因此需要开发一种适用于虫草素工业化生产的分离方法。目前在虫草素生产上应用较多的方法是离子交换树脂吸附法,此法存在树脂的再生过程中酸、碱的用量多以及废水的排放量大等缺点[10-11]。因此,有学者采用吸附树脂从蛹虫草发酵液中提取虫草素[12-15],但依然存在树脂对虫草素的吸附容量低、吸附选择性差等缺点,导致分离得到的洗脱液中虫草素纯度低,需要进一步纯化[16]。
鉴于采用吸附树脂具有易解吸、能重复使用、生产成本低等优点,本文中,笔者采用吸附树脂来分离蛹虫草发酵液中的虫草素,首先筛选一种吸附/解吸性能较好的吸附树脂,研究pH对吸附容量的影响,测定虫草素在树脂上的吸附等温线,并采用动态柱吸附-脱附的方法分离发酵液中的虫草素,系统地考察色谱柱的高径比(H/D)、流速及温度等条件对虫草素在树脂上的吸附的影响。
1 材料与方法
1.1 实验原料
蛹虫草发酵液,由南京高新工大生物技术研究院提供,采用蛹虫草CICC14014进行发酵,最终发酵液中虫草素的质量浓度为3~4 g/L。
发酵液的预处理:先通过离心去除发酵液中的菌体(4 000 r/min,15 min),得到的上清液继续进行超滤(PT1812型有机卷式膜,美国GE公司),进一步去除发酵液中的蛋白质、色素等杂质。
吸附树脂的预处理:吸附树脂XAD-16、XAD-1600、KA-I、HD-01和HD-06由南京工业大学国家生化中心提供。树脂在使用之前,先用6倍体积的无水乙醇浸泡,在浸泡过程中需要不断搅拌,时间要超过4 h以便将树脂中的杂质洗出,再用乙醇洗涤2~3遍后,用纯水将树脂中的乙醇冲洗干净,备用。
1.2 检测方法
采用安捷伦高效液相色谱法(安捷伦1260型,紫外检测器),色谱柱为C18柱(安捷伦,SB-AQ),流动相为1.36 g/L的KH2PO4溶液和甲醇缓冲液(两者体积比为75∶25),流速为1 mL/min,分析时间为25 min,紫外检测器,检测波长为260 nm。
1.3 静态吸附/解吸
将预处理好的树脂进行抽滤,取2 g抽滤好的湿树脂,加入100 mL的锥形瓶中,然后精确加入50 mL虫草素溶液,并用封口膜将锥形瓶密封好之后,放入摇床,在设定的温度下,以120 r/min的速度振荡8 h,使溶液和树脂充分接触,然后对上清液取样,测定其中虫草素的浓度。树脂的静态吸附容量的计算见式(1)。
(1)
式中:Qe为树脂达到吸附平衡时的吸附容量,m为加入的树脂质量,ρ0为初始溶液中溶质的浓度,ρe为达到吸附平衡时溶液中溶质的浓度,V0为初始溶液的体积。在吸附前后,溶液的体积基本上不发生变化。
静态解吸:取2 g对虫草素吸附饱和的湿树脂(用滤纸抽滤后)放入100 mL的锥形瓶中,然后精确加入20 mL的解吸剂,再放入摇床中,在设定的温度下,以120 r/min的速度振荡8 h,使溶液和树脂充分接触,然后对上清液取样,测定其中虫草素的浓度。树脂的静态解吸率的计算见式(2)。
(2)
式中:R为树脂的静态解吸率,ρR为达到解吸平衡时溶液中溶质的浓度,VR为加入的解吸剂的体积。在解吸前后,溶液的体积基本上不发生变化。
1.4 动态吸附-脱附过程
采用带夹套的玻璃层析柱,通过水浴对其进行控温,柱子的尺寸:内径为1.6 cm、高度为40 cm。采用湿法装柱,将吸附树脂装入色谱柱中,并用纯水将床层冲洗均匀。采用Kleinübing等[17]的方法测定床层的空隙率ε(约为0.33),将虫草素提取液恒速流过层析柱,检测流出液中虫草素浓度,绘制动态吸附曲线。通过考察进样流速、高径比及温度等因素对虫草素在树脂上的吸附效果,选择合适的上样条件。树脂动态吸附容量的计算见式(3)。
(3)
式中:Qd为动态吸附容量(mg/g);ρf和ρi(t)分别代表进口和出口溶液中溶质的质量浓度,g/L;Vf是进料的体积;Vb是床层的体积;Vi(t)是分部收集中每根试管中溶液的体积。
2 结果与讨论
2.1 虫草素在树脂上的静态吸附及脱附
2.1.1 树脂的筛选
挑选了5种不同结构的树脂,考察树脂结构对发酵液中虫草素吸附容量的影响,其中XAD-16、XAD-1600为大孔吸附树脂,KA-I为中孔微孔树脂,HD-01、HD-06是超高交联度树脂,树脂的理化性质见表1。
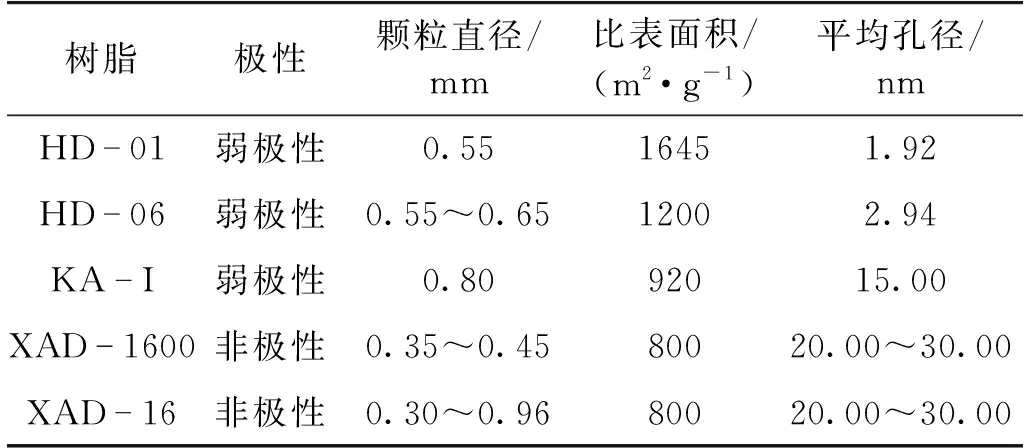
表1 5种不同结构树脂理化性质
在25和40 ℃条件下,考察树脂对发酵液中虫草素的静态吸附容量的影响,结果如图1所示。由图1可知:在这两个温度条件下,虫草素在各树脂上的吸附容量趋势一致,其中,HD-01和HD-06树脂对虫草素的吸附容量最高(20.2 mg/g),远高于原晋波等[10]得到的1.3 mg/g的结果;其次是KA-I树脂,而XAD-16和XAD-1600对虫草素的吸附容量较低。这可能是由于超高交联度的树脂具有独特的微孔结构,比表面积大,因此对虫草素的吸附容量也大。由图1还可知,除了HD-01树脂之外,虫草素在树脂上的吸附容量随温度升高而降低,因此较高的温度,有利于虫草素的解吸。
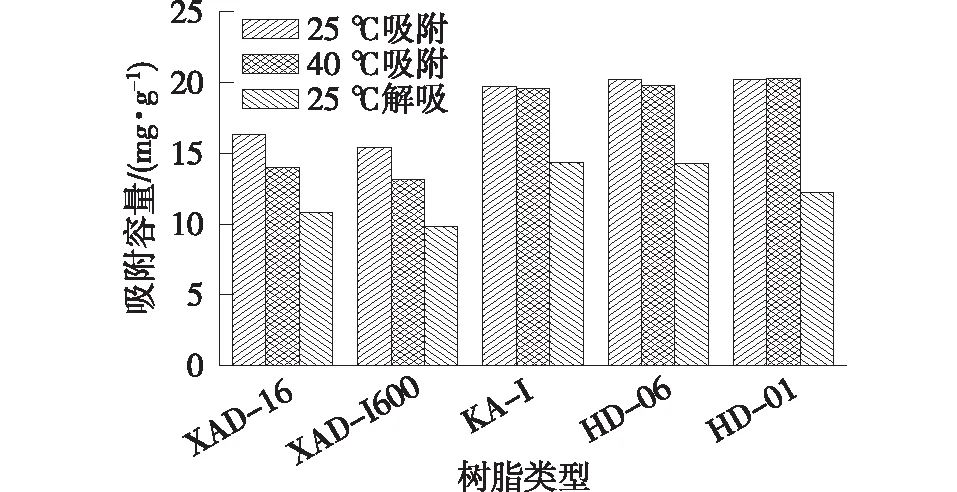
图1 虫草素在5种树脂上吸附-脱附性能对比Fig.1 Adsorption and desorption performance for cordycepin on five resins
除了吸附容量外,虫草素在树脂上的解吸难易程度也是需要重点考虑的。为了保证大部分的虫草素被解吸下来,同时能对比出不同树脂之间的脱附性能,采用50%的乙醇作为脱附剂,KA-I的解吸率达到了72.6%,其次是HD-06,达到了70.8%。虽然这两种树脂的解吸性能相近,但在吸附实际发酵液中虫草素时,HD-06对色素的吸附能力较强,因此在后续的洗脱过程中,被吸附在树脂上的色素也会进入虫草素洗脱液,导致其颜色较深,影响最后产品的色泽。综合考虑树脂对虫草素的吸附容量、解吸难易程度以及对色素的吸附选择性,选择KA-I树脂作为分离发酵液中虫草素的吸附剂。
2.1.2 乙醇浓度对解吸率的影响
由于虫草素在树脂上的吸附亲和力较强,用水难以解吸,因此考虑采用不同浓度乙醇作为解吸剂。在室温(25 ℃)条件下,考察浓度乙醇对虫草素的解吸率的影响,结果见图2。由图2可知:随着乙醇用量的增加,其对树脂上吸附的虫草素解吸能力增强,但当乙醇的体积分数超过70%后,解吸率反而下降。这可能是由于在室温下虫草素在乙醇中的溶解度较低,当水溶液中乙醇浓度超过一定值之后,对虫草素的解吸能力反而下降。另外,采用体积分数50%的乙醇的解吸率为79.9%,仅比体积分数70%的乙醇(解吸率为81.5%)低一点。因此考虑到洗脱过程中乙醇的用量及回收利用,最终采用体积分数50%的乙醇为解吸剂。

图2 乙醇用量对虫草素在KA-I树脂上脱附性能的影响Fig.2 Effects of ethanol concentration on desorption performance of cordycepin on KA-I resin
2.1.3 pH对虫草素吸附容量的影响
在虫草素分子中有一个含氮的碱基(腺嘌呤),所以虫草素在不同pH条件下;解离状态是不一样的。因此,考察不同pH条件下,虫草素在KA-I树脂上的吸附容量,结果见图3。由图3可知:随着溶液pH的升高,虫草素在树脂上的吸附容量逐渐增大;当溶液的pH>4.0后,其吸附容量达到一个稳定值(约为21.5 mg/g)。这与Zhang等[18]发现在pH为8.0时,虫草素在NKA-II树脂上的吸附容量达到最大的结果不一致。本研究的结果与文献[18]报道的结果略有不同,可能是与选择的吸附树脂类型有关,因为在水溶液中虫草素在KA-I树脂上的吸附主要依赖范德华力作用,当其溶解度降低后,疏水性增强,更有利于其在树脂上的吸附。因此,选择在pH>4.0的条件下,对虫草素吸附的效果较好。虫草素发酵液的原始pH为5.0,因此,后续试验不调节pH。
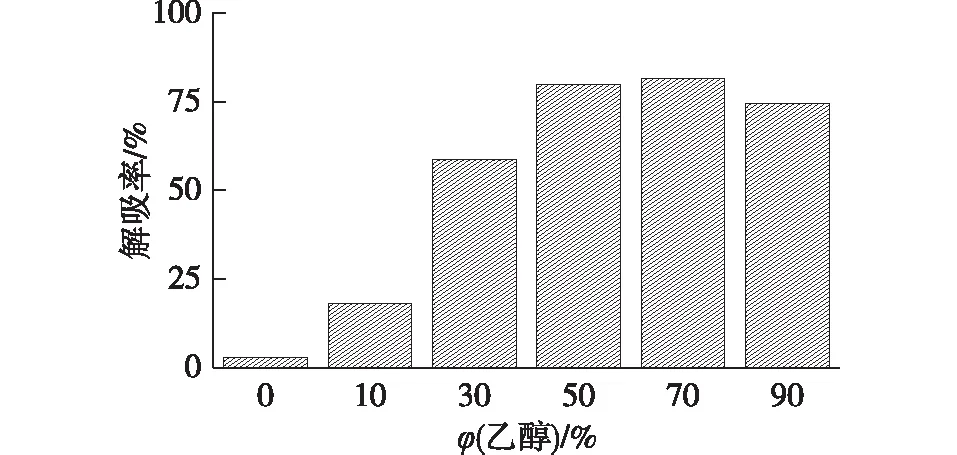
图3 pH对虫草素在KA-I树脂上吸附吸附容量的影响Fig.3 Effects of pH on the adsorption capacity of cordycepin on KA-I resin
2.1.4 虫草素在吸附树脂上的吸附等温线
在pH>4.0时,虫草素在树脂上的吸附容量较大,因此选择pH=5.0时,考察在不同温度(25、40和60 ℃)条件下,虫草素在KA-I上的吸附过程,结果如图4所示。由图4可知:虫草素在树脂上的吸附容量随着温度的升高而逐渐下降。这说明虫草素在KA-I上的吸附是一个放热的过程,低温有利于吸附,高温有利于解吸。分别采用Langmuir和Freundlich模型对3个温度下的等温线数据进行拟合,拟合的结果列于表2中。由表2可知:这两种模型都可以较好地拟合实验数据,其中Freundlich模型拟合的程度更高,回归系数R2达到95%以上。
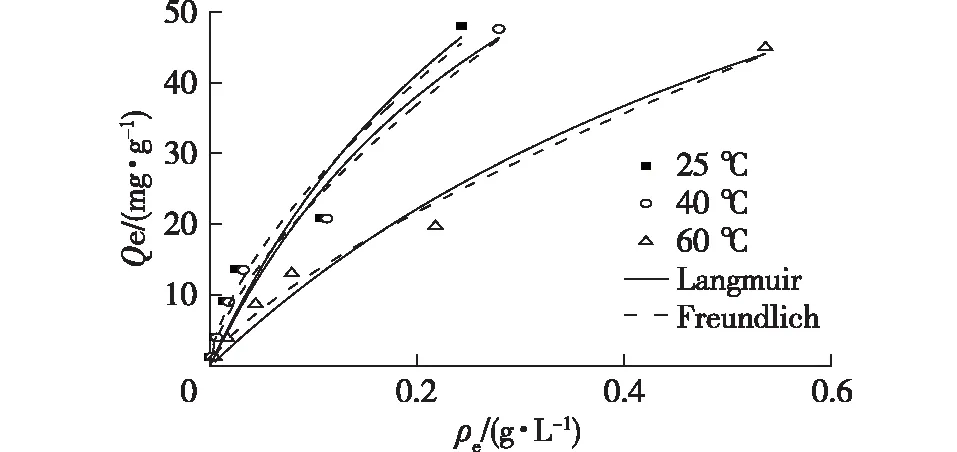
图4 虫草素在树脂KA-I上的吸附等温线Fig.4 Adsorption isotherms of cordycepin on KA-I resin
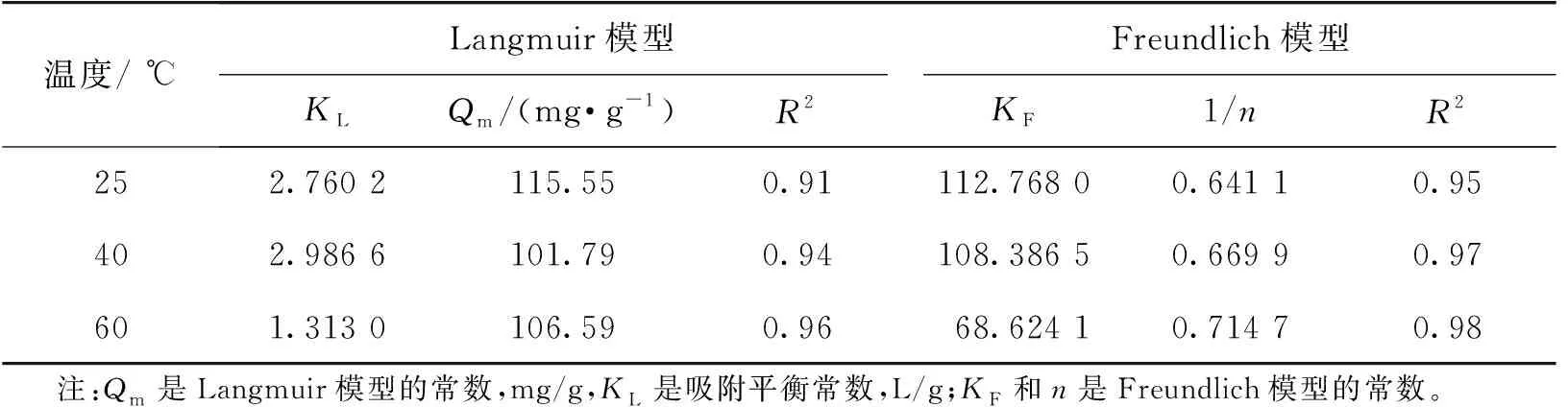
表2 虫草素在KA-I树脂上的吸附模型拟合
2.2 虫草素在色谱柱上的动态吸附-脱附研究
采用动态柱吸附的方法分离发酵液中的虫草素,由于高径比(H/D)、温度及流速等条件对虫草素的吸附影响较大,因此分别测定不同条件下,虫草素在装载KA-I树脂的层析柱上的穿透曲线。
2.2.1 不同流速下虫草素在KA-I树脂上的穿透曲线
分别测定不同流速(0.5、1.0和1.5 mL/min)条件下,虫草素在层析柱上的穿透曲线,结果如图5所示。由图5可知:在高径比、温度和进样浓度一定的情况下,随着流速的增加,虫草素的穿透时间提前。溶液中虫草素的穿透曲线较为缓和,从开始穿透(ρi(t)/ρ0>0.05)到完全达到吸附饱和(ρi(t)/ρ0接近1)所需的时间较长。这是由于进样质量浓度较低(2.06 g/L),溶液中虫草素浓度与树脂之间的浓度差较小,传质的推动力小,所以虫草素在KA-I树脂达到吸附平衡所需的时间较长。由图5还可以看出,随着流速的增大,虫草素来不及在树脂上达到吸附平衡,就开始流出,因此穿透时间提前。在较低的流速下,有利于虫草素在KA-I树脂上的吸附,可减少层析柱的传质区长度,但在较低的流速下,分离所需的时间也相应较长。因此要综合考虑传质速率和生产效率,选择1.0 mL/min的流速较为合适。
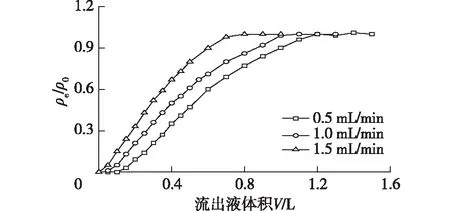
H/D=10∶1,进样质量浓度2.06 g/L图5 不同流速下虫草素在KA-I树脂柱上的穿透曲线Fig.5 Breakthrough curves of cordycepin on column with KA-I resin at various flow rate
2.2.2 不同高径比下虫草素在KA-I树脂上的穿透曲线
如果增大层析柱的高径比,则理论塔板数增大,在多组分体系中,各物质之间的分离度也相应增大;但随着高径比的增大,分离时间延长,柱压也相应增加,相应的能耗增大,生产效率则下降。因此考察在不同高径比(10∶1、15∶1和25∶1)条件下,虫草素在KA-I柱中的穿透曲线,结果见图6。由图6可知:随着高径比的增大,虫草素的穿透时间延后,达到吸附平衡的时间更长,所需的进样体积也更大。在不同高径比条件下,虫草素在KA-I树脂上的吸附容量接近(约为29.2 mg/g),这可能是因为在虫草素发酵液中除了虫草素之外,还存在腺苷、虫草酸等物质,特别是腺苷的结构与虫草素非常相似,因此影响虫草素的分离。为了实现这些组分之间的高效分离,因此可以考虑在较大的高径比条件下进行操作。
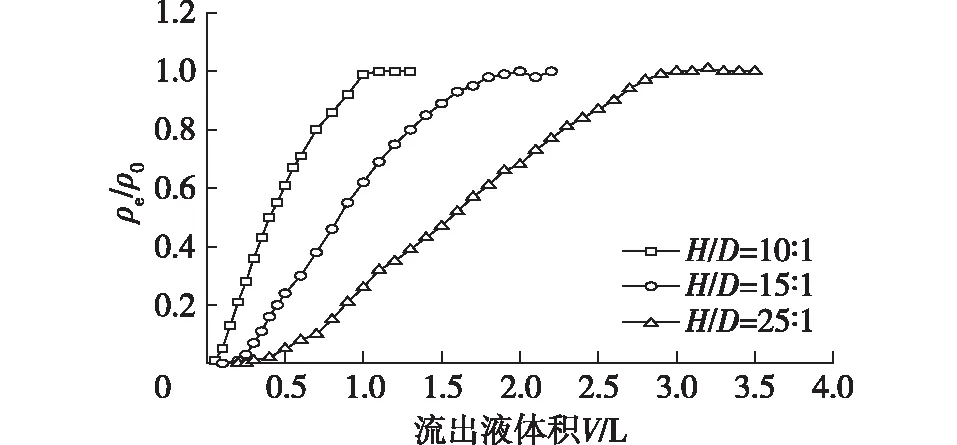
进样质量浓度1.96 g/L,流速1.0 mL/min图6 不同高径下虫草素在KA-I树脂柱上的穿透曲线Fig.6 Breakthrough curves of cordycepin on column with KA-I resin at different H/D
2.2.3 不同温度下虫草素在KA-I树脂上的穿透曲线
考察在不同温度条件下,虫草素在KA-I树脂柱中的穿透曲线,结果见图7。由图7可知:随着温度的升高,穿透曲线提前,这与所测定的虫草素在KA-I树脂上的吸附等温线结果一致。由此可见,高温更有利于虫草素在KA-I树脂上的脱附;随着温度的升高,虫草素的穿透曲线更为陡峭,这跟预期的结果一致。这是因为虫草素分子在水溶液中的布朗运动随着温度的升高而加剧,分子扩散系数增大,使其在树脂上的传质速率增大,能更快地达到吸附平衡。
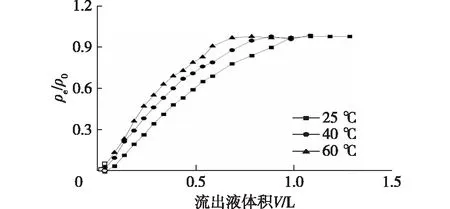
H/D=10∶1,进样质量浓度2.06 g/L,流速1.0 mL/min图7 不同温度下虫草素在KA-I树脂柱中的穿透曲线Fig.7 Breakthrough curves of cordycepin on column with KA-I resin at different temperatures
2.2.4 虫草素在KA-I树脂上的动态吸附-解吸曲线
图8是在高径比为25∶1、流速为1.5 mL/min、进样质量浓度为1.65 g/L、进样溶液pH为5.0的条件下,虫草素在KA-I树脂柱上的吸附-脱附曲线。由图8可知:KA-I树脂对虫草素的动态吸附容量为29.2 mg/g,采用体积分数50%乙醇为洗脱剂,可以很快将被树脂吸附的虫草素洗脱下来,洗脱液中虫草素的最高质量浓度达到了12.73 g/L。但由于后期,虫草素洗脱曲线有一点拖尾,从而降低了洗脱液中虫草素的平均浓度。最终,经计算洗脱液的平均质量浓度为1.22 g/L,收率达到了97%。
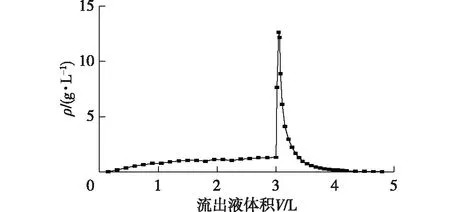
H/D=25∶1,流速1.5 mL/min,进样质量浓度1.65 g/L图8 虫草素在KA-I树脂柱中的动态吸附-脱附曲线Fig.8 Dynamic adsorption-desorption curves of cordycepin on column with KA-I resin from fermentation broth
2.3 虫草素的结晶
从KA-I树脂上洗脱得到的洗脱液中虫草素的浓度较低,需要进一步浓缩。由于溶液的体积较小,直接采用真空旋转浓缩的方法,待浓缩液中快出现沉淀时停止浓缩,此时浓缩液中虫草素质量浓度约为60 g/L,然后放冰箱(4 ℃)静置过夜,进行冷却结晶。冷却析出的固体进行抽滤、烘干,即得到虫草素粗品。经过高效液相色谱(HPLC)检测,粗品中虫草素的含量约为85%,比文献报道的35%[12]以及32.5%[18]都要高。
3 结论
采用吸附树脂从发酵液中分离虫草素,考察了树脂的结构、溶液的pH、温度、流速及高径比等对虫草素吸附性能的影响,并摸索得到合适的解吸条件,最后通过动态柱吸附、脱附的方式,分离得到了虫草素粗品。①KA-I树脂对虫草素具有较高的吸附容量,达到了21.5 mg/g,采用体积分数50%的乙醇作为解吸剂,静态解吸率可达到79.9%。②虫草素的吸附容量随温度的升高而降低,吸附平衡数据符合Freundlich模型,回归系数R2达到95%以上。③虫草素的动态柱吸附容量可达29.2 mg/g,洗脱液中虫草素的质量浓度可达1.22 g/L,收率达到97%,粗品中虫草素的含量约为85%。由此可见,该方法操作简单,得到的虫草素含量高,具有一定的工业化应用前景。

