基于GEO数据库预测分析卵巢癌顺铂耐药相关基因及意义
严 静 黄益玲 黄利鸣
(1. 三峡大学 医学院 肿瘤微环境与免疫治疗湖北省重点实验室, 湖北 宜昌 443002; 2. 三峡大学 医学院 病理学系, 湖北 宜昌 443002)
卵巢癌是女性常见恶性肿瘤,通常发生在围绝经期,其中上皮性肿瘤最为常见,约占90%以上,近年来有年轻化趋势。因缺乏筛查和早期诊断的方法,多数患者发现患病时已处于疾病晚期,且半数在治疗后16个月内复发,或发生化疗耐药,5年总体生存率在50%以下[1]。肿瘤细胞减灭术联合以铂类药物为基础的化疗方案仍是卵巢癌首选治疗模式,临床上将患者对铂类化疗药物敏感程度分为铂类敏感型、铂类耐药型。铂类敏感型指对初期以铂类药物为基础的治疗有明确反应,且已经达到临床缓解,停用化疗后12个月以上出现进展或复发。铂类耐药型指对初期的化疗有反应,但在完成化疗后6个月内病情进展或复发[2]。卵巢癌的顽固耐药使得传统治疗方法疗效十分有限,对肿瘤进展的分子机制也缺乏了解,因此需要更多关于卵巢癌的基础研究。
铂类抗癌药物主要指顺铂、卡铂、奥沙利铂,是目前临床应用中对多种肿瘤具有较高活性的抗肿瘤药物。顺铂(cisplatin)自从上世纪70年代被发现可以抑制肿瘤细胞生长后,就广泛应用于肿瘤化学治疗,具有抗肿瘤谱广、作用强、与多种抗肿瘤药有协同作用等特点[3]。顺铂通过被动扩散或者通过转运子(copper transport protein 1,CTR1)运输进入细胞质,再进入细胞核作用于DNA分子[4]。顺铂耐药可能通过降低细胞对药物的摄取、药物的失活、通过细胞硫醇进行药物解毒、改变药物靶标和修复受损DNA等途径产生[5]。
生物信息学是基于计算机模拟方法对比筛选基因芯片数据,进行基因挖掘和功能预测[6]。基因芯片提供了庞大的生物基因信息数据,包括mRNA数据、DNA甲基化数据、非编码RNA数据等,可以高效获取肿瘤分子标志物,为后续体内和体外实验验证分子标志物提供可靠依据[7,8]。本研究拟通过GEO(Gene Expression Omnibus)数据库获取卵巢癌顺铂耐药细胞系和顺铂敏感细胞系之间的差异基因(differentially expressed genes, DEGs),寻找可靠的肿瘤分子标记物,为卵巢癌顺铂耐药患者的诊断和治疗提供可靠基因靶点。
1 材料与方法
1.1 数据集获取
通过关键词“ovarian cancer”和“drug resistance”检索GEO(http://www.ncbi.nlm.nih.gov/geo)数据库,筛选以物种“人类”为研究对象且同时具有卵巢癌顺铂耐药组和顺铂敏感对照组细胞系,获得3个数据集:GSE58470,GSE15372,GSE33482,使用GEO筛选DEGs。GSE58470数据集基于GPL6947平台[Illumina HumanHT-12 V3.0],IGROV-1细胞系,包含6组顺铂耐药组,3组顺铂敏感组。GSE15372数据集基于GPL570平台[HG-U133_Plus_2] Affymetrix Human Genome U133 Plus 2.0 Array,A2780上皮性卵巢癌细胞系,包含5组顺铂耐药组,5组顺铂敏感组。GSE33482数据集基于GPL6480平台[Agilent-014850 Whole Human Genome Microarray 4x44K G4112F],A2780上皮性卵巢癌细胞系,包含6组顺铂耐药组,6组顺铂敏感组。各数据集中显著DEGs,筛选标准设置为:①P<0.05;②Log2|FC|(fold change)>1(即差异倍数>2倍)。为降低结果的假阳率,Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.htm)在线软件对上述3个数据集的显著DEGs做韦恩图取交集。
1.2 显著差异基因GO功能富集分析和KEGG信号通路分析
利用DAVID(http://david. ncifcrf.gov)在线分析工具,对显著DEGs进行GO功能富集分析,以了解其分子功能(molecular function,MF)、参与的生物学过程和途径(biological process,BP)及细胞组分和定位(cellular component,CC),并进行KEGG信号通路富集分析,以P<0.05作为纳入标准。
1.3 构建卵巢癌顺铂耐药显著DEGs的PPI网络图,并筛选Hub基因
将获得的显著DEGs导入STRING数据库(https://string-db.org/),蛋白质间存在高度相互关系筛选标准设为:P<0.05,使用Cytoscape构建PPI网络图。将STRING所得的蛋白质互作网络信息数据导入Cytoscape中,利用MCODE插件(molecular complex detection,分子复杂性检测)筛选显著DEGs中关键蛋白模块,寻找Hub基因,筛选条件为:MCODE score>5,degree cut-off=2,node score cut-off=0.2,Max depth=100,k score=2。
1.4 Hub基因生存率分析
使用UALCAN[9]分析Hub基因与卵巢癌生存相关性,“Survival”的分析结果以P<0.05作为纳入标准。
2 结果
2.1 筛选获得67个卵巢癌顺铂耐药显著DEGs
GSE58470数据集筛选显著DEGs 701个,其中上调450个,下调251个;GSE15372数据集筛选显著DEGs 3336个,其中上调822个,下调2514个;GSE33482数据集筛选显著DEGs 3359个,其中上调2034个,下调1325个。分别绘制3个数据集GSE58470、GSE15372、GSE33482基因表达的火山图(图1A、1B、1C),红色为上调基因、绿色为下调基因。将3个数据集显著差异基因取交集制作韦恩图(图1D),得到67个共表达的显著差异基因。
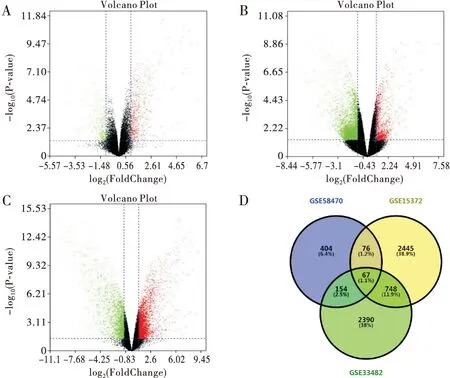
注:A、B、C:分别为GSE58470、GSE15372、GSE33482数据集的火山图; D:差异共表达基因的韦恩图图1 卵巢癌顺铂耐药显著DEGs分析
2.2 显著DEGs涉及的主要分子功能、生物学过程、细胞组分及信号通路
使用DAVID在线网站分析筛选所得67个显著DEGs,GO分析结果表明显著DEGs主要参与分子功能包括结构分子活性;生物学功能包括消化道发育、指甲发育、细胞对高氧反应、细胞基质粘附、整合素介导的信号通路、中胚层细胞分化、伤口愈合、成骨细胞分化、肽基络氨酸磷酸化调控;细胞中组分包括细胞外泌体(图2)。KEGG通路分析表明,显著DEGs主要在局灶性黏连、调节肌动蛋白、心律失常性右室心肌病、细胞外基质受体相互作用等方面富集(表1)。

表1 卵巢癌顺铂耐药差异基因KEGG通路富集分析

图2 卵巢癌顺铂耐药差异基因GO富集分析
2.3 显著DEGs构建蛋白质相互作用网络并分析获得10个Hub基因
使用STRING数据库分析筛选所得67个显著DEGs,获得存在相互作用关系的PPI网络图(图3A),并获得紧密连接度最高的基因模块(图3B)。Cytoscape软件筛选PPI网络信息后获得10个Hub基因:整合素β2(integrin subunit beta 2,ITGB2)、人源黏着斑蛋白(vinculin,VCL)、整合素α2(integrin subunit alpha2,ITGA2)、整合素β4(integrin subunit beta 4,ITGB4)、鸟苷酸结合蛋白1(guanylate binding protein 1,GBP1)、Ⅵ型胶原α1(collagen type VI alpha 1 chain,COL6A1)、金属硫蛋白2A(metallothionein 2A,MT2A)、月桂酰2-磺基转移酶(uronyl 2-sulfotransferase,UST)、胞外基质蛋白多糖(versican,VCAN)、硫酸皮肤素差向异构酶(dermatan sulfate epimerase like,DSEL)。
2.4 Hub基因与患者总生存率相关性
UALCAN在线网站分析各Hub基因与卵巢癌生存期相关性,结果发现VCAN与卵巢癌生存期显著相关(P<0.05,见图4)。
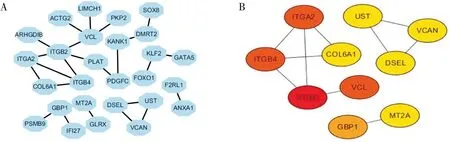
注:A:67个显著DEGs相互作用关系的PPI网络图;B:紧密连接度最高的基因模块图3 蛋白质互作网络图及紧密连接度最高的基因模块
3 讨论
卵巢癌可根据形态学分为不同类别,包括浆液性癌、粘液性癌、子宫内膜样癌、透明细胞癌、混合性和未分化型移行细胞癌。这些亚型在病因、细胞形态、分子生物学和预后方面各不相同,却被视为一个整体。这种肿瘤自身异质性,使免疫治疗、小分子靶向药物产生较大个体差异。PARP抑制剂(poly ADP ribose polymerase,多腺苷二磷酸核糖聚合酶) 为卵巢癌的治疗带来了重大变革,在初始治疗或铂敏感复发治疗获得完全缓解和部分缓解后应用PARP抑制剂可显著延长卵巢癌患者的无进展生存期[10]。但铂耐药复发患者难以治愈,治疗方案只能选择姑息治疗的同时维持生活质量。铂类药物经典的耐药机制包括三方面:①药物摄取减少,药物泵出增加,两者都会导致细胞内药物浓度减少;②谷胱甘肽(glutathione,GSH)和其他抗氧化物质对铂类抗癌药物的解毒作用,GSH是细胞内一种分子量小且大量存在的具有抗氧化和解毒作用的三肽,谷胱甘肽可以和铂(platinum,Pt)形成Pt-GSH,阻碍Pt与DNA的结合,使得细胞内解毒作用增强,细胞出现耐药;③增强DNA修复或者增加耐受[11]。
VCAN是一种聚合硫酸软骨素蛋白多糖,该基因位于染色体5q14.2-q14.3处,编码蛋白是组成细胞外基质的主要部分,属于聚集蛋白聚糖/versican蛋白聚糖家族的成员,在上皮间质转化过程中扮演着重要的角色,也参与细胞粘附、增殖和血管生成,并在组织形态发生和维持中起关键作用[12]。VCAN基因在肿瘤组织中高表达,抑制其表达可发挥抗肿瘤作用,主要机制可能与参与调节内源性Toll样信号通路、p53下游信号通路和β-catenin信号通路有关。Zhang等[13]研究发现,VCAN表达水平与乳腺癌恶性程度呈正相关,并促进上皮间质转化。Li等[14]研究发现,VCAN高表达是胃癌预后不良的独立预测因子。Mitsui等[15]研究发现,在Caki-2和786-O肿瘤细胞系中,敲减VCAN基因表达可抑制细胞增殖并促进细胞凋亡,参与调节肿瘤坏死因子(tumor necrosis factor,TNF)-α,BID和BAK等TNF相关基因信号通路;还可抑制细胞迁移和侵袭能力,参与下调基质溶解素(matrix metalloproteinase,MMP)7和CXCR4表达。Zhao等[16]发现,MiR-135a-5p可通过靶向调控VCAN表达,抑制甲状腺癌的细胞增殖。Ghosh等[17]对临床样本进行免疫组化分析,结果显示VCAN高表达与总体生存率较差、无进展生存期、铂耐药性以及肿瘤微血管密度(microvessel density,MVD)增加有关。
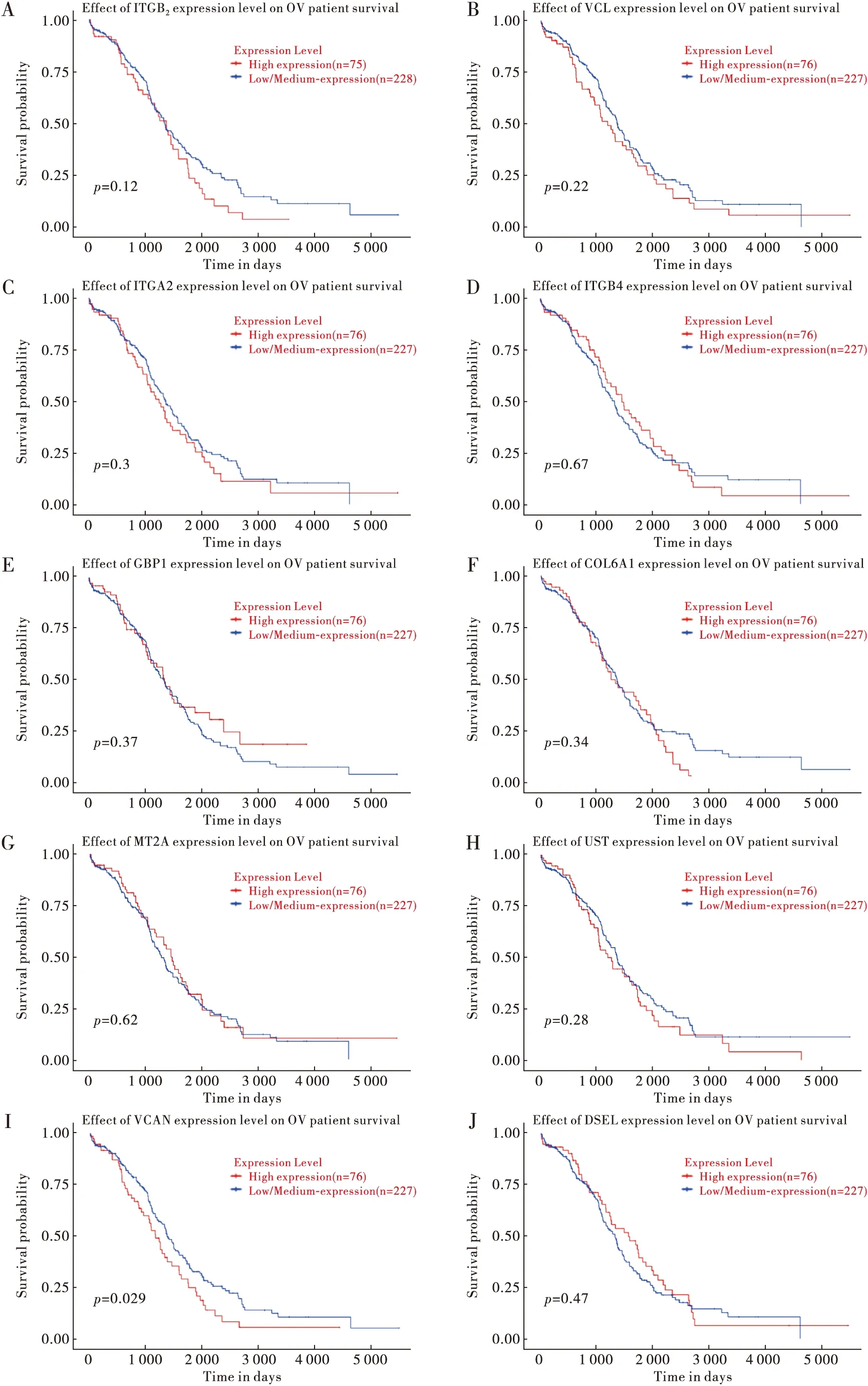
注:A~J依次为基因ITGB2、VCL、ITGA2、ITGB4、GBP1、COL6A1、MT2A、UST、VCAN、DSEL在卵巢癌中生存曲线图图4 UALCAN分析患者的总生存率
综上所述,本文通过GEO数据库、差异基因筛选工具GEO2R分析卵巢癌顺铂耐药基因芯片,结合DAVID在线分析工具、STRING数据库、Cytoscape软件、UALCAN在线网站等分析方法,最终获得VCAN基因与卵巢癌生存风险显著相关,并且可能参与顺铂耐药。下调卵巢癌顺铂耐药患者VCAN基因表达,有可能改善患者耐药,提高患者对顺铂化疗敏感性,使患者获得更大生存希望。

