豆制品废水制备微生物絮凝剂培养条件优化及产物成分分析
尹乐斌,杨爱莲,刘 丹,廖 聪,李乐乐,何 平,刘桠丽
(1.邵阳学院 食品与化学工程学院,湖南 邵阳 422000;2.豆制品加工与安全控制湖南省重点实验室,湖南 邵阳 422000)
随着工业化的迅速发展,化工、食品、养殖、电子等企业每日排放各种废水[1],其有毒有害物质给生态环境造成严重伤害。传统的无机盐类(如铝盐系絮凝剂)、有机高分子(如聚丙烯酰胺)絮凝剂在污水治理中被普遍使用,但对人类健康以及生态环境存在一定的危害[2-3]。微生物絮凝剂是由微生物产生的具有絮凝活性的产物,主要成分有糖蛋白、多糖、蛋白质、核酸等[4],具有高效、无毒、无二次污染、可生物降解等特点,是一种安全的绿色水处理剂。其在食品[5]、重金属[6]、制浆[7]、染料[8]等废水处理中均有应用,且取得良好的效果。然而,微生物絮凝剂发酵产絮凝剂因菌种稳定性差、絮凝能力低和培养成本高,导致其工业化实现较困难。所以,在挖掘新的优良产絮菌的同时,廉价、无毒无害的替代营养基质也很重要。因此,食品加工废水成为微生物絮凝剂培养替代营养基质的首选,目前已报道的有酿酒黄水[9]、糖蜜及啤酒废水[10]、花生壳水解液[11]等,且成效显著。
我国是豆制品生产大国,每生产1 t大豆制品就会产生1 t左右的泡豆废水、4~5 t的豆清液和10 t的左右的清洁废水,其中豆清液中富含有丰富的植物蛋白、氨基酸、脂肪酸等有机物质,化学需氧量(8 000~20 000 mg/L)、生化需氧量(5 000~8 000 mg/L)极高,处理难度大[12]。其作为废水排放,既严重污染环境,又浪费大量的营养物质。
鉴于此,本研究利用平板划线分离方法,在豆制品加工基地的活性污泥及附近土壤样品中分离筛选出一株高效生产絮凝剂的菌株,并对其进行形态学观察及分子生物学鉴定,探究其利用豆清液产微生物絮凝剂,旨在为微生物絮凝剂产絮菌基因库提供新的优良菌株的同时也为豆制品废水绿色处理提供新途径。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及废水
菌种:从豆制品加工与安全控制湖南省重点实验室的活性污泥及附近土壤中筛选、分离获得。
豆制品废水(豆清液):豆制品加工与安全控制湖南省重点实验室提供。
1.1.2 化学试剂
氯化钠、硫酸铵、七水硫酸镁、葡萄糖、酵母粉、尿素:国药集团化学试剂有限公司;无水乙醇、无水氯化钙、高岭土、牛肉膏、蛋白胨、酵母膏:北京奥博星生物技术有限责任公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂15~20 g/L、水1 L,pH 7.0~7.2。121 ℃灭菌20 min。
牛肉膏蛋白胨培养基:牛肉膏5 g/L、蛋白胨10 g/L、氯化钠5 g/L、琼脂15 g/L,水1 L,pH值7.0。121 ℃灭菌20 min。
液体发酵培养基:葡萄糖20 g/L、酵母膏0.5 g/L、K2HPO45 g/L、MgSO40.2 g/L、KH2PO42 g/L、NaCl 0.1 g/L、尿素0.2 g/L、(NH4)2SO40.2 g/L,pH 8.0。108 ℃灭菌30 min。
1.2 仪器与设备
GI54DWS全自动灭菌锅:长沙艾迪生物科技有限公司;D-7PC紫外可见分光光度计:南京菲勒仪器有限公司;SW-CJ-1D超净工作台:江苏通净净化设备有限公司;DH-360电热恒温培养箱、101-1电热恒温鼓风箱:北京中兴伟业仪器公司;BA210生物显微镜:麦克奥迪实业集团有限公司;IS-AX恒温振荡器:苏州捷美电子有限公司。
1.3 实验方法
1.3.1 微生物絮凝剂产生菌的分离、筛选[13]
分离:取适量样品用无菌水进行10倍梯度稀释,取3个适宜的稀释度(10-5、10-6、10-7)涂布于PDA培养基、牛肉膏蛋白胨培养基的分离平板中,分别在30 ℃和37 ℃培养箱中培养,分别分离出真菌和细菌,然后挑取单独的菌株进行多次平板划线分离纯化。将纯菌株于斜面试管中保存、编号,4 ℃保存。
筛选:将纯菌株分别接入到装液量为50 mL/150 mL液体发酵培养基中,真菌于30 ℃、细菌于37 ℃,150 r/min摇床培养72 h。选取发酵液对高岭土悬浊液絮凝效果最好的菌株进行后续实验。
1.3.2 菌株鉴定
观察PDA平板菌落形态、显微镜观察菌体形态、16SrDNA序列测定,确定絮凝剂产生菌的种属,菌株基因序列测定由生工(上海)股份有限公司完成。
1.3.3 絮凝活性分布[14]
将发酵液于离心机8 000 r/min离心20 min,分离上清液和菌细胞,一部分菌细胞加入等体积水制成菌细胞悬液,另一部分菌细胞用蒸馏水洗涤3次,再加入等体积的水制成菌细胞悬液。以蒸馏水作对照,对发酵原液、离心上清液、菌细胞悬液以及洗涤3次后的菌细胞悬液进行絮凝率测定,以确定菌株产絮凝活性物质的分布情况。
1.3.4 絮凝率的测定方法
根据周俊利等[15]的方法,略有改动。高岭土悬浊液质量浓度4 g/L,取20 mL高岭土悬浊液置于25 mL烧杯中,再加入0.8 mL 10%的CaCl2溶液和0.4 mL发酵液,用1 mol/L HCl和1 mol/L NaOH调节pH,用磁力搅拌器充分搅拌1 min,静置10 min,在液面同一刻度下取液体于波长550 nm条件下测定吸光度值。以蒸馏水代替发酵液,其他条件相同作为对照。絮凝率计算公式如下:

式中:A表示对照组上清液在波长550 nm处的吸光度值,B表示样品组上清液在波长550 nm处的吸光度值。
1.3.5 菌株培养条件优化
单因素试验:以豆制品废水为培养基,优化菌株发酵产絮凝剂培养条件。以培养菌株后的发酵液对高岭土悬浊液的絮凝率为评价指标,分别考察豆制品废水添加量(20%、40%、60%、80%、100%)、菌液接种量(1%、2%、3%、4%、5%)、培养基初始pH值(5、6、7、8、9)、培养温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、转速(90 r/min、120 r/min、150 r/min、180 r/min、210 r/min)以及培养时间(24 h、36 h、48 h、60 h、72 h、84 h、96 h)对絮凝效果的影响,从而确定该产絮菌的最佳条件。
正交试验:根据单因素试验结果,选择影响因素较大的培养温度(A)、初始pH值(B)、转速(C)以及培养时间(D),采用L9(34)正交试验设计,进行培养条件优化。正交试验因素与水平见表1。

表1 培养条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for culture conditions optimization
1.3.6 菌株J-7产物的提取及成分分析
将发酵液进行8 000 r/min离心20 min,向上清液中加入2倍体积的预冷无水乙醇,4 ℃静置过夜。离心取沉淀,蒸馏水溶解,按照1∶1体积比加入氯仿-正丁醇溶液(氯仿与正丁醇体积比为5∶2),静置过夜,有机溶剂层加入1∶2的无水乙醇,静置24 h。再离心取沉淀,-45~-20 ℃的温度下真空冷冻干燥3 d,制得微生物絮凝剂[14,16]。
将微生物絮凝剂配制成1 g/L溶液,糖类的定性测定采用蒽酮反应、莫立许反应,蛋白质的定性测定采用双缩脲反应、茚三酮试验[17-18],以及进行紫外光谱扫描、红外光谱分析表征其成分。
2 结果与分析
2.1 菌株的分离与筛选结果
采用平板划线分离法,分离出33株菌株,将其编号为J-1~J-33,以发酵液对高岭土悬浊液的絮凝效果,根据菌株发酵液对高岭土悬浊液的絮凝效果筛选出4株具有絮凝活性的菌株,分别为菌株J-2、J-4、J-6、J-7。菌株J-6、J-7絮凝率最高,初筛复筛均达到70%以上。通过观察其絮凝沉淀体,菌株J-6絮凝沉淀矾花细小,易松散。而菌株J-7 絮体沉淀矾花大紧实且絮凝效率最快,故以菌株J-7为后续实验的研究对象。
2.2 菌株的鉴定
由图1A可知,为菌株J-7在PDA培养基上培养5 d后,菌落中心有突起,质地絮状,菌丝体初期为白色,渐渐转变为浅黄色、黄色,生长7 d后变为墨绿色。由图1B可知,其孢子梗为帚状枝双轮生或单轮生。

图1 菌株J-7的菌落(A)及孢子(B)形态Fig.1 Colony (A) and spore (B) morphology of strain J-7
将菌株J-7进行16S rDNA序列测序,与GenBank数据库中的核酸数据进行同源性对经比,构建系统发育树结果见图2。由图2可知,菌株J-7的序列与菌株Talaromyces pinophilusMF093899.1的序列亲缘性最高,相似度为99%,结合形态学特征观察,菌株J-7 被鉴定为Talaromyces pinophilus。

图2 基于16S rDNA基因序列菌株J-7的系统进化树Fig.2 Phylogenetic tree of strain J-7 based 16S rDNA gene sequence
2.3 絮凝活性分布结果
菌株J-7絮凝活性分布的试验结果见图3。由图3可知,发酵液原液、离心上清液、离心后洗涤及未洗涤的菌细胞悬液均有一定的絮凝效果,且前三者的絮凝效果相差不大,而洗涤3次后的菌细胞悬液絮凝率大幅度降低。结果表明,菌株J-7所产生的絮凝活性成分主要分布于上清液中,为微生物的生长代谢产物,而非菌体本身。此结果与武晓畅等[19-21]的结果一致,微生物絮凝剂主要成分为菌细胞的胞外产物。
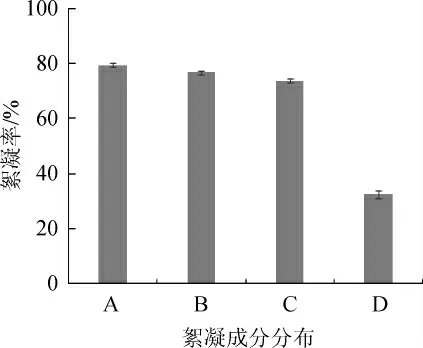
图3 菌株J-7的絮凝活性分布Fig.3 Flocculating activity distribution of strain J-7
2.4 培养条件优化单因素试验
2.4.1 不同废水添加量对絮凝效果的影响
由图4可知,絮凝率随着豆制品废水添加量的增加,呈现先增加后下降的趋势。在添加量为60%时,絮凝率达最大值73.76%。当废水添加量>60%时,絮凝率呈下降趋势。豆制品废水属于一种有机物含量高的废水,浓度越高,其渗透压越大,则菌体生存繁殖受到抑制,从而抑制了其代谢产物的分泌。因此,最适废水添加量为60%。
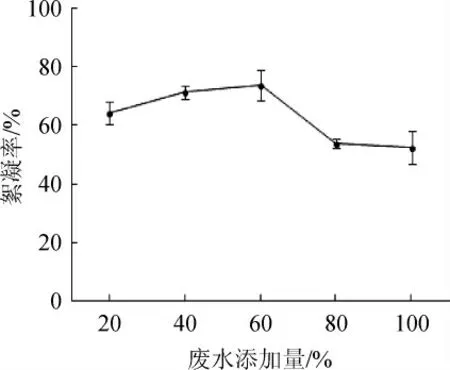
图4 不同废水添加量对絮凝效果的影响Fig.4 Effect of different waste water addition on flocculation
2.4.2 不同接种量对絮凝效果的影响
接种量对菌株J-7产微生物絮凝剂的影响如图5所示,接种量在1%~5%范围内,其絮凝率表现为先上升后下降的趋势,在接种量为4%时,絮凝率达到最大值,为75.04%。接种量过小,菌株在短期内还没适应环境,絮凝率偏低。接种量过大,菌株快速生长繁殖,适应期缩短,由于培养基营养有限,细胞之间相互争夺营养,不利于代谢产物的生成和积累,也加速了菌株的老化,从而导致絮凝率下降[22]。因此,控制适合的菌种接种量,才能有益于微生物的生长,提高絮凝物质的产量和活性。因此,最适接种量为4%。
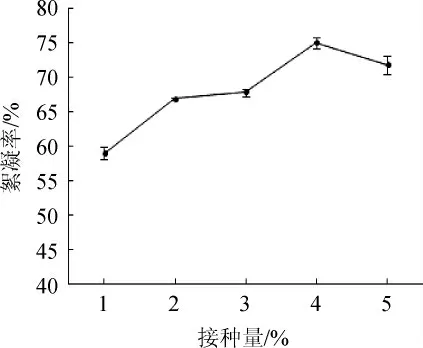
图5 接种量对絮凝效果的影响Fig.5 Effect of inoculum on flocculation
2.4.3 不同培养基pH对絮凝效果的影响
由图6可知,在初始pH 5~9范围内,菌株J-7发酵液的絮凝率表现为先升高再降低,在pH值为6时达到最大值,当pH>7时,絮凝率有所下降,总体表现为酸性环境下更适于菌株J-7生长代谢产絮凝剂,碱性环境不利于絮凝剂的合成积累。原因可能为环境pH值的高低直接影响菌细胞表明的电荷、细胞壁通道大小、有机物的离子化作用以及某些生物酶的活性,导致微生物对营养物质的吸收利用能力降低,从而影响代谢物的分泌[23]。因此,最适培养基初始pH值为6。

图6 培养基初始pH对絮凝效果的影响Fig.6 Effect of medium initial pH value on flocculation
2.4.4 不同培养温度对絮凝效果的影响
温度的高低会直接对微生物的生长代谢产生重要的影响。由图7可知,在温度为20~40 ℃时,随着温度的上升,絮凝率出现先上升再降低的趋势,且在25~35 ℃时其发酵液对高岭土悬浊液的絮凝率较好,絮凝率均>70%,并在温度为25 ℃时絮凝率达到最大。低温环境下,细胞内的某些酶不能很好的发挥其活性,代谢速率缓慢。温度过高,会导致菌株内某些生物酶变性失活,从而使产物的合成受到影响[16]。因此,最适培养温度为25 ℃。
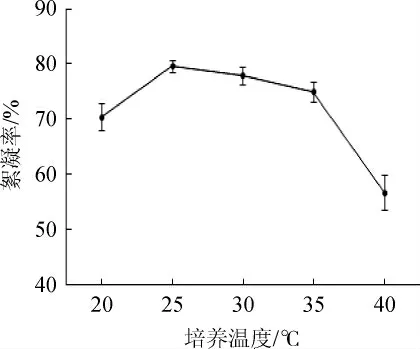
图7 培养温度对絮凝效果的影响Fig.7 Effect of culture temperature on flocculation
2.4.5 不同转速对絮凝效果的影响
由图8可知,在摇床转速为90~210 r/min时,絮凝率呈先增高再降低的趋势,在150 r/min时,絮凝率达到最大值,为80.36%,超过这个值,絮凝率大幅度下降。摇床转速主要为对菌株的供氧过程,转速过慢,氧气供不应求,菌株不能正常的生长代谢,絮凝率低;转速过快,培养体系内离心作用过于强烈,不利于菌株正常的生长[17]。选择适宜的培养转速,减少对菌株损伤程度,有利于絮凝剂的累积。因此,最适转速为150 r/min。

图8 转速对絮凝效果的影响Fig.8 Effect of rotation speed on flocculation
2.4.6 不同培养时间对絮凝效果的影响
不同种类的微生物,分泌絮凝物质的时间各有不同。由图9可知,菌株J-7在24~96 h内,絮凝率先增大后降低。豆制品废水本身是一种无毒无害且营养丰富的有机废水,是大多数微生物的理想培养基。在24~48 h范围内,培养基营养充足,利于菌株J-7生长繁殖,絮凝率大幅度增加,并在48 h时絮凝率最大,为86.78%。48~72 h内,大部分营养物质被消耗完,此时菌株浓度高,相互竞争,生长受限抑制,代谢产物减少,导致絮凝率降低。72 h之后,菌细胞浓度达到平衡,絮凝率慢慢趋于稳定状态。因此,最佳发酵培养时间为48 h。

图9 培养时间对絮凝效果的影响Fig.9 Effect of culture time on flocculation
2.5 培养条件优化正交试验
为优化菌株J-7利用豆制品废水产絮凝剂的培养条件,根据单因素试验,以絮凝率为评价指标,选择培养温度(A)、培养基初始pH 值(B)、转速(C)以及培养时间(D)4个因素,按照正交设计L9(34)进行试验,正交试验结果及方差分析见表2。
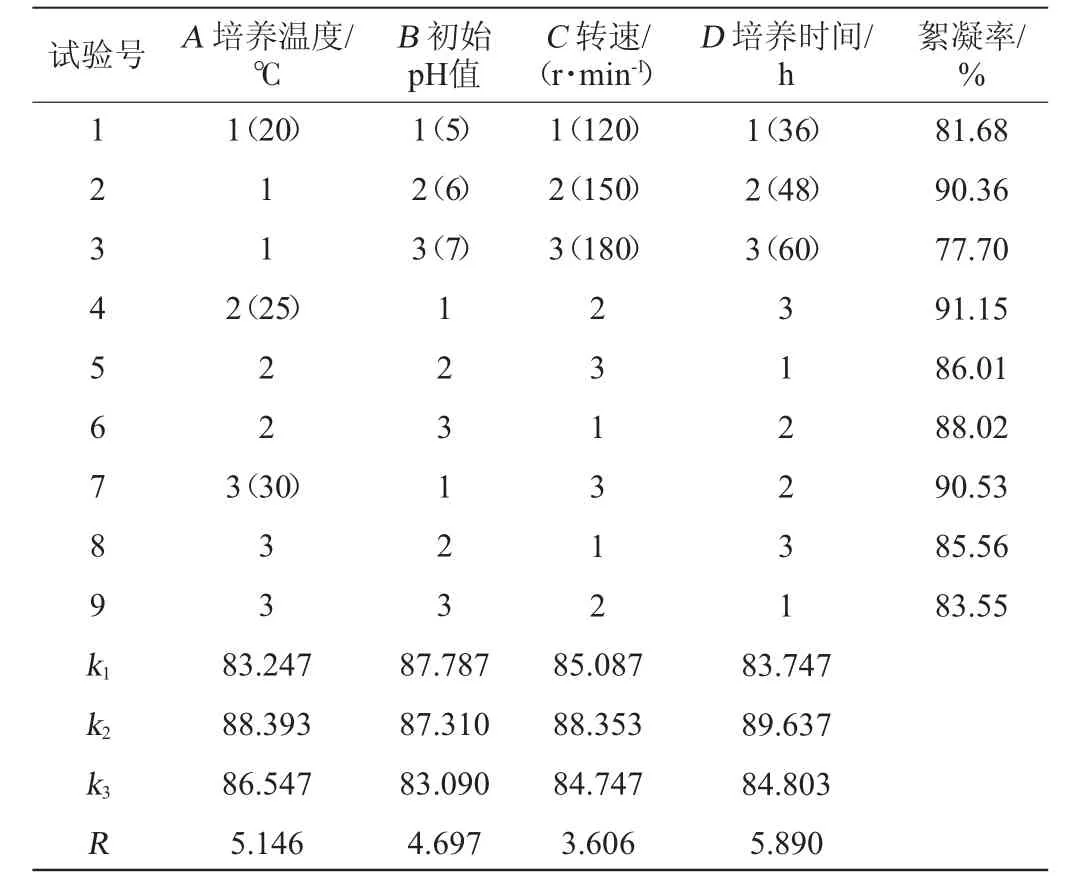
表2 培养条件优化正交试验结果及分析Table 2 Results and analysis of orthogonal experiments for culture conditions optimization
由表2可知,各因素对菌株J-7产絮凝剂能力的影响主次因素顺序为:培养时间>培养温度>初始pH值>转速。其中正交试验表中第4组,即A2B1C2D3组合的絮凝率最高,达到91.15%,但根据极差分析,该菌株的最佳培养条件组合为A2B1C2D2,即温度25 ℃、初始pH值5、转速150 r/min,发酵48 h。在此最佳条件下进行验证试验,发酵液絮凝率达到93.42%。
2.6 微生物絮凝剂成分分析及结构表征
对微生物絮凝剂分别进行糖类和蛋白质的定性检测试验,结果见表3。由表3可知,莫立许反应、蒽酮反应为检验样品中是否含有糖类物质,它们能与糖类物质产生颜色反应,从而证明是否存在糖类,而这两种反应均出现阳性,发生颜色反应,说明该絮凝剂含有糖类物质;双缩脲反应、茚三酮反应能与蛋白质产生呈色反应,在此结果中两种反应均为阴性,没有颜色变化,说明该样品不含蛋白质或者蛋白质含量极少。

表3 絮凝剂的定性分析结果Table 3 Qualitative analysis results of flocculants
由图10可知,该絮凝剂为一条较为光滑的吸收曲线,在波长260 nm处无明显吸收峰,在280 nm处有微弱的吸收峰,说明絮凝物中有微量的蛋白质,表明不含有核酸物质[14,24],初步判断该絮凝剂的主要成分为多糖类物质。

图10 絮凝剂紫外光谱分析Fig.10 Ultraviolet spectrum analysis of flocculants
由图11可知,该絮凝剂在波数为3 269.41 cm-1处有一个吸收峰,表明分子间有-OH的存在;在波数为2 929.82 cm-1处出现强度较弱的吸收峰为C-H的伸缩振动峰,为饱和C-H伸缩振动的信号,可能存在碳水化合物;在波数为1643.33cm-1和1 317.23 cm-1处的吸收峰分别为C=O不对称伸缩振动和C=O对称伸缩振动,其中在波数为1 643.33 cm-1处的峰与蛋白质和氨基糖中-CONH-官能团的C=O伸缩振动有关;在波数为1 077.38 cm-1处有吸收峰,表明该物质含有C-O和C-N官能团的存在[25-27]。综上所述,表明该絮凝剂含有羰基、羟基、羧基、氨基等官能团,而这些基团存在可能对絮凝分子的吸附效果有促进作用。
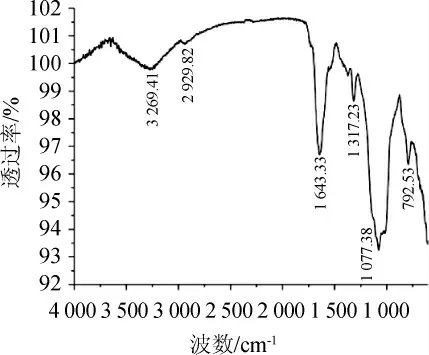
图11 絮凝剂红外光谱分析Fig.11 Infrared spectrum analysis of flocculants
3 结论
采用平板划线法分离筛选出一株产絮凝剂的高效絮凝菌J-7,其发酵液对高岭土悬液具有较好的絮凝效果,经形态学观察及16S rDNA基因测序,菌株J-7被鉴定为Talaromyces pinophilus。该菌株能够在豆制品废水中良好生长繁殖,产生具有絮凝活性的物质,最佳培养条件为培养温度25 ℃,初始pH值5,转速150 r/min,培养时间48 h。在此优化条件下,其发酵液絮凝率可达到93.42%。对提纯后的絮凝剂进行定性测定、紫外光谱扫描及红外光谱分析结果表明其主要成分为多糖,其中含有羰基、羟基、羧基、氨基等官能团。

