沙棘总黄酮抗单侧输尿管梗阻大鼠肾脏纤维化作用及机制
李艺文,唐志书*,张珍*,梁涛,宋忠兴,王昌利,,马虎强,王宇鹏(.陕西中医药大学 陕西省中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西中药产业技术研究院,陕西 咸阳 708;.陕西海天制药有限公司,陕西 咸阳 7046;.内蒙古海天制药有限公司,内蒙古 通辽 08000)
慢性肾脏疾病(chronic kidney disease,CKD)是指由于各种原因引起的慢性肾脏结构和功能障碍,包括各种原发的、继发的肾小球肾炎、肾小管损伤和肾血管的病变等,其特点是发病率高、伴发的心血管患病率高、病死率高[1]。肾脏纤维化是CKD的主要病理基础。目前研究认为肾脏纤维化不可逆,临床上用于治疗的药物主要分为血管紧张素转换酶抑制剂和血管紧张素受体拮抗剂两大类,但是治疗效果不佳,且伴随一系列的不良反应[2]。因此,寻找有效减缓肾脏纤维化的药物已成为CKD治疗的关键。
沙棘总黄酮(total flavonoids of hippophae,TFH)是从沙棘(Hippophae rhamnoidesLinn.)中提取的有效活性成分,主要含有槲皮素、异鼠李素及山柰酚等[3]。近年多项研究发现,槲皮素可改善单侧输尿管梗阻(unilateral ureteral obstructive,UUO)大鼠肾功能,具有抗UUO大鼠肾脏纤维化的作用[4-6];异鼠李素具有抗肝脏纤维化和肺纤维化的作用[7-9];因此,推测沙棘总黄酮可能具有抗肾脏纤维化的作用。本研究拟建立UUO大鼠肾脏纤维化模型,研究沙棘总黄酮对UUO大鼠肾脏纤维化的影响,并探讨其作用机制。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(200±10)g [成都达硕实验有限公司,动物生产许可证号SCXK(川)2020-030]。
1.2 试药
沙棘总黄酮(陕西海天制药有限公司,以异鼠李素为标准,沙棘总黄酮含量为30%);α-平滑肌肌动蛋白(α-SMA)、钙黏附蛋白-E(E-cadherin)、细胞间隙连接蛋白(Cx43)(美国Cell Signaling Technology公司);纤维连接蛋白(Fibronectin)(美国Santa Cruz biotechnology公司);转化生长因子-β1(TGF-β1)和甘油醛-3-磷酸脱氢酶(GAPDH)(中国Proteintech公司);HRP标记山羊抗小鼠二抗、山羊抗兔二抗、RIPA(强)裂解液(上海碧云天生物技术有限公司);BCA蛋白定量试剂盒(陕西中晖赫彩生物医药科技有限公司);内源性H2S检测试剂盒(南京建成生物工程研究所);PVDF膜(美国Merck Millipore公司)。
1.3 仪器
LD5-2A型低速离心机(北京雷博尔);DSZ 2000X型倒置显微镜(重庆澳浦);Thermo Multiskan GO多功能酶标仪(美国Thermo);Western blot曝光仪器ChemiDoc XRS+凝胶成像1708265(美国Bio-bad)。
2 方法
2.1 造模、分组及给药
雄性SD大鼠50只,腹腔注射1%戊巴比妥钠(35 mg·kg-1)麻醉大鼠,腹部左侧切口,双结扎左侧输尿管的近端中上三分之一处,然后在两个结扎处之间将输尿管剪断,逐层缝合腹腔。假手术组仅游离,不结扎不剪断[10]。将50只大鼠随机分为5组(n=10):假手术组、模型组、依那普利组(10 mg·kg-1)、沙棘总黄酮低剂量组(175 mg·kg-1)、沙棘总黄酮高剂量组(350 mg·kg-1)。给药组使用蒸馏水配制并灌胃给药,假手术组及模型组给予等量蒸馏水灌胃。术前给药3 d,术后连续给药2周,每日一次。
2.2 标本采集
手术2周后,用1%戊巴比妥钠(35 mg·kg-1)麻醉,腹主动脉采血,收集血清,将其保存于-80℃。取左侧肾脏组织,除去肾包膜,生理盐水冲洗,从中间纵切,1/2固定于4%多聚甲醛,1/2保存于-80℃进行后续蛋白表达分析。
2.3 肾组织形态学观察
2.3.1 测定肾脏重量、皮质厚度及长度 将肾脏取出后,生理盐水冲洗,称重。将固定后的1/2肾脏取出,观察UUO诱导大鼠肾脏大小和肾盂扩张情况,肾脏纵切面测量肾皮质厚度和肾脏长度。
2.3.2 Masson染色 肾脏组织用4%多聚甲醛缓冲液固定24 h,石蜡包埋、切片,进行Masson染色。观察肾小管扩张、管型形成和间质细胞外基质沉积,并采用Image J软件对胶原纤维的蓝色阳性染色进行定量分析。
2.3.3 免疫组化分析 石蜡切片脱蜡、水化后,置于枸橼酸缓冲液中煮沸15 min;置3% H2O2中灭活,3%BSA 室温封闭1 h;孵育Ⅰ抗:α-SMAⅠ抗的稀释比例为1∶1000,Cx43 Ⅰ抗的稀释比例为1∶100,FibronectinⅠ抗的稀释比例为1∶500,置于4℃冰箱过夜;α-SMA、Cx43和Fibronectin Ⅱ抗的稀释比例均为1∶200,室温孵育Ⅱ抗1 h;按DAB显色试剂盒说明配制显色液,滴加后镜下控制反应时间;洗涤、苏木素复染、脱水、透明、封片。阳性表达呈棕黄色或深棕色染色,采用Image J软件分析对阳性表达进行定量分析。
2.4 肾脏组织纤维化相关蛋白表达量检测
取各组大鼠肾脏组织研碎,加入裂解液4℃低温匀浆。将裂解物转移至离心管中4℃ 12 000 r·min-1离心收集裂解液上清,采用BCA试剂盒蛋白定量,取60 µg蛋白样品经10% SDS-PAGE电泳,转膜,封闭,一抗4℃过夜,PBST洗膜,加入二抗,孵育1 h,洗膜后用ECL发光试剂显影,使用凝胶成像系统进行拍照。采用Image J分析软件,以GAPDH为内参蛋白,定量计算各组样品间蛋白相对表达量。上述实验重复3次。
2.5 肾脏组织和血清中H2S检测
采用内源性H2S检测试剂盒检测肾脏组织和血清中H2S水平,按照试剂盒说明操作,内源性H2S与醋酸锌、N,N-二甲基对苯二胺和硫酸铁铵等反应生成亚甲基蓝,显色,使用酶标仪在665 nm处测定吸光度,并进行统计分析。
2.6 统计学处理
采用SPSS 17.0进行统计分析,数据以均数±标准差表示,两组数据比较采用t检验,组间数据比较用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 沙棘总黄酮改善UUO大鼠肾脏组织形态
造模第14日后,肉眼可见UUO导致大鼠肾脏肾盂扩张、皮质变薄,经测量发现UUO引起肾脏重量增加、皮质变薄、长度增大。给予沙棘总黄酮干预,以上各项肾脏形态指标均显著改善(见图1)。

图1 沙棘总黄酮对UUO大鼠肾脏形态的影响(n=4)Fig 1 Effect of TFH on the renal morphology in UUO rat(n=4)
3.2 沙棘总黄酮减少UUO大鼠肾脏纤维化模型中胶原纤维的沉积
与假手术组相比,模型组大鼠肾脏的胶原纤维大量沉积,纤维化面积显著增大(P<0.01),表明造模成功。与模型组比较,沙棘总黄酮高、低剂量组大鼠的肾脏胶原纤维化面积显著减小(P<0.05),表明沙棘总黄酮可有效减缓肾脏胶原纤维的形成(见图2)。

图2 沙棘总黄酮对UUO大鼠肾脏组织胶原纤维沉积的影响(n=4,200×)Fig 2 Effect of TFH on the accumulation of collagen fibrils in UUO rat(n=4,200×)
3.3 沙棘总黄酮抑制UUO大鼠肾脏组织Fibronectin的表达
免疫组化结果表明,与假手术组相比,模型组大鼠肾脏组织中Fibronectin表达显著升高(P<0.05);与模型组比较,沙棘总黄酮高、低剂量组Fibronectin表达显著降低(见图3A、B,P<0.05)。Western blot结果表明,与假手术组相比,模型组Fibronectin蛋白表达显著升高(见图3C,P<0.01);与模型组比较,沙棘总黄酮高、低剂量Fibronectin蛋白表达水平明显下调(见图3C,P<0.05)。表明沙棘总黄酮可降低细胞外基质(ECM)的沉积,有效改善UUO大鼠肾脏纤维化。

图3 沙棘总黄酮对UUO大鼠肾脏组织ECM的影响(200×;A&B.n=4;C.n=3)Fig 3 Effect of TFH on the expression of ECM in UUO rat(200×;A&B.n=4;C.n=3)
3.4 沙棘总黄酮抑制UUO大鼠肾脏组织上皮细胞-间充质转化(EMT)形成
免疫组化结果表明,与假手术组相比,模型组肾脏组织中α-SMA显著升高(P<0.01);给予沙棘总黄酮高、低剂量组干预后,α-SMA显著降低(P<0.01)。Western blot结果发现,与假手术组相比,模型组α-SMA蛋白表达显著升高,E-cadherin显著降低(P<0.05);给予沙棘总黄酮高、低剂量干预后,α-SMA蛋白表达下调,E-cadherin蛋白表达上调(P<0.05)。表明沙棘总黄酮能有效抑制UUO大鼠肾脏组织EMT的形成(见图4)。

图4 沙棘总黄酮对大鼠UUO肾脏组织EMT形成的影响(200×;A&B.n=4;C&D.n=3)Fig 4 Effects of TFH on EMT formation in UUO rat(200×;A&B.n=4;C&D.n=3)
3.5 沙棘总黄酮抑制UUO大鼠肾脏组织TGF-β1蛋白表达
结果表明,与假手术组相比,模型组TGF-β1水平显著升高(P<0.01);与模型组比较,沙棘总黄酮高、低剂量组TGF-β1水平均显著下降(见图5,P<0.05)。
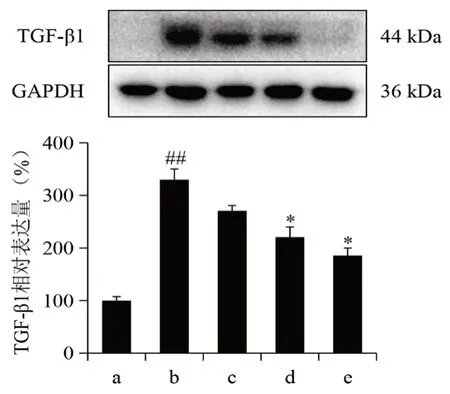
图5 沙棘总黄酮对大鼠UUO模型诱导肾脏组织中TGF-β1水平的影响(n=3)Fig 5 Effect of TFH on the TGF-β1 level in kidney tissue of UUO rat(n=3)
3.6 沙棘总黄酮上调UUO大鼠肾脏组织和血清中H2S水平
与假手术组相比,模型组肾脏组织和血清中H2S水平显著下降(P<0.01),而沙棘总黄酮干预后,H2S水平均显著升高(见图6,P<0.01),表明沙棘总黄酮可上调UUO大鼠内源性H2S水平。

图6 沙棘总黄酮对大鼠UUO模型诱导肾脏组织和血清中H2S水平的影响(±s,n=7)Fig 6 Effect of TFH on the kidney tissue and plasma H2S level in UUO rat(±s,n=7)
3.7 沙棘总黄酮抑制UUO大鼠肾脏组织Cx43的表达
免疫组化结果表明,与假手术组相比,模型组大鼠肾脏组织中Cx43表达显著升高(P<0.01),而沙棘总黄酮高剂量组的Cx43表达与模型组比较显著降低(见图7,P<0.05)。

图7 沙棘总黄酮对大鼠UUO模型肾脏组织中Cx43的影响(200×,n=4)Fig 7 Effect of TFH on the expression of Cx43 in UUO rat(200×,n=4)
4 讨论
本研究建立经典的UUO大鼠肾脏纤维化模型,研究沙棘总黄酮对肾脏纤维化的影响及其机制。结果发现沙棘总黄酮改善UUO大鼠肾脏形态及皮质厚度,抑制UUO大鼠肾脏组织中胶原纤维形成和Fibronectin的表达,表明沙棘总黄酮能减少ECM的沉积;减少α-SMA的表达,增加E-cadherin的表达,表明沙棘总黄酮能抑制EMT的形成;其中沙棘总黄酮高剂量组效果强于沙棘总黄酮低剂量组。提示沙棘总黄酮具有抗肾脏纤维化的作用。
TGF-β1在纤维化的进展中起关键作用。TGF-β1主要介导TGF-β1/Smads和非Smad信号通路的激活,引起EMT的形成和ECM的进行性聚集,而ECM的降解减少,会导致肾小球硬化、肾小管间质纤维化,最终使肾功能丧失[11]。本研究发现沙棘总黄酮可显著抑制UUO大鼠肾脏组织TGF-β1的表达,但是沙棘总黄酮的抗肾脏纤维化作用是否通过TGF-β1/Smads和非Smad信号通路还需进一步的研究证实。
众所周知,H2S是继一氧化氮、一氧化碳后被发现的第三种人体内重要的气体信号分子。临床研究表明CKD患者血清中H2S水平下降[12],多项研究表明UUO大鼠的H2S水平相比于假手术组显著降低,给予NaHS供体干预,可显著改善其肾脏纤维化[10]。本研究发现沙棘总黄酮可上调UUO大鼠肾脏组织和血清H2S水平,但沙棘总黄酮是否通过影响产生H2S相关酶CBS、CSE和3-MST的表达以及沙棘总黄酮如何通过上调内源性H2S改善UUO大鼠肾脏纤维化,有待进一步研究。
细胞间隙连接或称缝隙连接,在肾脏组织中有着广泛的分布,在维持肾脏组织结构和功能中起重要的作用[13]。Cx43蛋白是主要的间隙连接组成蛋白[14]。近年来有研究证实Cx43在高血压性肾病和梗阻性肾病的早期表达增加,抑制Cx43表达降低了炎症细胞浸润和肾纤维化,并明显改善了肾脏的结构和功能,Cx43被认为是治疗CKD的新靶点[14,15-17]。本研究中发现沙棘总黄酮高剂量可显著抑制Cx43的表达,表明其抗肾脏纤维化作用很可能是通过Cx43发挥的。
综上所述,沙棘总黄酮可显著改善UUO大鼠肾脏纤维化,抑制EMT形成和降低ECM沉积,其作用机制可能与降低TGF-β1表达,升高内源性H2S水平和抑制Cx43表达有关。沙棘总黄酮有可能发展为潜在的抗肾脏纤维化的治疗药物。

