基于网络药理学和分子对接探讨珠子参地上部分防治脂肪肝的作用机制
郭敏,贺依依,徐虹,姜祎*,张化为,杨新杰,黄文丽,邓翀,许洪波,王薇*,宋小妹(.陕西中医药大学药学院,陕西 咸阳 7046;.陕西省中药资源产业化协同创新中心、陕西省创新药物研究中心,陕西 咸阳 7046)
脂肪肝是由多种疾病和原因引起的肝脏脂肪性变[1],可进一步发展为脂肪性肝炎、肝硬化、肝癌,而且脂肪肝是冠心病的易患因素之一[2]。由于其发病率不断增加,已经成为一种严重威胁人类健康的高发疾病[3-4]。
珠子参为五加科植物珠子参Panax japonicusC.A.Mey.var.major(Burk.)C.Y.Wu et K.M.Feng或羽叶三七Panax japonicusC.A.Mey.var.bipinnatifidus(Seem.)C.Y.Wu et K.M.Feng的干燥根茎[5],主要分布在陕西、甘肃、宁夏、河南、湖南、湖北、四川、云南、西藏等地[6]。珠子参的化学成分多样,主要包括三萜及其皂苷类、挥发油类、甾体及其皂苷类、黄酮类及微量元素等[7],其中,珠子参的皂苷类化学成分表现出较强的抗肿瘤活性[8]和抗肝损伤作用[9]。珠子参的地上部分称为“参叶”“汉中参叶”,局部地区仅将其作为茶叶饮用,利用率低。珠子参可通过抑制c-Jun氨基末端激酶(JNK)和C/EBP同源蛋白(CHOP)的表达来抑制高脂饮食模型组大鼠的肝细胞凋亡,对高脂饮食诱发的肝损伤具有一定保护作用[10]。本研究拟对珠子参地上部分防治脂肪肝的有效成分以及相关作用机制进行探讨。
本研究遵循网络药理学理论与技术[11],筛选珠子参地上部分活性成分及潜在靶点,通过构建活性成分和靶标(C-T)、靶标和疾病(T-D)网络图,并进行GO功能和KEGG通路的富集分析以及分子对接验证,通过实验验证珠子参地上部分对环氧合酶2(PTGS2)、丝裂原激活的蛋白激酶3(MAPK3)、过氧化物酶体增殖物激活受体γ(PPARG)的影响,以期从分子层面初步探讨珠子参地上部分防治脂肪肝的可能作用机制,为后续深入研究珠子参地上部分防治脂肪肝作用提供参考依据。
1 材料与方法
1.1 网络药理学
1.1.1 数据库及软件 TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php);Swiss TargetPrediction数据库(http://www.swisstargetprediction.ch/);Uniprot数据库(https://www.uniprot.org);Genecards数据库(https://genecards.weizmann.ac.il/v3/);Cytoscape 3.2.1软件;功能蛋白联系网络(String)数据库(https://string-db.org/);R project软件;Autodock_vina 软件(http://vina.scripps.edu/);Protein Data Bank数据库(PDB https://www.rcsb.org/);运行环境 Microsoft Windows 10 Home Basic操作系统。
1.1.2 珠子参地上部分活性成分及其靶点的筛选
利用TCMSP数据库、Swiss TargetPrediction数据库及现有文献报道,查找珠子参地上部分中的化学成分,在此基础上以OB≥20%、DL≥0.1作为活性成分筛选条件[12],将筛选出的活性成分逐一配对潜在作用靶点,再通过Uniprot数据库进行靶点蛋白和基因信息校正,预测珠子参地上部分主要活性成分的靶点。
1.1.3 脂肪肝相关疾病靶点的筛选 以“fatty liver”为关键词在Genecards数据库中查找与脂肪肝相关的靶点。将活性成分靶点与疾病靶点取交集绘制韦恩图,筛选出共同靶点。
1.1.4 “药物-成分-疾病-靶点”网络的构建将珠子参地上部分活性成分与脂肪肝相关疾病靶点数据输入Cytoscape软件,构建“药物-成分-疾病-靶点”网络。
1.1.5 关键靶点蛋白相互作用网络的构建 将筛选出的共同靶点输入String数据库,构建靶点蛋白互作(PPI)网络图,在构建的PPI网络图中,节点的大小和颜色深浅反映了度值(degree)大小,边粗细反应组合分数(combine score)大小。计算网络中节点度值,度值越大代表节点在网络中越处于核心地位,分析PPI网络图,并按度值大小进行分类。
1.1.6 关键靶点的GO分析与KEGG通路富集分析 使用R project软件的生物学分析功能,对珠子参地上部分防治脂肪肝的关键靶点进行GO分析和KEGG通路富集分析。在此程序语言中,定义P<0.05,Q<0.05,最后将分析结果以条形图的形式展示。
1.1.7 活性成分与关键靶点的分子对接验证根据上述筛选出的活性成分和核心靶点,从PDB 数据库获取相应靶点的蛋白结构,使用Autodock_vina 软件对靶点与活性成分进行分子对接验证。
1.2 动物实验验证
1.2.1 试药与仪器 珠子参地上部分(来源于道地产区陕西秦岭,经陕西中医药大学中药资源办公室鉴定为中药珠子参的干燥带茎叶);生理盐水(100 mL,西安京西双鹤药业有限公司);鱼肝油(批号:20200407,青岛双鲸药业有限公司);总胆固醇(T-CHO)测定试剂盒(批号:20200506)、三酰甘油(TG)测定试剂盒(批号:20200508)(南京建成生物工程研究所)。山羊血清(批号:SL038,北京索莱宝科技有限公司),DAB(批号:DAB-1031,福州迈新生物技术开发有限公司),HRP-山羊抗兔IgG(批号:115-035-003,美国Jackson ImmunoResearch公司);PTGS2(WL0232a)、MAPK3(WL01864)、PPARG(WL01800)(万类生物科技有限公司)。
GZX-9240MBE型电热鼓风干燥箱(上海博迅实业有限公司);KQ-50E型超声波清洗器(昆山市超声仪器有限公司);Elx808型吸收光酶标仪(美国伯腾仪器有限公司);AL204型电子天平(梅特勒-托利多仪器有限公司);ACS-A型电子计重秤(上海友声衡器有限公司);KDC-160HR型高速冷冻离心机(科大创新股份有限公司中佳分公司)。
1.2.2 实验动物 昆明种小鼠40只,高脂饲料、普通饲料均由西安交通大学提供。高脂饲料:每500 g普通饲料加入蛋黄粉30 g,鱼肝油2粒(含维生素A 4000单位,维生素D31400单位),白砂糖10 g、猪油10 g、食盐3 g,混匀,制棒状,90℃烘干[13]。
1.2.3 珠子参地上部分提取物的制备 取干燥珠子参地上部分320.00 g,加13倍量水,浸泡0.5 h,煎煮3次,每次2 h,过滤,合并滤液,浓缩,干燥,得到珠子参地上部分水提物粉末56 g。取珠子参地上部分水提物粉末适量,加水配制成0.2 g·mL-1的溶液备用。
1.2.4 肥胖模型建立 选用体质量20~24 g雌性小鼠24只,随机分为正常组和肥胖模型组。正常组6只,喂养普通饲料;肥胖模型组18只,喂养高脂饲料。连续喂养35 d,期间质量小鼠均自由摄食、摄水。
1.2.5 实验方法 将肥胖模型组小鼠随机分为3组,分别为模型组、高剂量组和低剂量组,每组6只。模型组按0.2 mL/只灌胃生理盐水,高剂量组按0.2 mL/只灌胃0.2 g·mL-1的珠子参地上部分提取物,低剂量组按0.1 mL/只灌胃0.2 g·mL-1的珠子参地上部分提取物,每日一次,连续灌胃一周。给药结束最后1 d,禁食12 h,内眦取血,1000×g离心10 min分离血清,测定各组血清中 TG、TC水平。
取小鼠肝脏组织,将肝脏组织用4%多聚甲醛固定液充分固定后分为两份进行组织学制片,一份样品用30%蔗糖溶液脱水后用OCT包埋制作冰冻切片,冰冻切片制备完成后进行油红O染色;另一份样品用于免疫组化实验,固定好的组织经包埋切片后,将切片脱蜡至水,抗原修复后使用3%过氧化氢室温孵育25 mim,PBS清洗5 min(3次);滴加10%正常山羊血清均匀覆盖组织室温封闭30 min;甩掉血清,加入按比例稀释好的一抗均匀覆盖组织,4℃过夜后从冰箱拿出切片复温30 min,PBS洗5 min(3次),加入按比例稀释好的二抗室温孵育50 min,PBS洗5 min(3次);用现配的DAB显色,纯水冲洗终止显色;苏木精复染,脱水、透明、封固。
2 结果
2.1 珠子参地上部分活性成分及其靶点筛选
经过筛选,共有5个主要活性成分与课题研究相关,如表1所示。对这5个成分进行靶点预测以及靶点蛋白和基因信息校正,筛选重复值后得到175个靶点。
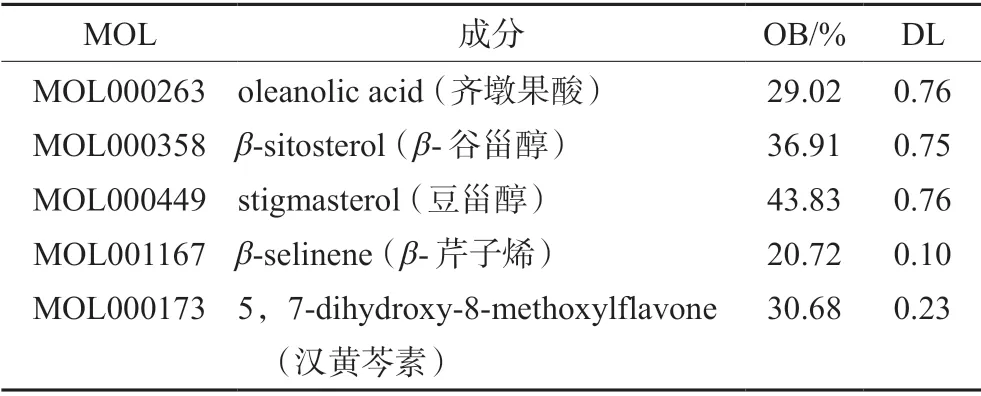
表1 珠子参地上部分中的主要活性成分Tab 1 Main active ingredients in APRPM
2.2 脂肪肝相关疾病靶点的筛选
Genecards数据库中共查找到与脂肪肝相关的靶点1481个,然后将上述的预测靶点与疾病靶点取交集绘制韦恩图,筛选出共同靶点86个,如图1所示,将其定义为珠子参地上部分防治脂肪肝的关键靶点。

图1 脂肪肝相关靶点与珠子参地上部分作用靶点交集Fig 1 Intersection of related targets of fatty liver with in APRPM targets
2.3 “药物-成分-疾病-靶点”网络的构建和分析
将珠子参地上部分活性成分与脂肪肝相关疾病靶点数据输入Cytoscape软件,构建“药物-成分-疾病-靶点”网络,如图2所示(其中蓝色菱形代表药物,粉色多边形代表药物中所含的活性成分,黄色六边形代表疾病,蓝色圆形代表药物活性成分所作用的靶点映射到疾病的靶点;网络图中的节点代表珠子参地上部分及其有效活性成分、疾病、靶点等;边代表珠子参地上部分与其活性成分、活性成分与成分作用靶点、疾病与作用靶点等之间的相互关系)。

图2 珠子参地上部分防治脂肪肝的“药物-成分-疾病-靶点”网络Fig 2 “Drug-component-disease-target” network for the prevention and treatment of fatty liver in APRPM
2.4 关键靶点PPI网络的构建
将筛选出的关键靶点输入到String数据库,构建珠子参地上部分防治脂肪肝靶点PPI网络图,如图3所示。在构建的PPI网络中共包含节点84个,边513条。其中该网络图中靶点对应的平均度值为12.21,按照度值大于平均值筛选出的关键靶点有29个,如表2所示。靶点的度值越高,活性成分作用于该靶点发挥治疗作用的概率越大。

图3 珠子参地上部分防治脂肪肝靶点PPI网络图Fig 3 Protein-protein interaction network of APRPM prevention and treatment of fatty liver targets

表2 部分关键靶点的度值参数Tab 2 Degree parameters of some key targets
2.5 GO分析和KEGG通路富集分析
利用软件R projiect分析86个关键靶点主要富集的细胞学组分、分子功能与生物学过程。其中所涉及的生物学功能与过程有类固醇代谢过程、脂肪酸代谢过程、不饱和脂肪酸代谢过程、脂肪酸衍生物代谢过程等。前20位GO分析结果见图4。
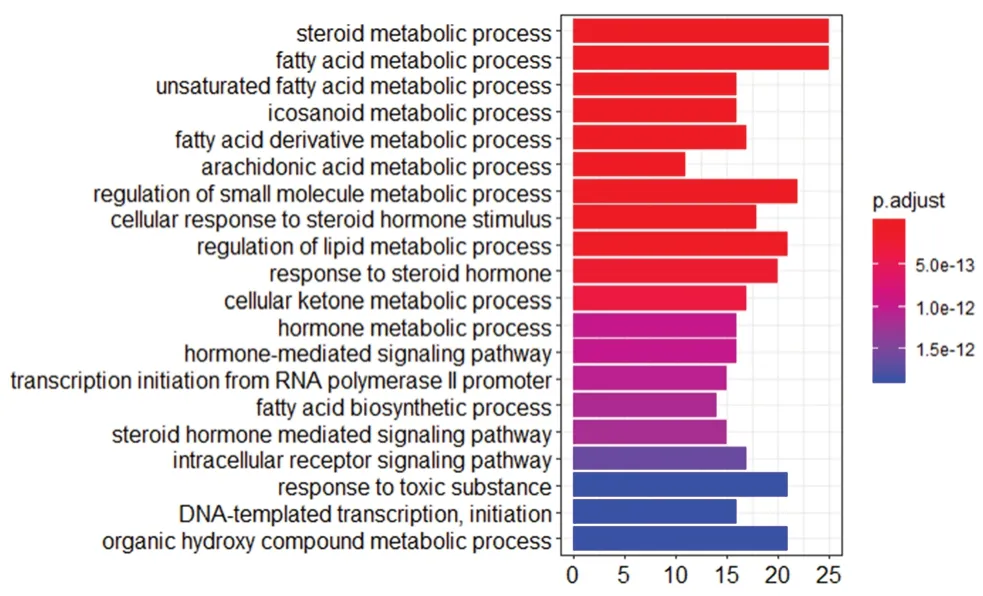
图4 关键靶点的GO富集分析Fig 4 Gene ontology pathway enrichment analyses
对珠子参地上部分防治脂肪肝的86个关键靶点进行 KEGG 富集分析,涉及的通路包括PPAR信号通路(PPAR signaling pathway)、非酒精性脂肪肝通路(non-alcoholic fatty liver disease)、细胞色素P450对外源生物的代谢通路(metabolism of xenobiotics by cytochrome P450)、脂肪消化吸收通路(fat digestion and absorption)。通过通路富集分析发现这些信号通路对疾病的形成以及发展存在影响。前10位KEGG通路富集分析结果见图5。

图5 关键靶点的KEGG富集分析Fig 5 KEGG pathway enrichment analyses

表3 珠子参地上部分防治脂肪肝相关信号通路Tab 3 Signal pathways related to the prevention and treatment of fatty liver by APRPM
2.6 分子对接验证
使用分子对接模拟软件Autodock_vina,将PPI网络中度值排名靠前的靶点蛋白PTGS2、MAPK3、PPARG分别与珠子参地上部分活性成分进行分子对接验证,计算活性成分与受体蛋白间的最低结合能。从PDB数据库筛选的PTGS2受体蛋白PDBID为5F1A;MAPK3受体蛋白PDB-ID为4QTB;PPARG受体蛋白PDB-ID 为6MS7。若结合能<0,表明配体分子均能和受体蛋白能自发地结合,且结合能<-5.0 kcal·mol-1,表明其结合良好,结合能越小,结合性越好。分子对接最低结合能计算结果见表4,活性成分与受体蛋白对接的最低结合能对应的可视化结果见图6。表4的结果表明大部分活性成分与受体蛋白的最低结合能均远小于-5.0 kcal·mol-1,结合图6的分子对接可视化结果,说明PTGS2、MAPK3、PPARG 3个靶点能够与活性成分自发结合并借助氢键等分子间作用力形成较为稳定的构象。

图6 活性成分与3种受体蛋白的分子可视化结果Fig 6 Visualization of molecular docking of active ingredients and 3 receptor proteins
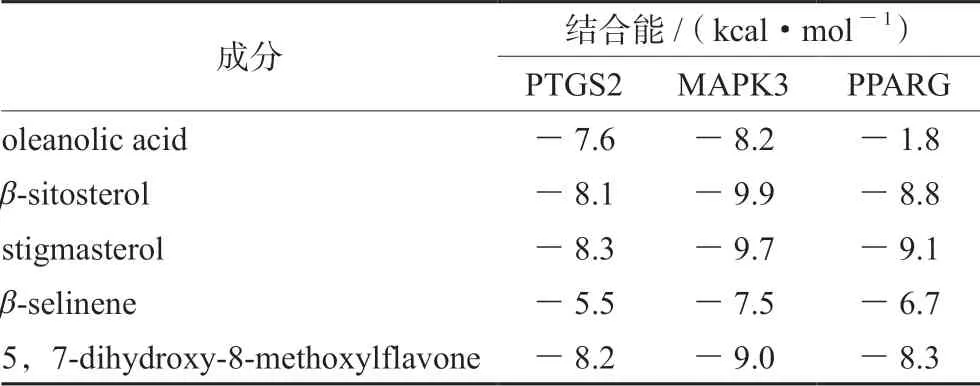
表4 活性成分与受体蛋白的最低结合能Tab 4 Minimum binding energy of active ingredients and receptor proteins
2.7 实验验证
2.7.1 珠子参地上部分提取物对受试小鼠体质量的影响 给药4~5 d后,受试小鼠体质量逐渐下降,给药7 d后,与模型组相比较,高剂量组和低剂组小鼠体质量均明显下降(P<0.01)。7 d后高剂量组与低剂量组肥胖指数均低于正常组,见表5。
表5 给药前后珠子参地上部分提取物对受试小鼠体质量的影响(±s)Tab 5 Effect of extracts from APRPM on the body mass of tested mice before and after the administration (±s)

表5 给药前后珠子参地上部分提取物对受试小鼠体质量的影响(±s)Tab 5 Effect of extracts from APRPM on the body mass of tested mice before and after the administration (±s)
注:与模型组相比较,*P<0.01(Compared with the model group,*P<0.01)。
7 d后肥胖指数正常组 27.25±0.88 29.58±1.69 10.33±0.23 289.24±2.57模型组 31.92±2.18 34.58±2.69 11.03±0.23 295.13±4.19高剂量组 29.8±1.29 29.17±2.07* 10.85±0.11 282.69±5.49低剂量组 28.5±2.92 28.00±3.48* 10.88±0.17 280.21±7.78组别 初始体质量/g 7 d后体质量/g 7 d后体长/cm
2.7.2 珠子参地上部分提取物对受试小鼠血清TG、TC的影响 结果显示,与对照组相比,高剂量组和低剂量组小鼠的TG和TC均有所降低,说明珠子参地上部分提取物能够有效降低肥胖小鼠的TG和TC(见表6)。
表6 给药后的TG、TC水平 (±s)Tab 6 Level of TG and TC after the administration (±s)

表6 给药后的TG、TC水平 (±s)Tab 6 Level of TG and TC after the administration (±s)
注:与模型组相比较,*P<0.01(Compared with the model group,*P<0.01)。
组别 TG/(mmol·L-1) TC/(mmol·L-1)正常组 2.58±0.24 1.71±0.27模型组 2.74±0.31 1.67±0.35高剂量组 2.04±0.56* 1.51±0.39*低剂量组 2.13±0.40* 1.49±0.32*
2.7.3 珠子参地上部分提取物对肝脏组织的影响
正常组的肝细胞结构完整,脂肪滴极少,颜色浅;模型组脂肪滴数量明显增多,颜色深,细胞界限较模糊;高剂量和低剂量组脂肪滴数量明显少于模型组,高剂量组颜色与正常组接近,低剂量组颜色略高于正常组,结果见图7。
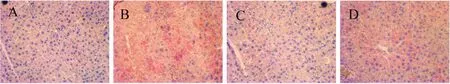
图7 油红O染色观察各组小鼠肝脏病理变化(200×)Fig 7 Hepatic pathological change of mice by oil red O staining in each group(200×)
2.7.4 珠子参地上部分提取物对肝脏组织中PTGS2、MAPK3、PPARG蛋白的影响 小鼠肝脏的免疫组化切片及光密度测定结果见图8和图9。结果显示,与模型组比较,珠子参地上部分水提物显著降低了小鼠的肝脏组织中PTGS2的表达,升高了MAPK3、PPARG蛋白的表达(P<0.05,P<0.01)。

图8 各组小鼠肝脏组织中PTGS2、MAPK3、PPARG的蛋白表达(200×)Fig 8 Expression of PTGS2,MAPK3 and PPARG in the liver of mice in each group(200×)

图9 珠子参地上部分对小鼠肝脏组织中PTGS2、MAPK3、PPARG蛋白表达的影响(n=6)Fig 9 Effect of APRPM on protein expression of PTGS2,MAPK3 and PPARG in liver tissue of mice(n=6)
3 讨论
本研究通过网络药理学方法结合分子对接,最终筛选出珠子参地上部分的活性成分5个,靶点175个;脂肪肝相关的疾病靶点1481个;构建的关键作用靶点的PPI网络,其中包含节点84个,边513条;分子对接结果显示PTGS2、MAPK3、PPARG 3个核心靶点能够与活性成分结合并借助氢键等分子间作用力形成较为稳定的构象。
在GO 功能和KEGG 通路富集分析结果中,珠子参地上部分防治脂肪肝的作用机制与类固醇代谢过程、脂肪酸代谢过程、不饱和脂肪酸代谢过程、脂肪酸衍生物代谢过程等生物学功能与过程有关以及和PPAR信号通路、非酒精性脂肪肝通路、细胞色素P450对外源生物的代谢通路、脂肪消化吸收通路等相关。
PTGS2、MAPK3、PPARG是PPI 网络中按度值排名靠前的关键靶蛋白。PTGS2是前列腺素(PG)合成的关键酶,它在多种细胞和组织的炎症过程及增殖中发挥重要作用[14]。PTGS2及其合成产物可以对脂肪、糖类、蛋白质的代谢产生作用,干扰肝脏正常的脂代谢,导致TC的蓄积[15]。脂质代谢紊乱会引发高脂血症,最终导致脂肪肝、动脉粥样硬化等疾病。免疫组化实验说明珠子参地上部分能够抑制PTGS2的表达,降低小鼠血清中TG和TC的含量,说明珠子参地上部分有一定调节脂质代谢的作用。MAPK3、MAPK8、MAPK1 均属于MAPK(丝裂原蛋白活化激酶)家族。MAPK 可被上游激酶活化并磷酸化,从而活化下游因子,发挥调节细胞增殖、分化及死亡的作用[16]。PPAR是调节各种生化反应的配体激活型转录因子,有PPARA、PPARB、PPARG 3种亚型。研究证明,PPAR参与过氧化物酶体和脂质生长等过程,控制并调节参与糖及脂质代谢相关基因的表达、体内动态平衡以及脂肪形成等[17]。脂肪组织会分泌一些与脂肪移动有关的激素和细胞因子,而PPARG对脂肪细胞的增生和分化起着重要作用,PPARG被其配体激活后,能促进脂肪细胞分化,并能抑制这些细胞因子的表达和活性[18]。由于脂肪细胞主要存在于白色脂肪中,营养丰富时以TC的形式储存能量,营养缺乏时以脂肪酸形式释放能量,脂肪细胞的过度增生和分化可造成脂肪细胞生成过多,而PPARG的激活增加了脂肪酸的摄取,对脂肪细胞的分化起正向调节作用,抑制PPARG能阻断脂肪细胞分化效应[19]。本研究中高剂量组和低剂量组TG和TC与模型组相比较均有所降低,说明珠子参地上部分水提物能够影响脂肪细胞分化,明显降低脂肪组织摄取脂肪酸。同时,利用Autodock_vina 对PTGS2、MAPK3、PPARG 3个靶点与活性成分进行分子对接验证,结果显示上述两个靶点的受体蛋白均能与核心活性成分较稳定地自发结合。由此可以推测,珠子参地上部分可能通过活性成分作用于PTGS2、MAPK3、PPARG受体达到防治脂肪肝的效果。
免疫组化实验结果显示,与模型组比较,珠子参地上部分水提物显著降低了小鼠的肝脏组织中PTGS2的表达,升高了MAPK3、PPARG蛋白的表达,说明珠子参地上部分能够抑制肝脏组织中PTGS2受体蛋白的表达,增强MAPK3、PPARG受体蛋白的表达,证实其通过对PTGS2、MAPK3、PPARG 3个核心靶点的基因及蛋白的直接作用,发挥药理作用,同时也印证了分子对接结果的合理性。
综上所述,本研究应用网络药理学、分子对接的研究方法,对珠子参地上部分防治脂肪肝的作用机制进行了系统分析和讨论,并通过实验验证为研究其机制提供了部分依据,但围绕珠子参地上部分防治脂肪肝的靶点、通路的验证实验仍需进一步展开。

