人脑胶质瘤大鼠移植模型的初步建立
谭邓旭,吴朋朋,赵 勇,师长宏,葛 煦
(空军军医大学实验动物中心,西安 710032)
胶质瘤是最常见的恶性脑肿瘤,占恶性原发性中枢神经系统肿瘤的80%[1-2]。其中,预后最差的是多形性成胶质细胞瘤,患者中位生存时间为14.6个月,只有26.5%的患者存活持续2年[3]。神经胶质瘤具有极强的浸润性,这不可避免地导致手术切除肿瘤不完全,迫切需要更有效的肿瘤特异性疗法[4]。
建立有效、稳定的脑胶质瘤动物模型对人脑胶质瘤治疗研究具有重要意义。比如,通过异种移植模型,可以从少量可能导致肿瘤复发的干细胞中获得重要的耐药性信息。建立肿瘤移植模型的方法通常是采用小鼠或者大鼠来源的细胞系进行原位移植,或者选取裸小鼠移植人的肿瘤细胞[5-7]。前者的鼠源性肿瘤细胞系与人体存在很大差别;后者的裸小鼠体型较小,并且生存期短,在建立模型后进行肿瘤干预性治疗的窗口期短,动物实验操作和饲养要求严格。已知大鼠相较于裸小鼠,具有先天性的体质优势及较长的生存周期,这在肿瘤干预性治疗中优势明显。因此,利用免疫抑制剂建立人源性肿瘤细胞系大鼠异种原位移植模型,操作方便,饲养简单[8]。本研究通过使用不同免疫抑制剂探索人脑胶质瘤大鼠移植模型的建模条件和评估方法,以期为人胶质瘤研究提供良好的实验工具。
1 材料与方法
1.1 实验动物
5~6周龄SPF级雄性SD大鼠20只,体质量为40~60 g,购自中国人民解放军空军军医大学教研保障中心实验动物室[SCXK(陕)2019-001],动物质量检测符合国家SPF级标准(编号为SXLA-2020第11号)。本研究通过空军军医大学动物伦理委员会审核,伦理审查编号为IACUC-20200602。实验动物饲养于空军军医大学屏障设施[SYXK(陕)2019-001]。环境温度为23~25 ℃,相对湿度为40%,12 h/12 h昼夜交替,饮用水经高压灭菌处理,动物自由摄食和饮水。
1.2 主要试剂和设备
Caliper LuminaⅡ小动物活体光学成像系统购自美国Caliper公司。细胞培养液和CO2培养箱购自美国Thermo Fisher Scientific公司。脑立体定位仪、异氟烷麻醉剂和微型手持电钻购自深圳市瑞沃德生命科技有限公司。环孢霉素A购自北京索莱宝科技有限公司。雷帕霉素购自美国MCE(MedChemExpress)公司。胎牛血清购自浙江天杭生物科技股份有限公司。苏木精和伊红染色液均购自北京雷根生物技术有限公司。小鼠抗人Mitochondria单克隆抗体(仅与人源细胞线粒体的非糖基化蛋白发生反应,工作液稀释比例为1∶1 000)购自英国 Abcam 公司;相应二抗为生物素标记的山羊抗小鼠IgG,购自北京中杉金桥生物科技有限公司。DAB显色试剂盒和小鼠SP免疫组织化学检测试剂盒购自北京中杉金桥生物科技有限公司。肿瘤靶向性近红外荧光染料DZ-1由北京泛博生物化学有限公司合成[9]。
1.3 人胶质瘤 U87-MG细胞培养
人恶性脑胶质瘤U87-MG 细胞购自美国模式培养物保藏中心,由本实验室保存。U87-MG 细胞培养在37 ℃、5%CO2的加湿培养箱中,培养液为含10%胎牛血清的RPMI 1640,其中加入100 U/mL青霉素和100 µg/mL链霉素。收集对数生长期肿瘤细胞,经胰蛋白酶/EDTA联合消化后,用PBS重悬备用。
1.4 大鼠胶质瘤模型的构建
将SD大鼠随机分为4组,每组5只,分别为雷帕霉素单药组(Rapa)、环孢霉素A单药组(CsA)、雷帕霉素和环孢霉素A联合用药组(Rapa+CsA),以及空白对照组(Control)。将雷帕霉素和环孢霉素A溶于0.2%羧甲基纤维素和0.25%Tween-80混合溶剂中,其工作液质量浓度分别为2 mg/mL和5 mg/mL。Control组用0.2%羧甲基纤维素和0.25%Tween-80混合溶剂培养细胞。手术前3 d,连续口服给药对大鼠进行预处理,Rapa组用药剂量为4 mg·kg-1·d-1,CsA组用药剂量为10 mg·kg-1·d-1,Rapa+CsA组用药剂量分别为4 mg·kg-1·d-1雷帕霉素联合10 mg·kg-1·d-1环孢霉素A,Control组用溶剂作对照。各实验组持续给药,每天1次,直至实验结束。大鼠吸入异氟烷麻醉后,用脑立体定位仪固定,手术部位备皮,消毒,切开暴露前卤,用手持微型钻于中线右2 mm、冠状缝后1 mm处钻孔。用1 mL注射器吸取备好的肿瘤细胞,进针2 mm,退针0.5 mm,缓慢注射 20 µL(约4×106个细胞)的U87-MG 细胞液。停针保持5 min后缓慢撤针,骨蜡封闭骨孔,缝合切口。同时,于大鼠右侧背部皮下注射200 µL(约1×107个细胞)的U87-MG细胞液,用于反映免疫抑制剂的直接效果,间接判断原位脑胶质瘤的生长情况。
1.5 大鼠体质量和皮下肿瘤体积的变化
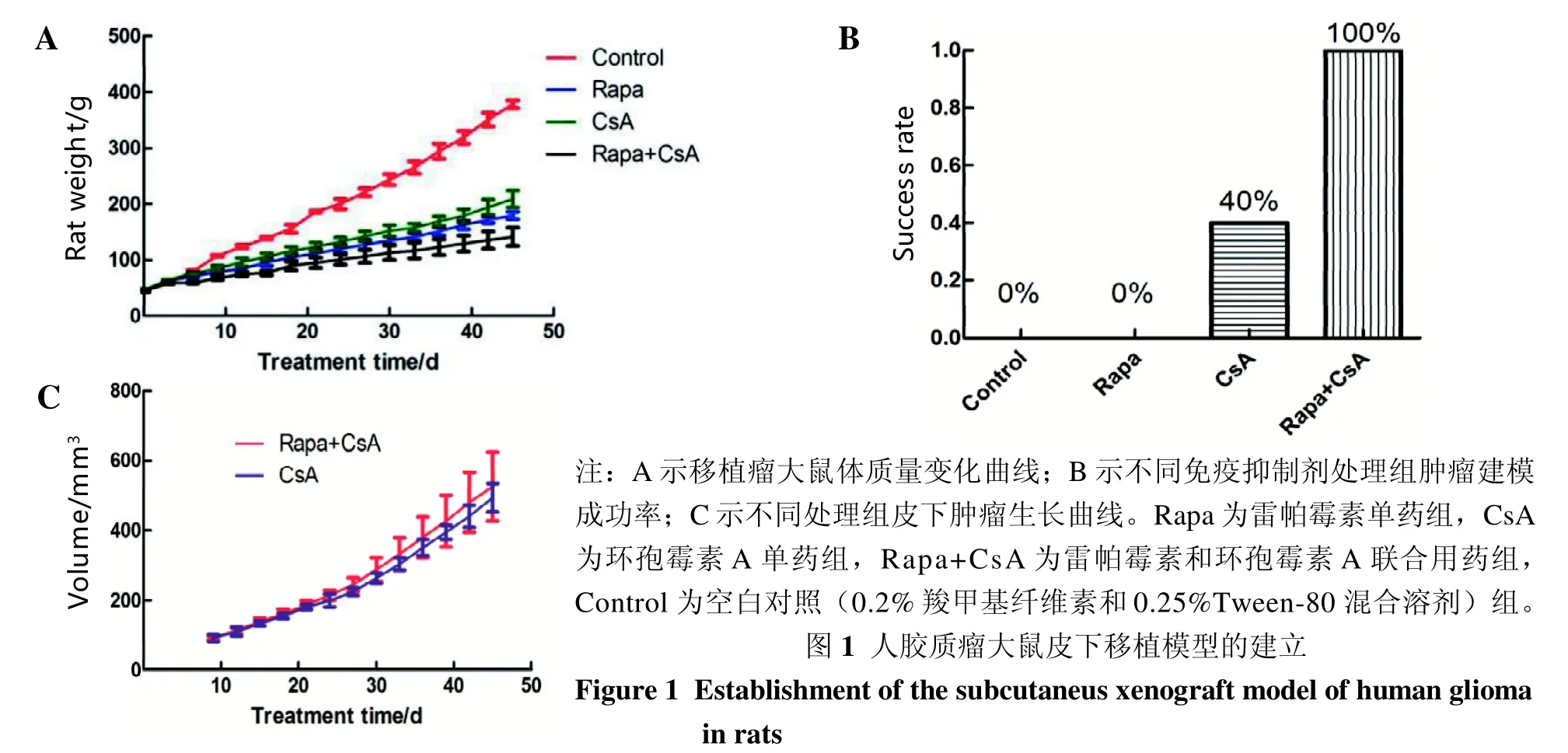
自开始给药,每周3次持续测量大鼠体质量,检测抑制剂对大鼠体质量增长的影响,绘制体质量变化曲线,间接反映免疫抑制剂的作用。待皮下肿瘤生长至80~100 mm3,用游标卡尺测量肿瘤的长(L)和宽(W),计算肿瘤体积V=1/2×L×W2。绘制肿瘤生长曲线,直观反映抑制剂效果 。
1.6 近红外荧光活体成像检测原位肿瘤生长
基于实验室前期研究基础,近红外荧光染料DZ-1具有很强的肿瘤靶向性,借助活体成像设备检测大鼠脑胶质瘤的成瘤情况。当皮下肿瘤长至600 mm3时腹腔注射0.1 µmol 近红外荧光染料DZ-1,24 h后选择激发波长745 nm、发射波长845 nm的条件自动曝光,进行近红外荧光活体成像。观察染料分布情况,以反映肿瘤生长状况。
1.7 肿瘤组织HE染色和线粒体免疫组织化学分析
建模结束后,用CO2对大鼠施行安死术,取皮下肿瘤和大脑组织,用4%多聚甲醛溶液固定24 h,石蜡包埋后取最大横截面多部位切片。二甲苯脱蜡后再依次进行梯度乙醇溶液脱水,苏木精对比染色,盐酸乙醇分化。然后进行伊红染色,脱水后二甲苯透明,封固,光学显微镜下观察HE染色结果。
切片脱蜡水化后,去除内源性过氧化物酶,山羊血清封闭。滴加1∶1 000稀释的Mitochondria单克隆抗体,4℃反应过夜。PBS冲洗后,再滴加生物素标记的山羊抗小鼠IgG工作液,37 ℃反应30 min。滴加适量的辣根过氧化物酶标记的链霉卵白素工作液,37 ℃反应30 min。显色剂显色后,冲洗脱水,封固,光学显微镜下进行观察。
1.8 统计学方法
采用SPSS 22.0统计学软件进行统计分析。所有实验结果数据以±s表示。多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠体质量变化及皮下肿瘤生长情况
联合用药的Rapa+CsA组大鼠体质量较其他3组明显最轻,差异有统计学意义(P<0.01,图1A);Rapa组和CsA组大鼠体质量较对照组增加缓慢,差异有统计学意义(P<0.01);其中Rapa组较CsA组大鼠体质量更轻,差异有统计学意义(P<0.01)。皮下移植肿瘤细胞的对照组和Rapa组大鼠均未出现肿瘤生长(图1B);而CsA组的5只大鼠中有2只出现皮下肿瘤生长,并且与联合用药组的肿瘤生长速度相比无明显差异(P=0.748,图1C);Rapa+CsA组5只大鼠皮下均见肿瘤生长。
2.2 大鼠脑部近红外荧光活体成像表现
待皮下肿瘤明显生长后,进行近红外荧光活体成像(图2A和D),结果显示:对照组和Rapa组大鼠皮下和脑部均无荧光富集,而CsA组有2只大鼠的脑部荧光富集,联合用药组则有5只大鼠均有脑部荧光富集。处死大鼠后取脑组织,进行离体组织成像的结果(图2B~C)显示:在大鼠脑部同样出现明显的荧光信号富集,但是肉眼观无明显的实质化肿瘤或脑组织局部凸起。
2.3 肿瘤组织的形态特征和人线粒体非糖基化蛋白的表达
为确定大鼠脑胶质瘤原位移植是否成功,切取荧光富集区域的脑组织固定并取最大横截面切片,进行HE染色以筛查肿瘤生长情况,同时观察脑组织病理形态。结果显示,CsA组2只和Rapa组5只大鼠的脑组织中均有肿瘤浸润生长(图3A)。对筛查出有肿瘤细胞的大鼠脑组织切片用具有种属特异性的人线粒体Mitochondria抗体进行免疫组织化学染色,结果发现肿瘤部位表现强阳性,而大鼠脑组织部位呈现阴性(图3B);结合HE染色结果,证实了用人源化肿瘤细胞进行大鼠异种原位移植模型建立成功。同时对皮下肿瘤进行HE染色,发现组织病理形态为比较典型的胶质瘤形态(图3C),并与脑胶质瘤原位移植瘤形态一致。
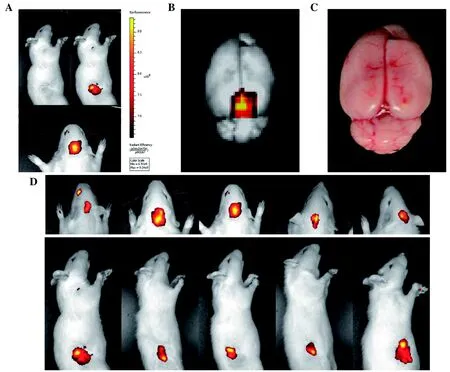
图 2 近红外荧光活体成像检测人胶质瘤大鼠移植模型Figure 2 Detection of human glioma xenograft formation in rats by near-infrared fluorescence optical imaging
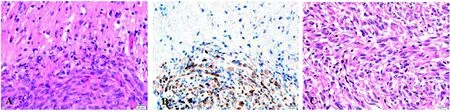
图 3 人胶质瘤大鼠移植瘤的病理检测结果(×400)Figure 3 Pathological results of xenograft tumors in rats (×400)
3 讨论
使用免疫抑制剂处理SD大鼠,创建人源性细胞系异种原位移植模型,目前在国内外报道较少。与传统使用鼠源细胞系C6等建立大鼠脑胶质瘤原位模型[5,7]相比,人源性细胞系异种原位移植模型避免了种属差异造成的缺陷。另外,相较于免疫缺陷小鼠,如裸小鼠和NSG小鼠(Rag2和IL-2 rg双基因敲除的NOD-SCID小鼠)等,用免疫抑制剂构建的SD大鼠胶质瘤模型的优势主要表现在大鼠体型较大、手术易操作、建模后进行肿瘤干预性治疗的窗口期长;但该模型最大的障碍在于SD大鼠具有正常的免疫系统,对人源细胞系有免疫排斥和杀伤作用。本研究通过选择不同类型的免疫抑制剂有效降低了大鼠体内免疫应答水平,成功实现人源性细胞系的异种移植。
目前临床应用的免疫抑制剂基本可以分为五大类[10],包括钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)、哺乳动物雷帕霉素靶蛋白抑制剂、抗代谢类药物、糖皮质激素和抗淋巴细胞抗体。临床研究表明,有97%的肝移植患者在出院后使用CNI维持免疫治疗[11];哺乳动物雷帕霉素靶蛋白抑制剂是毒性较小的新型强效免疫抑制剂;使用抗代谢药物的排斥反应发生率较高[12];长期使用糖皮质激素容易引发不良反应;抗淋巴细胞抗体虽然可以降低早期急性排斥反应的发生风险,但增加了真菌、EB(Epstein-Barr)病毒、BK多瘤病毒和巨细胞病毒(cytomegalovirus,CMV)感染风险[13]。环孢霉素A(CNI代表药物之一)和雷帕霉素多用于器官移植和自身免疫疾病治疗[14-15]。环孢霉素A主要是通过选择性抑制T淋巴细胞活化而发挥免疫抑制作用[16],具体是:抑制淋巴细胞在抗原或者分裂原刺激下的分化和增殖,阻断淋巴细胞生长周期,使其停滞在G0或者G1期,导致白细胞介素-2(interleukin-2,IL-2)分泌受到抑制;同时通过抑制T淋巴细胞和促炎因子,影响巨噬细胞产生和释放IL-1,进而达到免疫抑制的效果。雷帕霉素与细胞内FK结合蛋白-12(FK binding protein-12,FKBP-12)结合后,阻断T淋巴细胞从G1期至S期的进程,在转录水平抑制蛋白合成[17]。雷帕霉素也可以抑制外源性细胞因子(如IL-2、IL-4、IL-5),激发T淋巴细胞的活化、增殖和B淋巴细胞产生抗体,从而达到免疫水平的抑制。
临床研究和临床用药均发现,环孢霉素A和雷帕霉素联合使用能发挥更好的免疫抑制效果[16,18]。基于此,本实验设计雷帕霉素和环孢霉素A单药以及联合用药进行大鼠免疫抑制,同时进行人源化细胞系移植,寻找稳定、可靠的建模方法。结果表明,联合用药组大鼠的体质量增长最慢,肿瘤移植成功率达到100%,单药CsA组成功率达到40%,其余两组成功率均为0%。但是肿瘤在经过45 d的生长后,联合组最大肿瘤体积仅624 mm3,属于生长缓慢且没有出现指数增长的趋势,可能与免疫排斥有关。肿瘤的生长与整个免疫环境有关,包括T细胞、B细胞和自然杀伤(natural killer,NK)细胞等。从作用机制来看,环孢霉素A是通过选择性抑制T淋巴细胞活化发挥免疫抑制作用;雷帕霉素除了抑制T细胞外,还可以抑制B淋巴细胞产生抗体,达到免疫抑制的效果。联合用药在T细胞和B细胞水平进行了免疫抑制,而环孢霉素A仅仅在T细胞水平进行免疫抑制,这可能是出现这一现象的主要原因。
鉴于原位肿瘤不易监测的特殊性,本研究对移植大鼠注射肿瘤靶向性近红外荧光染料DZ-1,通过活体成像技术监测脑内移植肿瘤的生长情况。发现脑部有很强的荧光富集后,进一步将荧光部位的瘤组织样本进行HE染色,确认其为胶质瘤。最后利用具有种属特异性的人线粒体Mitochondria抗体进行免疫组织化学染色,明确了肿瘤的人源性。结合活体成像结果以及病理和免疫组织化学染色结果,本研究确认了人源化肿瘤异种原位移植模型建立成功。
虽然免疫缺陷小鼠被广泛使用,但真正用于研究的体型较大的免疫缺陷动物种类较少。利用免疫抑制剂对较大动物免疫系统进行抑制,从而建立体型较大动物肿瘤异种移植模型是一种新的尝试。本研究使用不同免疫抑制剂成功建立的大鼠脑胶质瘤原位模型,将为后续开展较大体型动物肿瘤异种移植研究奠定了良好的实验基础。
——雷帕霉素

