苦参素对实验性自身免疫性甲状腺炎大鼠Th1/Th2细胞平衡及相关通路的影响
姚 婷,高 原,曾芳馨
(1. 成都医学院第二附属医院·核工业四一六医院内分泌科,成都 610051;2. 达州市中西医结合医院内分泌风湿免疫科,达州 635000)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT),又称为桥本甲状腺炎(Hashimoto’s thyroiditis,HT)[1],是临床上常见的器官特异性自身免疫性疾病。目前,临床上广泛采用免疫抑制剂、糖皮质激素等药物进行治疗,上述药物虽能有效缓解患者症状,但会严重损伤机体的免疫能力[2]。单核细胞趋化蛋白-1/细胞表面趋化因子受体2 (monocyte chemoattractant protein-1/cell surface chemokine receptor 2,MCP-1/CCR2)信号通路是趋化因子β和CC家族的重要成员,可影响T细胞在体内的分化,而AIT的发生与T细胞特别是辅助性T淋巴细胞(helper T lymphocytes,Th)1/Th2型细胞因子的表达有关,因此MCP-1/CCR2信号通路影响着AIT的发生和发展[3]。
苦参素(matrine)是从传统药材苦参(学名:Sophora flavescens)的根中提取的生物碱,对类风湿性关节炎、系统性红斑狼疮、多发性硬化症等多种自身免疫性疾病的自身免疫反应过程具有抑制作用[4]。近年来研究表明,苦参素能降低甲状腺自身抗体,抑制甲状腺自身免疫反应,因而能对AIT发挥一定疗效[5],然而尚不完全清楚其作用机制。因此,本实验通过建立与AIT具有相同病理特征的实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)大鼠模型[5],探讨苦参素对EAT大鼠甲状腺功能及MCP-1/CCR2信号通路的影响,初步阐述苦参素对EAT可能的作用机制,进而为临床应用苦参素早期干预AIT提供可靠的理论基础。
1 材料与方法
1.1 实验动物和主要试剂
6~8周龄SPF级雄性Lewis大鼠75只,购自四川大学实验动物中心[SCXK(川)2018-026],在环境温度为(25±2)℃,相对湿度(50±10)%,12 h 循环光照设施[SYXK(川)2018-185]中适应性饲养1周,自由饮食。苦参素注射液(批号: 150422304),0.3 g/mL,购自江苏正大天晴药业有限公司,以生理盐水(即0.9% NaCl溶液)稀释。猪甲状腺球蛋白(porcine thyroglobulin,pTG)、不完全弗氏佐剂(Freund’s incomplete adjuvant,FIA)、完全弗氏佐剂(completeFreund’s adjuvant,CFA)均购自美国Sigma公司。促甲状腺激素(thyroid stimulating hormone,TSH)、抗甲状腺球蛋白抗体(antithyroglobulin antibody,TGAb)和甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)检测试剂盒均购自美国MP Biomedicals公司。干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-12(interleukin-12,IL-12)、IL-4和IL-10检测试剂盒均购自上海酶联生物公司。MCP1抗体(ab3827)、CCR2抗体(ab34968)、核因子-κB亚基p65(nuclear facter-κB, subunit p65,NF-κBp65)抗体(ab194856),以及辣根过氧物酶标记的山羊抗兔IgGH&L(ab4091384)和GAPDH抗体-Loading Control(ab33998)均购自英国Abcam 公司。
1.2 动物模型建立[6]
用pH7.0的磷酸盐缓冲液(PBS)将pTG配制成2 mg/L的溶液,将该溶液与CFA等量混合充分乳化制成油包水乳剂,以0.8 mg/只的剂量,采取背部、腹部多点皮下注射对大鼠进行初次免疫。2周和4周后取等体积FIA与pTG溶液进行乳化,采取与首次免疫相同的剂量和方式注射,构建EAT大鼠模型。造模后大鼠TGAb和TPOAb均明显升高,说明造模成功。本实验经成都医学院第二附属医院实验动物福利伦理委员会批准(IACUC-2019-082)。
1.3 动物分组及干预方法
将大鼠按照随机数字表法分为对照组、模型组和苦参素低剂量组、中剂量组及高剂量组5组,每组15只。对照组在建立EAT大鼠模型免疫时给予等体积的PBS与CFA;低、中、高剂量组每只大鼠分别灌胃0.2、0.4、0.6 g/kg的苦参素,灌胃体积2 mL;对照组和模型组均给予等体积的生理盐水,隔日1次,共4周。造模过程中,模型组大鼠死亡3只,苦参素低剂量组死亡1只,苦参素中、高剂量组大鼠各死亡2只,最终各组大鼠均取12只用于后续实验。实验结束时各组大鼠心脏采血,离心收集血清,-80 ℃冰箱保存备用,采用体积分数为2%的戊巴比妥钠麻醉各组大鼠[2],取甲状腺组织,并置于体积分数为10%的中性甲醛溶液中固定。
1.4 甲状腺组织病理形态学检测
将固定保存的各组大鼠甲状腺组织依次进行脱水,常规石蜡包埋,切成5 µm的切片,HE染色,封固后光学显微镜下观察。
1.5 ELISA法检测甲状腺功能、血清自身抗体和血清细胞因子
血清中TSH、TGAb、TPOAb以及IFN-γ、IL-12、IL-4、IL-10水平,均采用相应ELISA试剂盒,参照试剂盒说明书进行测定。
1.6 免疫组织化学法检测甲状腺组织中NF-κBp65的表达
取出经10%甲醛溶液固定的甲状腺组织,经过脱水、透明、石蜡包埋、切片后,常规脱蜡,水化,高压修复,然后经一抗4 ℃过夜孵育,加稀释好的二抗,室温孵育30 min,PBS洗涤。加适量DAB孵育5 min,苏木精对比染色5 min,无菌水冲洗后,依次用不同浓度的梯度乙醇溶液脱水2h,经二甲苯透明,中性树胶封固。
每张切片随机选取5个高倍镜视野(×200),在光镜下连续观察10个视野,每个视野内计数200个细胞中的阳性细胞数,根据染色强度和阳性细胞率综合评分。
1.7 蛋白质印迹法检测甲状腺组织中MCP-1、CCR2蛋白表达
采用美国Invent公司的动物细胞/组织总蛋白提取试剂盒收集甲状腺组织中总蛋白,用BCA蛋白定量试剂盒测定蛋白含量。制备蛋白样品,并进行SDS-PAGE,电泳结束后,转移至PVDF膜,并用含有体积分数5%的BSA的封闭液室温封闭2 h。加入适当稀释比例的MCP-1和CCR2一抗,于4℃反应过夜。次日用缓冲液清洗PVDF膜3次,加入二抗,室温孵育1 h后,加入显色液,曝光显影。
1.8 统计学方法
采用SPSS 19.0软件对数据进行统计分析,计量资料采用±s表示,单因素方差分析用于多组间比较,独立t检验用于两组间比较;甲状腺功能和抗体、细胞因子的关系采用逐步线性回归分析;使用GraphPad Prism 5软件制图,P<0.05为差异有统计学意义。
2 结果
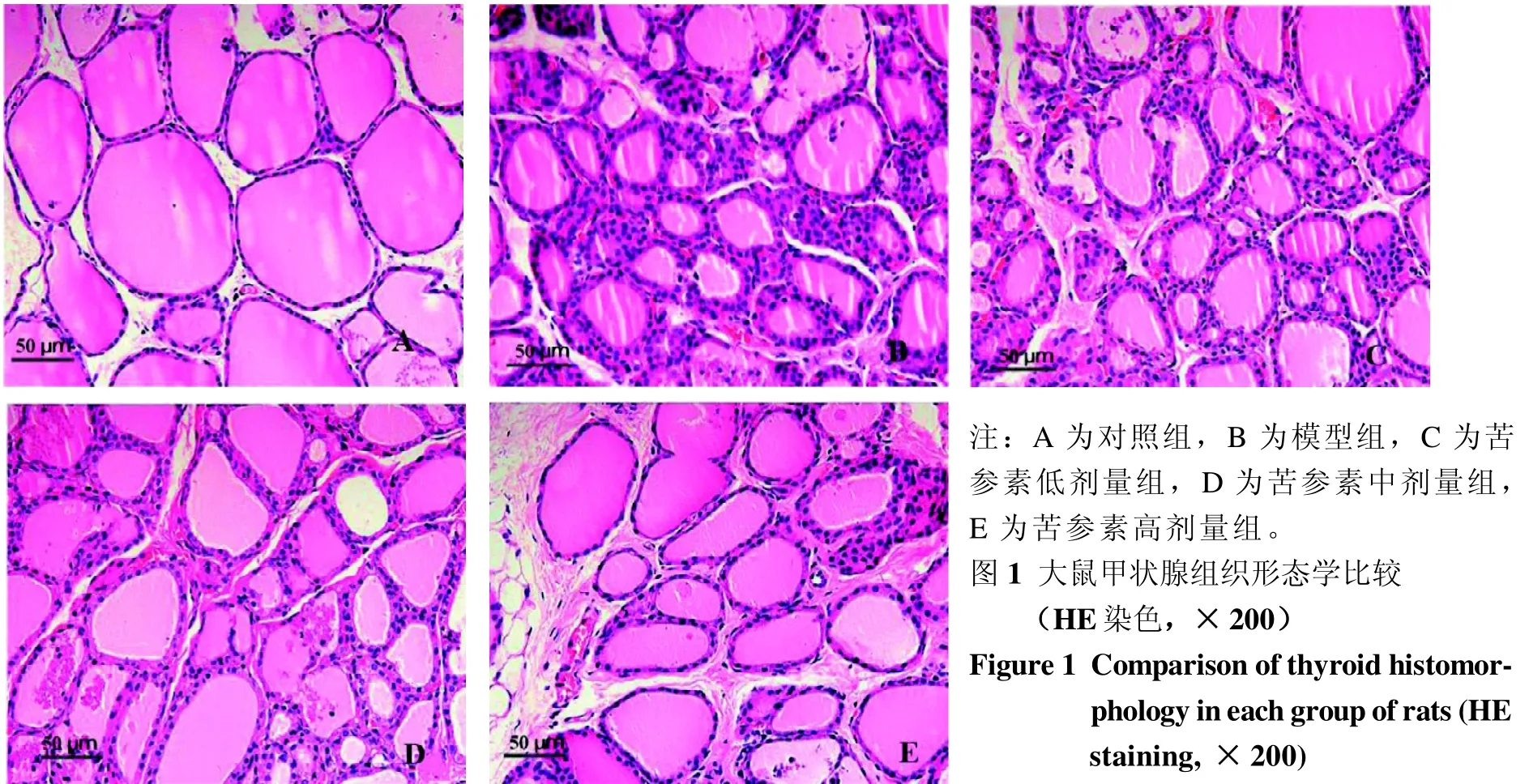
2.1 各组大鼠甲状腺组织形态学比较
对照组大鼠有完整的甲状腺结构,甲状腺滤泡分布均匀,呈椭圆形或圆形的小叶状排列,发育成熟,淡红色胶质均匀分布于滤泡腔内,少量血管分布于滤泡周围间质中,未见纤维组织增生(图1A)。模型组甲状腺滤泡结构遭到不同程度破坏,部分滤泡萎缩甚至消失,滤泡腔内胶质稀少,间质伴灶性淋巴细胞浸润以及水肿,纤维组织增生(图1B)。低、中、高剂量组甲状腺滤泡结构较完整,滤泡大小较一致,上皮细胞排列趋于规则,间质少量炎性细胞浸润,水肿减轻,且呈剂量依赖性(图1C、D、E)。
2.2 甲状腺功能和血清自身抗体水平
与对照组相比,模型组中TSH、TGAb、TPOAb水平均明显升高(P<0.05);与模型组相比,低、中、高剂量组TSH、TGAb、TPOAb水平均明显降低(P<0.05),且呈剂量依赖性(图2)。
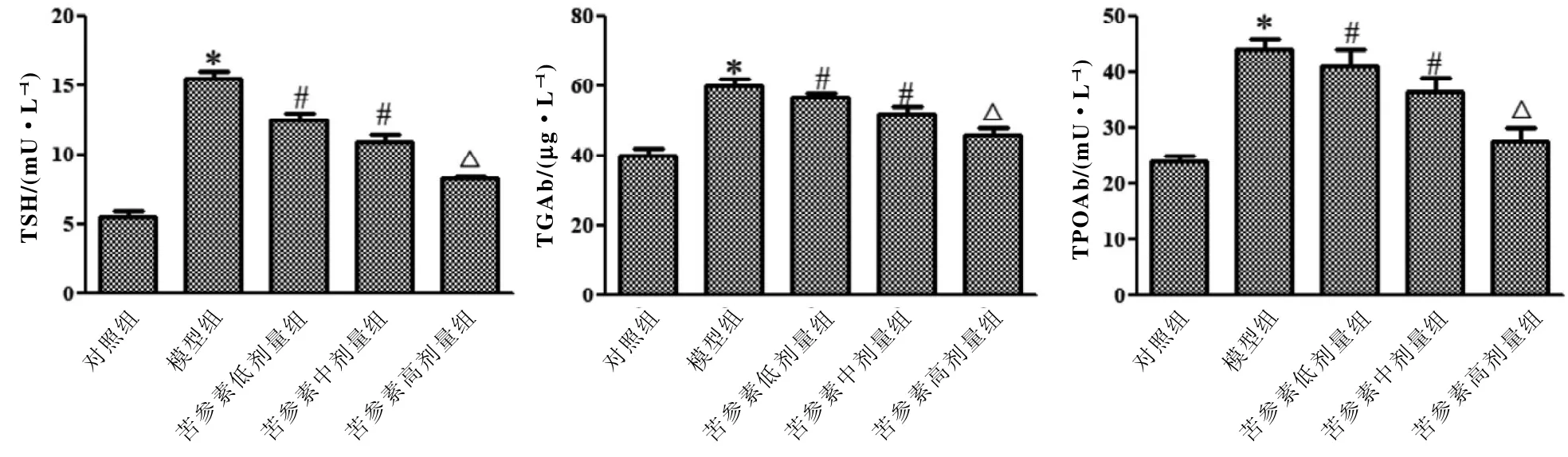
图 2 ELISA检测大鼠甲状腺功能和血清自身抗体水平Figure 2 Thyroid function and serum autoantibody levels detected by ELISA in each group of rats
2.3 血清细胞因子水平
与对照组相比,模型组IFN-γ、IL-12水平及IFN-γ/IL-4、IL-12/IL-10均明显升高(P<0.05),IL-4、IL-10水平均明显降低(P<0.05);与模型组相比,低、中、高剂量组IFN-γ、IL-12水平及IFN-γ/IL-4、IL-12/IL-10均明显降低(P<0.05),IL-4、IL-10水平均明显升高(P<0.05),且呈剂量依赖性(图3)。
2.4 逐步线性回归分析
将TSH作为因变量,甲状腺抗体(TGAb、TPOAb)和细胞因子(IFN-γ、IL-12、IL-4及IL-10)作为自变量。结果显示,抗体和细胞因子均与TSH呈正相关性(r2分别为0.786、0.696、0.875、0.855、0.685、0.596,均P<0.001)。逐步回归方程决定系数(R2)=0.897,F=176.495,P<0.001,方程有统计学意义。其中,TGAb、TPOAb、IL-10与TSH有非常显著性关系,方程TSH=-3.485+0.203TGAb+0.115TPOAb+0.037 IL-10(均P<0.001)。
2.5 甲状腺组织中NF-κBp65蛋白表达
从图4可见,与对照组相比,模型组大鼠甲状腺组织中NF-κBp65蛋白染色强度和阳性细胞率综合评分均明显升高(P<0.05)。与模型组比较,低、中、高剂量组NF-κBp65水平明显下降(P<0.05),且呈剂量依赖性。

图 3 ELISA检测大鼠血清细胞因子水平Figure 3 Serum cytokine levels detected by ELISA in each group of rats
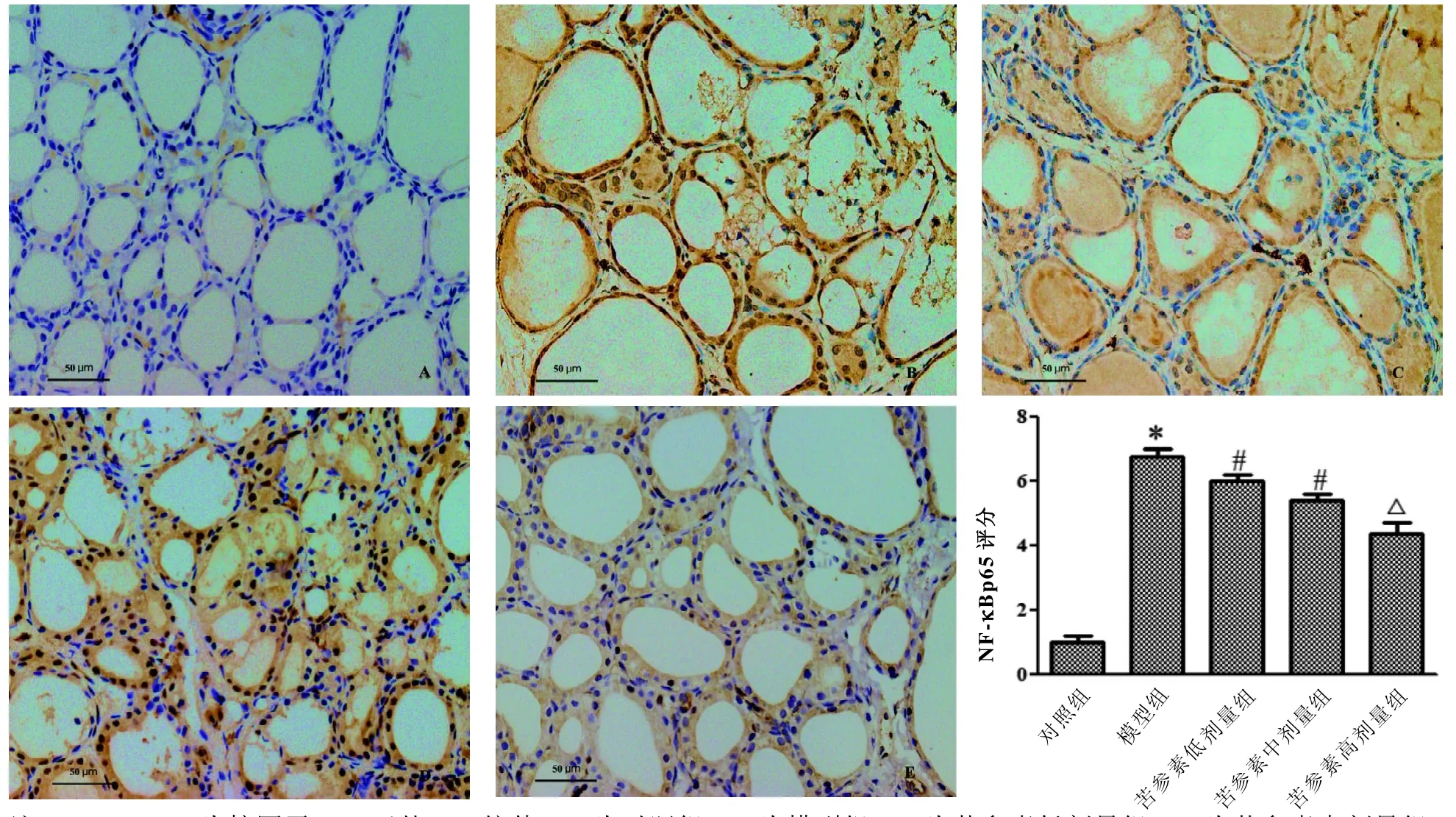
图 4 免疫组织化学法检测大鼠甲状腺组织中NF-κBp65蛋白表达(DAB,×200)及综合评分Figure 4 NF-κBp65 protein expression detected by immunohistochemistry (DAB,×200) in the thyroid tissues of rats in each group
2.6 甲状腺组织中MCP-1、CCR2蛋白水平
从图5可见,与对照组相比,模型组大鼠甲状腺组织中MCP-1和CCR2水平明显升高(P<0.05)。与模型组比较,低、中、高剂量组MCP-1和CCR2水平明显下降,差异均具有统计学意义(P<0.05),且呈剂量依赖性。

图 5 蛋白质印迹法检测各组大鼠甲状腺组织中MCP-1、CCR2蛋白水平Figure 5 MCP-1 and CCR2 protein levels detected by Western blotting in thyroid tissues of rats in each group
3 讨论
AIT是人类较为常见的一种特异性自身免疫性疾病。作为内分泌类疾病,AIT也是造成儿童获得性甲状腺功能减低的重要原因之一,其发病率仅次于甲状腺功能亢进症,在甲状腺疾病中占比为20%左右[7]。AIT发病机制尚不明确,一般认为可能与遗传、环境或T淋巴细胞介导的免疫反应引起甲状腺滤泡的破坏有关[8],而西医临床尚无有效的治疗方案,这也是该病亟需解决的问题。
祖国医学认为,AIT属于“瘿病”范畴,其发病与先天禀赋不足、情志内伤、饮食及水土失宜有关,导致气血运行不畅,气滞、血瘀、痰凝等壅结于颈前而引起病发。中医药在治疗AIT上已经取得一定的效果[9]。苦参属于祛风湿类中药,有祛风除湿、活血化瘀、消肿止痛等功效,具有良好的抗炎、免疫调节、抗菌等活性;苦参素作为苦参提取物,在如系统性红斑狼疮、自身免疫性脑脊髓炎病等自身免疫性疾病的治疗中均取得了满意效果[10-11],但其在AIT的研究中报告较少。目前常将EAT动物模型作为研究AIT的重要工具。本实验通过免疫pTG诱导Lewis大鼠建立EAT动物模型发现,给予苦参素治疗后,大鼠甲状腺组织病理变化改善明显,炎性细胞浸润程度减轻,炎症分级降低,血清中TSH、TGAb和TPOAb水平升高幅度下降,且呈剂量依赖性,证实苦参素可减轻AIT,对EAT模型大鼠发挥一定的保护作用。
Th1和Th2细胞因子在机体处于正常状态下互相调节,以保证细胞免疫和体液免疫维持正常功能[12]。其中Th1通过分泌IFN-γ、IL-12、TNF-α等Th1型细胞因子介导细胞免疫。研究发现,IFN-γ、IL-12作为促炎因子能够诱导B细胞分化、成熟,促进B细胞记忆、抗体分泌[13]。而在EAT中上述炎性因子还可将T细胞募集到炎症部位以使甲状腺滤泡细胞的凋亡加速。Th2细胞通过分泌IL-4、IL-5、IL-6、IL-10等Th2型抗炎细胞因子介导体液免疫,抑制机体的免疫应答[14]。据报告,甲状腺组织浸润的单核细胞和淋巴细胞内均有抗炎细胞因子的表达[15],但其表达水平随EAT免疫病程的进展逐渐下降。研究证实,在实验性自身免疫脑脊髓炎、系统性红斑狼疮等以Th1/Th2类免疫失衡为主的器官特异性自身免疫疾病中,苦参素可增强固有免疫反应,在免疫系统的调节中发挥重要作用[16]。本实验发现,经苦参素治疗后,EAT大鼠IFN-γ/IL-4和IL-12/ IL-10值明显降低,提示苦参素干预可能通过下调Th1型细胞因子IFN-γ、IL-12,上调Th2型细胞因子IL-4、IL-10,恢复Th1/Th2 细胞免疫平衡状态,以减轻AIT。逐步回归分析结果显示,TSH与甲状腺抗体TGAb、TPOAb和细胞因子IFN-γ、IL-12、IL-4及IL-10均呈正相关,说明苦参素可通过调节EAT大鼠的免疫反应保护其甲状腺功能。
研究发现,MCP-1/CCR2信号通路能够趋化巨噬细胞、单核细胞、杀伤T淋巴细胞等多种炎性反应相关的细胞,从而参与免疫调节作用[17]。MCP-1可由成纤维细胞及单核巨噬细胞等间质细胞分泌,对于T淋巴细胞具有较强的趋化作用;而CCR2广泛表达于自然杀伤细胞、内皮细胞等单核细胞上,是G蛋白的偶联受体。文献报告称,MCP-1在AIT患者甲状腺滤泡上皮细胞中明显高于正常水平[18]。另有研究发现,与结节性甲状腺肿患者相比,手术切除的AIT患者甲状腺组织经过免疫组化检测发现CCR2的表达水平明显升高[19]。转录因子NF-κB作为MCP-1/CCR2信号通路下游启动炎性因子的靶因子,正常情况下以NF-κB抑制蛋白激酶复合体的形式存在;在组织损伤诱发炎性反应时,NF-κB在酶的作用下发生解离,导致促炎性因子大量表达[20]。本实验结果显示,经苦参素治疗后,MCP-1、CCR2和NFκBp65蛋白水平明显下降,提示苦参素可通过下调MCP-1/CCR2信号通路及下游NF-κBp65蛋白表达,有效减轻炎性反应细胞的聚集,发挥对EAT的治疗作用。
综上所述,苦参素能抑制甲状腺抗体生成,下调Th1型细胞因子,上调Th2型细胞因子,进而降低Th1/Th2值,并抑制MCP-1/CCR2信号轴,发挥对EAT的保护作用。

