高原多脏器功能障碍综合征蕨麻猪模型C反应蛋白及炎性因子的变化
肖 攀,牛廷献,罗晓红,王红义,郭晓宇,陆 璐,冯小明
(1. 联勤保障部队第九四〇医院基础医学实验室,兰州 730050;2联勤保障部队第九四〇医院内分泌科,兰州 730050)
我国高原地区急性重型高原病并发多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)的发病率较高[1-2]。高原多脏器功能障碍综合征(high altitude multiple organ dysfunction syndrome,H-MODS)在本质上与平原地区发生的MODS没有区别,但是受低氧等高原特殊环境的影响,H-MODS在病程及临床发病特征方面具有一定的高原特异性,使其在临床治疗中显得更为复杂和危险[3]。本课题组前期采用具有高原特性的蕨麻猪成功建立了H-MODS动物模型[4-6],并发现促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮(corticosterone,CORT)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF) 及低氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)在H-MODS模型蕨麻猪的病程发展过程中发生明显变化。本研究在此基础上进一步探讨内毒素脂多糖(lipopolysaccharide,LPS)诱导多脏器损伤后,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)及C反应蛋白(C-reactive protein,CRP)等炎性指标的变化特点,以期了解H-MODS蕨麻猪模型发病过程中机体炎性反应的变化特征。
1 材料与方法
1.1 动物与试剂
高原蕨麻猪24只,雌雄各半,体质量为15 kg左右。所有蕨麻猪按雌雄各半随机分为H-MODS蕨麻猪模型LPS高、中、低剂量组和对照组,每组6只。蕨麻猪为甘南地区散户饲养(符合普通级实验动物要求),检测实验在本实验室[SYXK(军)2017-0046]进行,严格遵照动物实验福利伦理各项要求进行操作。CRP检测用ELISA试剂盒购自英国Abcam公司,IL-1β与TNF-α检测用ELISA试剂盒均购自美国R&D公司。氯胺酮(国药准字:H35020148)购自福建古田药业有限公司,地西泮注射液(国药准字:H12020957)购自天津金耀氨基酸有限公司,LPS(血清型为O127: B8,批号为64H4010)购自美国Sigma公司。
1.2 H-MODS模型建立方法
建模方法参照文献[4-7]。本实验在海拔3 500 m的甘南桑科草原进行,将猪运到实验地点适应性饲养3 d,待动物状态稳定后进行实验。采用氯胺酮(6 mg/kg)联合安定(0.5 mg/kg)肌内注射法进行动物麻醉,同时肌内注射阿托品(0.05mg/kg)。动物麻醉后经耳缘静脉泵入LPS,每组泵入时间均控制在30 min左右,低、中、高剂量组的泵入剂量分别为0.25 mg/kg(B组)、0.35 mg/kg(C组)和0.50 mg/kg(D组),对照组(A组)以等量的生理盐水(即0.9%NaCl溶液)代替。经过前期实验发现,采用LPS高、中、低这3个剂量来诱导蕨麻猪多脏器损伤建立H-MODS模型,都可以引起蕨麻小型猪的生理生化指标发生变化,同时中、高剂量组猪均出现死亡,提示3个剂量的LPS都可以成功建立H-MODS模型。
1.3 MODS的诊断标准
参照胡森等[7]提出的动物发生MODS时各个器官功能障碍分期诊断标准和评分标准,在注射LPS后出现2个或2个以上器官或系统功能障碍时判定为MODS。
1.4 血清采集
3组猪分别于泵入LPS后0 h、3h、6 h、12 h、24 h、48 h和72 h,经颈静脉采血,分离血清,保存于-80℃备用。
1.5 ELISA检测指标
IL-1β、TNF-α与CRP表达水平的检测由本实验室按照ELISA试剂盒说明书操作完成。
1.6 数据处理与统计
采用SPSS 17.0统计分析软件对检测结果进行分析。计量数据以±s表示,各组间差异比较采用单因素方差分析,组内两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 炎性因子TNF-α的变化
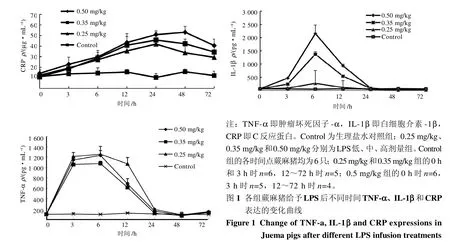
静脉泵入LPS后,B、C、D组TNF-α表达量急剧升高,在6 h时升至最高,之后逐渐下降;在3~12 h时B、C、D组与同组0 h和同时间点A组相比明显升高(P<0.05或P<0.01);24 h时B、D组与同组0 h和同时间点A组相比,均明显升高(P<0.05);72h时B组明显高于A组(P<0.05)。TNF-α表达量情况与走势详见表1和图1。
2.2 炎性因子IL-1β的变化
低、中、高剂量组在注入LPS后,IL-1β表达量均开始上升,并在6 h时达到峰值;在3~12 h时B、C、D组与0 h和A组相比,其表达量均有明显升高(P<0.05或P<0.01);24 h时D组高于0h和A组(P<0.05)。之后各组IL-1β表达量逐渐降低,在48 h、72 h时B、C、D组与0 h和A组相比,均明显降低(P<0.05或P<0.01)。从各剂量组的表达量来看,高剂量组的IL-1β表达水平高于低剂量组。IL-1β表达量情况与走势详见表1和图1。
表 1 各组蕨麻猪给予LPS不同时点的TNF-α、IL-1β和CRP水平比较Table 1 Comparison of TNF-α, IL-1β and CRP levels at different time points in Juema pigs after different LPS infusion treatments( ± s, n=6)

表 1 各组蕨麻猪给予LPS不同时点的TNF-α、IL-1β和CRP水平比较Table 1 Comparison of TNF-α, IL-1β and CRP levels at different time points in Juema pigs after different LPS infusion treatments( ± s, n=6)
注:TNF-a即肿瘤坏死因子-a,IL-1b即白细胞介素-1b,CRP即C反应蛋白。A为对照组,通过耳缘静脉注入等量的生理盐水;B~D分别为低、中、高剂量组,即分别经耳缘静脉泵入0.25mg/kg(B组)、0.35mg/kg(C组)、0.50mg/kg(D组)的脂多糖(LPS)。与对照组相比,*P<0.05,**P<0.01;与0h相比,△P<0.05,△△P<0.01。
组别 0 h 3 h 6 h 12 h 24 h 48 h 7 2 h TNF-α ρ/(pg·mL-1) A B C D IL-1β ρ/(pg·mL-1) A B C D CRP ρ/(µg·mL-1) A B C D 96.52±10.21 100.87±9.95 94.98±10.26 98.93±7.20 101.84±21.10 212.54±78.21**△△1 058.35±99.68**△△1 145.73±65.99**△△ 93.24±9.65 1 255.91±153.41**△△1 076.56±42.89**△△1 233.61±93.60**△△ 118.35±11.36 1 071.01±122.1**△△ 615.30±96.11*△ 681.92±103.46*△ 105.28±10.89 190.61±16.04*△ 117.68±14.40 156.35±17.20*△98.64±12.25 86.12±26.33 69.36±65.67 76.71±19.65 91.68±9.32 147.39±11.70*△128.56±13.34 133.66±32.08 66.25±21.41 60.43±6.49 57.32±4.05 65.71±11.24 59.14±16.32 187.59±16.34*△ 243.33±112.12**△△ 469.26±17.86**△△ 50.28±22.81 271.43±94.95**△△1 373.57±489.92**△△2 155.14±328.30**△△ 65.34±19.64 113.59±22.58*△ 542.14±261.27**△△ 936.43±57.58**△△ 58.23±28.25 42.14±17.17 80.71±52.22 90.48±19.20*△70.17±11.25 21.58±5.57*△△31.42±6.62*△14.28±8.08**△△ 63.58±31.35 22.37±8.35*△ 28.70±8.19*△ 16.43±5.91*△△ 11.23±2.52 12.38±4.51 10.91±2.26 14.23±3.96 13.78±3.45 19.26±3.84 18.48±4.01* 22.77±6.86△ 14.46±4.98 27.02±6.96*△ 28.69±3.56**△ 29.77±6.65*△ 15.49±2.47 35.44±5.21**△ 40.79±8.21*△△ 43.38±8.31**△ 10.33±3.64 41.93±8.11*△ 45.72±7.38**△△ 50.85±3.81**△△15.74±2.58 33.67±7.65*△42.22±4.49*△△53.08±5.50**△△ 12.11±4.14 29.32±4.77*△ 34.36±5.85*△ 40.46±6.35*△
2.3 CRP的变化
静脉泵入LPS后,B、C、D组CRP表达量开始升高,B、C组在24 h时表达量达到最大,D组在48 h时表达量达到最大,之后各组表达量开始逐渐下降;B组6~72 h时CRP表达量与0 h和A组相比,均明显升高(P<0.05或P<0.01);C组6~72 h时CRP表达量与0 h和A组相比均明显升高(P<0.05或P<0.01),其中3 h时CRP表达量与A组相比明显升高(P<0.05);D组6~72 h时CRP表达量与0 h和A组相比明显升高(P<0.05或P<0.01),其中3 h时CRP表达量与0 h相比明显升高(P<0.05)。从各剂量组的表达量来看,高剂量组的CRP表达水平略高于低剂量组。CRP表达情况与走势详见表1和图1。
3 讨论
本研究通过LPS致蕨麻猪多脏器损伤而建立H-MODS模型,并在建立模型时选用高、中、低3个剂量。前期实验结果显示,高、中、低剂量的LPS均可引起蕨麻猪生理生化指标的变化,且中、高剂量LPS可诱导蕨麻猪发生多脏器损伤[5]。目前,IL-1β、TNF-α与CRP已广泛用来反映临床疾病发生时的炎性反应及病程变化程度[8-9],并且这些指标在全身炎性反应及多脏器损伤疾病的诊疗中具有临床指导意义[10-11]。因此,本研究进一步利用蕨麻猪H-MODS模型,对蕨麻猪发生MODS时的炎性因子IL-1β、TNF-α与CRP进行检测,以期探讨H-MODS发生、发展中炎性反应的变化特点。
TNF-α由淋巴细胞和单核巨噬细胞分泌,是典型的促炎性因子,通过对细菌内毒素反应而参与炎性反应[12],导致组织细胞破坏。TNF-α可引起内皮损伤,造成炎性反应发生,同时可激活巨噬细胞和中性粒细胞,增强其吞噬和杀伤性,对相关炎性因子有介导作用,从而引起器官组织的损伤[13]。IL-1是一种前炎性细胞因子,主要通过修饰基因达到对免疫炎性反应的调节作用。IL-1的基因结构与其调节功能密切相关,并且内皮损伤可刺激内皮细胞释放IL-1[14]。研究发现,大鼠MODS模型也会引起TNF-α与IL-1β表达量出现上调[15-16]。本研究中TNF-α与IL-1β在LPS诱导MODS形成后表达量急剧升高,在6h时升至最高,之后逐渐下降。本研究发现,高剂量组蕨麻猪出现死亡;在蕨麻猪形成H-MODS时,其体内出现严重的应激感染状态;随着炎性反应逐渐增强,炎性因子TNF-α与IL-1β的表达也出现不同程度的上调;随后机体进入动态免疫调节阶段,抑制过度炎性反应,维持机体的平衡;在6 h后TNF-α与IL-1β表达水平开始慢慢降低,在72 h时IL-1β表达水平甚至低于对照组和0 h。以上结果提示,机体发生炎性反应后出现免疫应激反应,通过迅速的免疫调节快速下调炎性因子表达。
CRP是由肝细胞分泌的一种非特异性生化标志物的炎性因子,其表达量的增加与机体受到刺激引起的炎性反应关系紧密。同时,CRP作为一种急性反应蛋白能够快速反映出机体的慢性或急性炎症状态[17]。CRP会激活单核细胞,诱导血管内皮细胞功能紊乱,促进其他炎性因子的释放,最终诱导多脏器损伤。当机体受到外界LPS的作用时,多脏器出现不同程度的损伤,炎性反应开始加剧,CRP表达量就会迅速升高。此外,CRP能够诱导氧自由基产生,因此在炎性反应出现时IL-6、TNF-α等炎性因子开始大量释放;并且伴随着炎性反应的加剧,CRP还能够诱导血小板激活,加重心肌组织、肾脏组织微循环障碍[18],使得炎性反应持续加剧。本研究发现,蕨麻猪泵入LPS诱导多脏器出现损伤时,低、高、中剂量组的CRP表达量开始升高,并在6 h时与0 h和对照组相比明显升高;各组均在24~48 h表达量达到最大,在72 h后才缓慢降低。
目前,临床上广泛采用CRP、TNF-α及IL-1等炎性因子来评价患者疾病感染情况以及临床治疗效果,这些炎性因子已经成为临床评价病情及治疗效果的标志之一[19-22]。本研究中蕨麻猪经LPS诱导发生多脏器炎性反应后,其TNF-α及IL-1β表达量在6 h达到最大,之后开始快速降低,到48 h已经接近恢复正常;而CRP在6 h时处于上升期,到48 h才达到顶峰,之后缓慢回落。由此可以看出,在LPS诱导蕨麻猪形成H-MODS时,炎性因子TNF-α及IL-1β在体内表达量迅速上升再下降,相对而言,CRP的表达持续时间长且变化比较缓慢,这可能是因为各个因子的分泌器官及场所不同。因此,在评价HMODS炎性反应的发展变化时,应该对病程随时监测,根据各检测指标的变化来评估炎性反应的程度,以便及时调整治疗方案。临床研究显示,脓毒症患者与H-MODS患者的TNF-α及CRP具有相近的变化特点[23-24]。在H-MODS发生发展过程中,炎性反应及免疫反应贯穿整个疾病的发展始末,促炎细胞因子与抗炎细胞因子之间伴随着免疫反应调节,最终取得平衡以达到内环境的稳定,所以TNF-α及IL-1β炎性指标的变化呈现迅速的抛物线形趋势,这种变化趋势使得机体的炎性反应及时得到调整,不会出现过度抗炎性反应及免疫功能抑制。本研究发现,蕨麻猪模型HMODS形成时机体产生严重的炎性反应,炎性因子TNF-α、IL-1β表达迅速升高,这时免疫调节作用也迅速对炎性因子高表达进行反向调节,迅速下调TNF-α、IL-1β的表达水平,所以机体出现炎性反应时炎性因子的变化特点是短时间内出现急剧波动,且会经免疫调节快速达到平衡状态;相对而言,CRP表达的变化比较缓慢,其表达量表征着机体炎性反应的整个过程。
综上所述,研究H-MODS发生、发展过程中炎性因子及CRP的变化特点,将有助于人们准确预判H-MODS的病程发展,为进一步深入探讨H-MODS的致病机制提供理论参考,并且对H-MODS的临床精准诊断及治疗具有重要的指导意义。

