肝螺杆菌感染对葡聚糖硫酸钠诱导小鼠慢性结肠炎模型的影响
吴志浩,沈 宸,殷 俊,朱立麒,张 泉,2
(扬州大学兽医学院,扬州225009;2.扬州大学附属医院,扬州 225001)
肝螺杆菌(Helicobacter hepaticus,H.h)是一种革兰阴性菌,在某些易感小鼠品系中感染率较高,可引起肝脏和肠道疾病[1],对实验动物质量及实验动物疾病模型构建能造成一定影响。炎性肠病(inflammatory bowel disease,IBD)是一种复杂的肠道疾病,可分为克罗恩病和溃疡性结肠炎,罹患这两类IBD后患者通常因肠道长期过度的炎性反应出现便血和体质量减轻[2]。已知白细胞介素10(interleukin 10,IL-10)敲除(IL-10-/-)小鼠能够感染H.h并引起结肠炎[3],常用于结肠炎模型的建立。使用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎可作为IBD的疾病模型[4]。然而处于非无菌环境中的小鼠可能因感染H.h而对结肠炎模型造成一定影响。本研究旨在用DSS诱导感染H.h的小鼠制备IBD模型,探究H.h感染对DSS慢性结肠炎模型的影响。
1 材料与方法
1.1 实验动物及菌株
IL-10-/-小鼠(B6.129P2-IL10tmlCgn/J)购自美国Jackson实验室,饲养于扬州大学比较医学中心SPF级动物设施[SYXK(苏)2017-0044]。环境温度(26±2)℃,相对湿度40%~60%,昼夜12h更替。实验前小鼠H.h检测均呈阴性。H.h(ATCC51449)购自美国模式培养物保藏中心,保存于-80℃备用。
1.2 主要试剂
DSS购自上海翊圣生物科技有限公司;苏木精和伊红购自国药集团化学试剂有限公司;TRIzol购自美国Invitrogen公司;PrimeScript RT Regent Kit with gDNA Eraser购自日本TAKARA公司;Universal SYBR Green Master购自瑞士Roche公司;白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的PCR引物由生工生物工程(上海)股份有限公司合成;信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3(phosphorylation-STAT3,p-STAT3)和β-肌动蛋白(β-actin)抗体购自美国Cell Signaling Technology公司;超敏化学发光试剂购自苏州新赛美生物科技有限公司。
1.3 实验动物分组与模型建立
5周龄雄性IL-10-/-小鼠随机分为4组,每组10只,分别为对照组、DSS组、H.h组和H.h+DSS组。H.h组和H.h+DSS组各10只小鼠使用H.h标准菌株ATCC51449菌液0.2 mL(1×109CFU/mL)进行3次灌胃,每次灌胃间隔1 d,最后一次灌胃后5 d经环介导等温扩增技术(loop mediated isothermal amplification,LAMP)快速检测证明20只小鼠均已感染H.h[5]。在H.h组和H.h+DSS组确认感染后,DSS组和DSS+H.h组小鼠饮用质量分数为2%的DSS溶液2个周期,每个周期7 d;2个周期间隔,饮用无菌水5d。对照组和H.h组均正常饮用无菌水。观察小鼠及其粪便状态,并记录小鼠体质量变化。
1.4 实验取材
小鼠经脱颈椎处死后,分离小鼠结肠,并用游标卡尺(精度0.05mm)测量长度。取结肠近端1/3用于制作病理切片,中端及远端均分后分别用于提取相关mRNA和蛋白。
1.5 病理学检查
用质量分数为4%的多聚甲醛溶液固定结肠组织后,梯度乙醇溶液脱水,2次100%正丁醇透明各1 h,然后于60 ℃烘箱中浸蜡30 min,并进行包埋。连续切片,切片厚度为5µm。然后分别进行HE染色与Masson染色。按照组织病理学活动指数(histological activity index,HAI)进行评分(表1),比较各组病变差异。

表 1 小鼠结肠组织病理学活动指数评分表Table 1 Grading scheme of the histological activity index (HAI) in the colon of mice
1.6 实时荧光定量PCR法检测结肠相关炎性因子转录水平
提取结肠总RNA,反转录成cDNA,以GAPDH为内参,检测结肠组织中IL-6和TNF-α的表达量。每个样本重复3次,采用2-ΔΔCt法进行分析。PCR反应条件:95 ℃ 10 min;95 ℃15 s,60 ℃ 30 s,总计40个循环;72 ℃ 20 s。PCR引物序列包括:GAPDH上游引物为5'-CCATCACCATCTTCCAGGAG-3',下游引物为5'-CCTGCTTCACCACCTTCTTG-3';IL-6上游引物为5'-TAGTCCTTCCTACCCCAATTTCC-3',下游引物为5'-TTGGTCCTTAGCCACTCCTTC-3';TNF-α上游引物为5'-AACTAGTGGTGCCAGCCGAT-3',下游引物为5'-CTTCACAGAGCAATGACTCC-3'。
1.7 蛋白质印迹法检测STAT3蛋白表达水平
RIPA法提取结肠组织蛋白,BCA法测定蛋白浓度后,取等量蛋白用10%分离胶进行SDSPAGE分离。电泳结束后转膜,然后用5%脱脂奶溶液进行封闭,分别使用稀释比例为1︰1 000的β-actin、STAT3、p-STAT3一抗孵育过夜,再用稀释比例为1︰10 000的二抗孵育1 h,使用超敏化学发光试剂显影。以目的蛋白条带灰度值与内参β-actin条带灰度值之比表示目的蛋白的表达水平。
1.8 统计方法
采用Graphpad 7.0统计学软件进行分析。计量数据以±s表示,并进行正态检验和方差分析;组织切片参考Two-way ANOVA系统评级评分。以P<0.05为差异有统计学意义。
2 结果
2.1 H.h感染可加重DSS诱导的小鼠慢性结肠炎
DSS组和DSS+H.h组在饮用DSS水7 d后小鼠体质量降低,活动性下降,有轻微便血。恢复正常饮水后,DSS组小鼠体质量小幅回升;而DSS+H.h组小鼠体质量持续下降,精神萎靡,腹泻,便血。再次饮用DSS水后,DSS和DSS+H.h组均出现更明显的体质量下降(表2)、腹泻与便血。H.h组和对照组小鼠体质量保持稳定小幅上升,且精神状态良好,无腹泻和血便。H.h组和对照组小鼠结肠长度无变化,DSS和DSS+H.h组结肠长度均缩短,且DSS+H.h组缩短情况更明显(表2)。
表 2 各组小鼠体质量变化和结肠长度Table 2 Body weight of mice and their colon length in diffrent groups( ± s,n=10)

表 2 各组小鼠体质量变化和结肠长度Table 2 Body weight of mice and their colon length in diffrent groups( ± s,n=10)
注:与对照组比较,*P<0.05;与DSS组比较,△P<0.05。
组别 体质量/mg 结肠长度/cm 实验前 饮用DSS水7 d 正常饮水5 d 再次引用DSS水7 d对照组H.h组DSS组H.h+DSS组21.892±1.207 21.962±1.614 21.716±1.472 22.056±0.947 22.870±1.067 23.134±1.204 21.136±0.676*21.156±0.947*23.606±1.018 23.767±1.340 21.186±1.194*19.954±1.415*△24.125±0.941 24.333±1.473 19.650±1.755*17.809±1.616*△7.494±0.078 7.514±0.053 6.446±0.111*4.760±0.154*△
2.2 H.h感染可加重DSS慢性结肠炎小鼠病变
与对照组(图1A)相比,H.h组有少量淋巴细胞浸润,肠绒毛完整,杯状细胞无缺失(图1B)。DSS组小鼠结肠固有层大量淋巴细胞浸润,隐窝结构改变,部分隐窝扩张、扭曲,肠腺减少(图1C)。H.h+DSS组黏膜全层炎性细胞浸润,且延伸至黏膜下层,正常隐窝结构消失(图1D)。HAI评分(表3)表明,H.h主要通过促进炎性反应、上皮缺失、隐窝萎缩和增生,加剧DSS诱导的慢性结肠炎。
表 3 小鼠结肠组织病理学活动指数评分Table 3 The histological activity index (HAI) score of the colon tissues of mice( ± s,n=10)

表 3 小鼠结肠组织病理学活动指数评分Table 3 The histological activity index (HAI) score of the colon tissues of mice( ± s,n=10)
注:与对照组比较,*P<0.05,**P<0.01;与DSS组比较,△P<0.05。
分 组 炎性反应 上皮缺失 腺体萎缩 增生对照组H.h组DSS组H.h+DSS组 0 0.8±0.422*1.7±0.483*2.9±0.316**△ 0 0.4±0.309 1.7±0.483*2.8±0.422**△ 0 0.5±0.516 2.0±0.667*3.1±0.316**△ 0 0.6±0.516 2.6±0.667*3.5±0.527**△
2.3 H.h感染可加重DSS慢性结肠炎小鼠纤维化程度
Masson染色可用于指示胶原纤维沉积程度,能用蓝色和红色区分胶原纤维和肌纤维,因此常应用于肠纤维化的观察[6]。对照组和H.h组仅在黏膜下层有少量胶原纤维沉积(图2A、2B);DSS组中纤维沉积已出现在固有层(图2C);H.h+DSS组黏膜下层纤维沉积更为严重,黏膜层全层纤维沉积,且范围更大(图2D)。
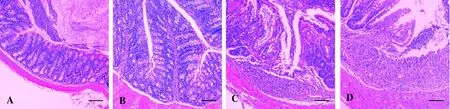
图 1 小鼠结肠组织病理学观察 (HE染色,×100)Figure 1 Pathological observation of the colon tissues of mice (HE staining, ×100)

图 2 小鼠结肠组织Masson染色(×100)Figure 2 Masson’s trichrome staining of the colon tissues of mice (×100)
2.4 H.h感染可增加DSS慢性结肠炎小鼠组织中炎性细胞因子转录水平
实时荧光定量PCR法检测结果如图3A所示。与对照组比较,H.h感染促进了IL-6、TNF-α的转录(P<0.05)。在DSS诱导的慢性结肠炎中,IL-6和TNF-α转录水平明显上调(P<0.01),而H.h+DSS组的IL-6和TNF-α转录水平比DSS组明显升高(P<0.05),提示H.h感染促进了DSS诱导的炎性细胞因子表达(表4)。
表 4 小鼠结肠组织中IL-6、TNF-α的mRNA转录水平Table 4 Transcriptional levels of IL-6 and TNF-α in the colon tissues of mice( ± s,n=10)

表 4 小鼠结肠组织中IL-6、TNF-α的mRNA转录水平Table 4 Transcriptional levels of IL-6 and TNF-α in the colon tissues of mice( ± s,n=10)
注:与对照组比较,*P<0.05,**P<0.01;与DSS组比较,△P<0.05,△△P<0.01。
分组 IL-6 TNF-α对照组H.h组DSS组H.h+DSS组 1.087±0.180 5.765±2.304*24.251±1.644**32.073±3.307**△ 1.044±0.117 3.737±0.371* 6.663±0.469**11.702±0.282**△△
2.5 H.h感染可激活DSS慢性结肠炎组织中STAT3磷酸化水平
JAK-STAT3通路是炎性反应中IL-6、TNF-α等炎性因子表达的调节因子[7]。如图3B所示,DSS组中的STAT3被激活,而H.h+DSS组中的STAT3则被大量激活,提示H.h感染显著增强了DSS慢性结肠炎组织中STAT3磷酸化程度,说明感染H.h可以加剧DSS诱导的慢性结肠炎严重程度。
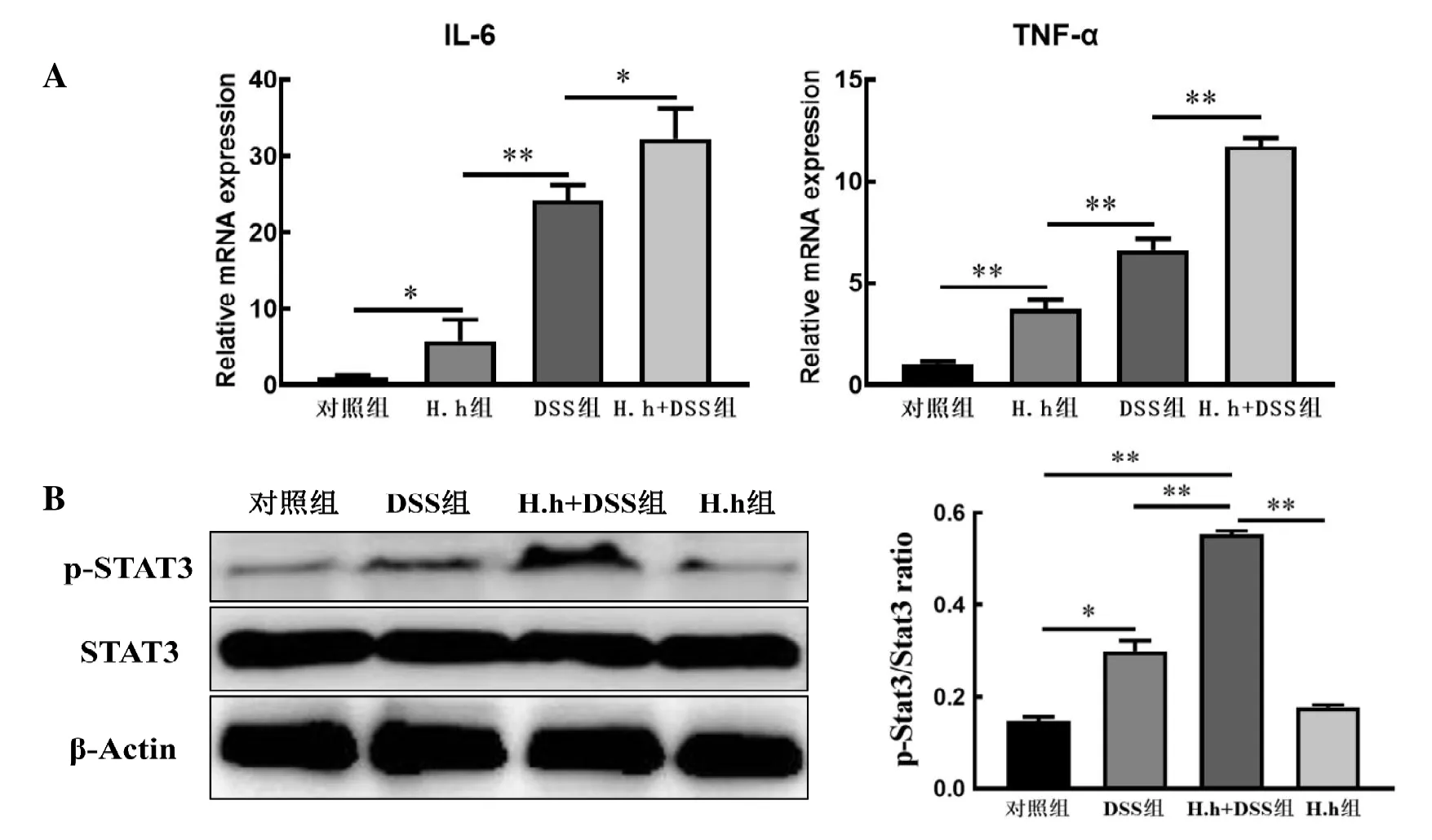
图 3 实时荧光定量PCR法(A)和蛋白质印迹法(B)检测小鼠肠道组织中相关分子表达Figure 3 Detection of relative molecular expression in the colon tissues of mice by real-time fluorescent quantitative PCR (A) and Western blotting (B)
3 讨论
21世纪以来,人类IBD发病率呈上升趋势,许多国家IBD的患病率达0.3%以上[8]。目前IBD的发病机制仍未明确。一些研究结果表明,细胞因子和趋化因子、肠道微生物、遗传和环境因素等参与了IBD的发病[9-12]。动物模型在IBD的发病机制及治疗手段研究中发挥重要作用。目前通常使用DSS、三硝基苯磺酸和H.h等化学或生物方法建立小鼠IBD模型。研究发现,肠道菌群对小鼠的免疫系统有着一定的调节作用,如激活炎性因子释放和激活免疫细胞[13-14];而不同饲养环境中的小鼠肠道菌群有所差异,导致构建疾病模型时小鼠免疫状态不同。H.h在易感小鼠中能够引起慢性活动性肝炎、肝细胞癌、结肠癌及IBD[7]。感染H.h的小鼠用于构建肝脏、肠道疾病模型时容易引起误差,因此在进行该类研究时控制实验动物的微生物学质量尤其重要。
促炎细胞因子如IL-6、TNF-α等在结肠炎性反应期间的失调会损害肠黏膜,在IBD的发病机制中起着关键作用[15]。IL-6能够影响细胞的增殖、存活、分化与转移[16]。TNF-α通过促进黏附分子如血管细胞黏附因子-1和细胞间黏附分子-1的表达,显著增加肠黏膜炎性细胞浸润[17]。STAT3能被多种因子激活,如IL-6和TNF-α,进而导致大量炎性因子表达,调节细胞存活与增殖,参与炎性反应[18]。本研究发现,H.h感染影响了DSS诱导的慢性结肠炎模型小鼠的生理指标和病理变化;在构建结肠炎模型时,H.h感染促进了淋巴细胞浸润和炎性细胞因子释放,并进一步激活了炎性反应关键信号STAT3,提高了DSS诱导的慢性结肠炎发病过程中炎性细胞浸润及纤维化程度,说明感染H.h的小鼠会影响动物模型尤其是结肠炎模型的建立及评价,提示了实验动物质量控制的重要性。
综上所述,在构建IBD模型时,H.h通过促进炎性因子表达,激活STAT3通路而造成更加严重的结肠炎;这对研究IBD发病进程及评价带来一定影响。

