山苍子精油抑制沙门菌作用机制研究
李欣越,苟玉虹,申瀚君,李育浩,王 涛,尹立子
(四川农业大学动物医学院,成都 611130)
沙门菌属(Salmonella)是一种在自然界广泛分布的革兰氏阴性细菌,可感染人和动物引发菌血症、败血症、胃肠炎等,威胁人和动物的健康[1-2]。据美国疾病预防控制中心(CDC)统计,沙门菌在美国每年会造成135万人感染,26 500人住院,400余人死亡;在全球可造成超过9 000万人感染和15余万人死亡[3]。因其广泛存在于肉类、乳类、蛋类、果蔬类食品甚至土壤中,故由其引起的感染主要是食源性的[4]。已有研究发现,从人体和鸡肉中分离的沙门菌对四环素、氨苄西林等多种抗生素产生了高度耐药性[5]。因此,寻找沙门菌的有效防治方法、维护公共卫生已迫在眉睫。
植物精油是从植物的果实、花、叶、根等中提取得到的挥发性芳香物质,含量低但却有多种生物活性,近年来在食品抗菌方面的应用研究尤其深入[6-7]。山苍子精油(Litsea cubeba essential oil,LC-EO)呈淡黄色,由山苍子果实中提取得到,且有强烈的柠檬味。山苍子精油有广谱抗菌作用,Liu T.等[8]和赵露露等[9]的研究表明,山苍子精油对金黄色葡萄球菌、铜绿假单胞菌等细菌都有良好的抑菌活性。戴锦铭[10]的研究表明山苍子精油可以破坏大肠杆菌的细胞膜、影响其能量代谢、抑制其蛋白质合成、减少胞内DNA含量等。吴均等[11]的研究发现,山苍子精油可以改变金黄色葡萄球菌菌体的通透性、降低其蛋白质的利用率。但目前山苍子精油对沙门菌的抑菌机理方面的研究还很少。本研究旨在从细胞膜通透性、形态结构、可溶性蛋白质含量、生物被膜形成等方面探究山苍子精油对鼠伤寒沙门菌的抑菌机制。为防治沙门菌引起的食物中毒、开发以山苍子精油为基础的新型药食同源产品提供理论依据。
1 材料和方法
1.1 药品和菌株
山苍子精油(纯度≥98%,成都瑞芬思公司)用二甲亚砜(成都浩博优公司)溶解,配制成质量浓度为40.96 mg/mL的母液备用;鼠伤寒沙门菌标准菌株(ATCC 14028)由四川农业大学动物医学院药学实验室保存。
1.2 试剂和器材
胰蛋白胨大豆肉汤培养基(TSB)、脑心浸出液肉汤(BHI)购自杭州微生物试剂公司;PBS磷酸缓冲盐粉剂、2.5%Gluta固定液、无水葡萄糖购自成都浩博优公司;BCA蛋白浓度测定试剂盒购自南京建成生物公司;SDS-PAGE凝胶配置试剂盒、4×双色蛋白上样缓冲液、双色预染蛋白Marker购自成都罗宁生物公司。
UV-2000型紫外分光光度计(UNICO,美国)、ZD-85A气浴恒温振荡器(金坛市科析仪器公司,中国)、DDS-307电导率仪(上海仪电科学仪器公司,中国)、全功能凝胶成像系统仪(Bio-Rad公司,美国)。
1.3 方法
1.3.1 山苍子精油对沙门菌生长的影响
采用二倍稀释法测定山苍子精油对沙门菌的MIC,设立只加菌液的阳性对照组,只加山苍子精油的阴性对照组,只加培养基的空白对照组,37℃恒温培养16~24 h后,用肉眼进行观测,所有透明且澄清的试管中,含最小的山苍子精油浓度的试管所设定的浓度值,即为MIC[12]。采用平板画线法测定MBC,从MIC试验中所有澄清的试管中吸取0.1 mL均匀涂布到琼脂固体培养基上,37℃培养24 h后观察计数,以5个以下菌落的培养基所对应的山苍子精油浓度为MBC[13]。
吸取80 μL过夜培养的沙门菌菌液于30 mL BHI培养基中继续培养,当菌液OD600=0.3时,加入山苍子精油,并使其质量浓度为 0、32、64、128、256 和512 μg/mL,振荡培养。并在第 0、1、2、4、6、8、16、24 h测定其OD600值,绘制生长曲线。
1.3.2 山苍子精油对沙门菌电导率的影响
参考F.Bendali等[14]的方法,取培养至对数期的沙门菌液1 mL接种于50 mL TSB液体培养基,振荡培养16 h后,加入山苍子精油使其质量浓度等于2 MIC,对照组加入同体积的DMSO。37℃恒温培养,在第0、1、2、4、6和 8h时,分别取5 mL菌液,4500r/min离心10 min,取适量上层澄清液体,将其按1∶40比例与5%的无菌葡萄糖溶液混合,用电导率仪测定混合溶液的电导率。
1.3.3 山苍子精油对沙门菌细胞膜电位的影响
吕:当然,你的《德克萨斯》的价值除了展现战争跳动的旋律和令人窒息的危险,在表述战争的惯性恐怖感受和作战的超现实主义方面成功外,启示人们用另一种眼光来审视世界的,给读者更大阐释空间的是你对处在战争这一非常态下的情爱的描写,对非常态的情爱的这种人文关怀同样令我痴迷。特别想听听你自己是如何诠释小说中苏珊与克洛特·盖博之间的情爱的。
参考杨磊等[15]的方法,将沙门菌于MH培养基中培养至OD600=0.5~0.6后,取适量菌液,3 000 r/min离心10 min,舍弃上层澄清液体,用5 mmol/L含葡萄糖的HEPES缓冲液洗涤沉淀并将其稀释至OD600=0.05左右。向适量稀释后的菌液中加入0.4 mmol/L DISC3(5)工作液并使其最终浓度为 0.8 μmol/L,在室温下避光振荡1.5 h后,加入4 mol/L KCL工作液并使其最终浓度为100 mmol/L,在室温下避光振荡0.5 h。取200 μL制备的菌液,在避光处迅速加入山苍子精油并使其最终浓度为 0、64、128、256、512 μg/mL,激发光622 nm、发射光670 nm条件下,间隔5 min,时长30 min,检测荧光强度。
1.3.4 山苍子精油对沙门菌细胞形态结构的影响
将沙门菌在TSB培养基中培养至对数期,加入山苍子精油使其浓度等于2 MIC,对照组加入同体积的DMSO,振荡培养。分别在第12、16、24 h时取适量菌液,4 500 r/min离心10 min,保留沉淀并用PBS缓冲液洗涤2次,用Gluta固定液固定,12、16 h样品经脱水、浸透、包埋、修块、切片、染色处理,在显微镜下观察细胞的形态结构[16];24 h样品经脱水、干燥、镀金后在扫描电镜下观察细胞的形态结构[17]。
1.3.5 山苍子精油对沙门菌可溶性蛋白的影响
按探究山苍子精油对沙门菌的形态结构的影响样品制备步骤,用PBS缓冲液洗涤下层菌体沉淀3次并定容至1 mL。将定容后的菌液超声破碎后,6 000 r/min离心10 min,取适量上层清液,用BCA蛋白试剂盒测定其中的蛋白质含量。将上清液与蛋白上样缓冲液按3∶1体积比混合,高温变性后进行SDS-PAGE凝胶电泳实验,经染色、脱色、成像后观察蛋白质电泳结果[18]。
1.3.6 山苍子精油对沙门菌生物被膜形成的影响
向5个TSB培养基中加入山苍子精油并使其浓度为 0、8、16、32、64 μg/mL,将沙门菌振荡培养至OD600=0.2后,取10 μL菌悬液于96孔板中,每孔再加290 μL含蔗糖和对应浓度山苍子精油的TSB培养基,37℃静置培养48~72 h。移除96孔板中混合溶液,加入10 μL 10%甲醛溶液并室温培养过夜,移除甲醛溶液,加入100 μL 0.1%的结晶紫并在室温放置30 min,移除结晶紫,用双蒸水小心冲洗孔板,加入200 μL 33%乙酸溶液后,用酶标仪测OD570值[19]。
2 结果与分析
2.1 山苍子精油对沙门菌生长的影响

图1 山苍子精油对沙门菌生长曲线的影响Figure 1 The growth curve of LC-EO against Salmonella
2.2 山苍子精油对沙门菌电导率的影响
当细菌细胞膜通透性改变时,其细胞内的无机盐等会渗透过细胞膜到细胞外,从而引起菌液电导率的增加[20]。据此原理,本实验对加入2 MIC浓度的山苍子精油的鼠伤寒沙门菌液电导率进行测定。据图2,与0 h的数据相比,菌悬液培养1 h的电导率为(8.39±0.50)%(P<0.01);培养 2 h的电导率为(9.82±0.49)%(P<0.01);培养 8 h 的电导率为(8.39±0.37)%(P<0.01)。而加入 DMSO 的菌液的电导率基本不变。由此可看出,山苍子精油可迅速且显著地改变沙门菌细胞膜的通透性。

图2 2 MIC的山苍子精油对沙门菌菌悬液电导率的影响Figure 2 Effect of 2 MIC LC-EO on conductivity of Salmonella suspension
2.3 山苍子精油对沙门菌细胞膜电位的影响
当细菌细胞膜破损或发生去极化时,DISC3(5)荧光探针可进入细胞水相溶液发出可检测荧光,引起荧光值变化[15]。据图3,与未加入山苍子精油的对照组相比,加有山苍子精油的沙门菌的荧光强度均增大,且呈浓度依赖性。在30 min内,加有山苍子精油的沙门菌荧光强度总体略呈增加趋势,而对照组率呈降低趋势。表明山苍子精油使沙门菌细胞膜发生了破损,改变了其通透性。

图3 不同浓度的山苍子精油对沙门菌细胞膜电位的影响Figure 3 Effect of different mass concentration LC-EO on membrane potential of Salmonella
2.4 山苍子精油对沙门菌细胞形态结构的影响
据图4,对照组细胞形态结构完整、边界清晰,胞内染色质和生物被膜丰富。而经山苍子精油处理的菌体,在透射电镜下观察到细胞变形,细胞膜皱缩、破损甚至溶解,从而使细胞内容物流出,胞质减少而染色变浅,且出现大量空泡化;在扫描电镜下观察到细胞膜塌陷,细胞发生粘连而边界不清晰,形态结构不完整。
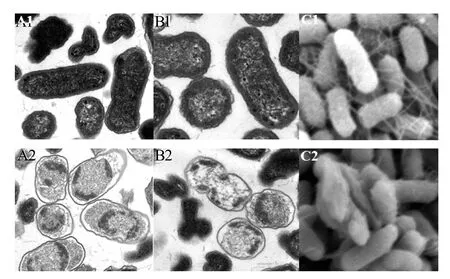
图4 山苍子精油对沙门菌形态结构的影响Figure 4 Effects of LC-EO on morphological structures of Salmonella cells
2.5 山苍子精油对沙门菌可溶性蛋白的影响
BCA蛋白试剂盒测定结果显示,山苍子精油作用12、16 h后,鼠伤寒沙门菌的可溶性蛋白分别减少(41.69±0.97)%(P<0.01)、(39.05±0.92)%(P<0.01)。据图5,经2 MIC的山苍子精油处理后,分子量在40 000和70 000左右的可溶性蛋白质减少,分子量在25 000~30 000间的蛋白质明显减少甚至消失。由此可看出,山苍子精油可使沙门菌的可溶性蛋白质减少。

图5 山苍子精油对沙门菌可溶性蛋白质含量的影响Figure 5 Effect of LC-EO on the soluble protein contents of Salmonella
2.6 山苍子精油对沙门菌生物被膜的影响
据图6,与对照组相比,经不同亚抑菌浓度的山苍子精油处理后,8 μg/mL组的生物被膜总量减少(19.25±3.42)%(P<0.01);16 μg/mL 组的生物被膜总量减少(37.73±2.84)%(P<0.01);32 μg/mL 组的生物被膜总量减少(56.91±3.40)%(P<0.01);64 μg/mL组的生物被膜总量减少(65.91±4.41)%(P<0.01)。据此可知,经亚抑菌浓度的山苍子精油处理后,沙门菌生物被膜的形成均被抑制,且随山苍子精油浓度增高,抑制作用增强,呈浓度依赖性。

图6 不同浓度的山苍子精油对沙门菌生物被膜形成的影响Figure 6 Effects of different concentrations of LC-EO on biofilm formation of Salmonella
3 讨论与结论
沙门菌感染是食源性疾病的主要原因,研究表明目前沙门菌已有较高的耐药性[21]。本实验研究发现,山苍子精油对鼠伤寒沙门菌的MIC和MBC均为256 μg/mL,表明山苍子精油对沙门菌有明显的抑制和杀灭作用,山苍子精油可作为沙门菌的杀菌药,因此,以山苍子精油为基础开发相关产品,治疗沙门菌引起的感染性疾病有很大前景。
细胞膜是细胞的屏障,受损会改变细胞的通透性,影响细胞的新陈代谢[22]。膜电位试验中,加有山苍子精油的沙门菌的细胞膜电位与对照组相比均增大,表明山苍子精油改变了沙门菌的通透性。电导率试验再次证明了这一观点。这与孟玉霞等[23]的结论一致。
蛋白质是生命的物质基础。何学文等[24]发现亚抑菌浓度的肉桂醛可使沙门菌蛋白质条带变浅甚至部分条带消失。本实验研究发现,山苍子精油可使沙门菌的蛋白质含量减少,部分蛋白质条带变浅甚至消失,这可能是因为山苍子精油改变了沙门菌膜结构的通透性和完整性,蛋白质外流所致。
生物被膜不仅可帮助菌体适应环境利于生存,还可以导致细菌的耐药性和持续性感染。本实验发现,亚抑菌浓度的山苍子精油可明显抑制沙门菌生物被膜的形成。崔海英等[25]的研究表明山苍子精油可通过清除胞外聚合物来破坏MRSA生物膜的结构,抑制膜内细菌的代谢水平,山苍子精油对沙门菌生物被膜的作用机制可能如此。
山苍子精油来源广泛,价格低廉,具有副作用小、不易产生耐药性的优势。根据GB2760-86标准,我国已批准山苍子精油用于食品中,因其无毒副作用,其还被广泛用于医药、化工等行业[26]。因此,以山苍子精油为原料,将其制成食品保鲜剂或药食同源产品有良好前景。
综上所述,山苍子精油可明显抑制沙门菌生长,可通过改变沙门菌的细胞通透性、抑制生物被膜合成、减少可溶性蛋白质含量、改变细菌形态结构来影响沙门菌的新陈代谢,从而起到抑菌和杀菌作用。为更好地开发出山苍子精油的相关产品以抑制沙门杀菌,还应探究山苍子精油对沙门菌遗传物质的作用,并进行相关体内抑菌实验。

