磷酸改性水稻秸秆和猪粪生物质炭添加对不同土壤吸附四环素的影响
邓达行,陈亭微,陈雨轩,罗 玲
(四川农业大学环境学院,成都 611130)
抗生素自20世纪40年代发现至今,就被广泛地应用于人类及动物的疾病防治、农业生产、畜牧及水产养殖等领域,并通过各种途径进入环境,造成严重的环境污染[1-5]。四环素类抗生素(TCs)在畜禽养殖业和临床中应用最为普遍,且其使用量和生产量在中国排名第一[6]。据报道,大约70%~90%的TCs不能被生物体有效代谢,并随着排泄物释放到环境中[7]。随着畜禽粪便的大量施用,畜禽粪便中的抗生素可以通过施肥等途径进入土壤,从而造成土壤抗生素污染[8-9]。目前,土壤中均已检测到高含量的TC残留[8-9]。因此,寻求有效手段缓解土壤TC污染十分重要。
生物质炭(biochar)是指由富含碳的生物质通过裂解或者不完全燃烧生成的一种固态物质,具有发达的孔隙结构、较大的比表面积以及丰富的表面官能团等特性[10-12]。生物质炭不仅作为土壤改良剂被广泛使用,同时在土壤修复领域的应用也十分广泛[12-15]。土壤中添加生物质炭会降低污染物的迁移性及生物有效性。目前,生物质炭添加对土壤中疏水性有机污染物(如多氯联苯、多环芳烃等)、重金属等污染物的影响研究较多,而关于生物质炭对土壤中离子型化合物(如TC)的影响却不甚明确。
农业废弃物被用于制备生物质炭的研究引起了国内外学者的广泛关注,且取得了较好的成果[16-19]。我国是农业大国,在农业生产过程中产生了大量的废弃物,其中产量最大的是农作物秸秆以及畜禽粪便[16]。农作物秸秆是应用最为广泛的生物质炭原料,而畜禽粪便作为生物质炭的制备原料却较为少见。生物质炭的性能主要受到原材料和热解温度的影响[20-21]。因此,作物秸秆和畜禽粪便为原料制备的生物质炭在性质上是否存在差异?这两类生物质炭进入土壤环境后,其吸附TC的能力是否有所不同?这些问题的答案并不清楚并有待解决。
为明确作物秸秆和畜禽粪便制备生物质炭的差异及其对土壤中TC吸附的影响,本研究以水稻秸秆和猪粪为代表制备了两种不同生物炭,并采用磷酸改性以提高其吸附性能。同时,本研究探讨了两类生物炭添加对3种不同土壤吸附TC的影响,并考察了不同pH下生物质炭添加对土壤吸附TC的变化规律,以期为应用水稻秸秆和猪粪生物质炭治理TC污染提供理论基础。
1 材料和方法
1.1 试验土壤
供试土壤为四川省典型的黄壤土、水稻土和紫色土。黄壤土和紫色土采自四川省雅安市名山区,水稻土采自四川省南充市高坪区。3种土的采集深度为0~20 cm,自然风干,过100目放入干燥器中待用。
不同供试土壤的pH采用测定电位法(土水比1∶1,上海雷磁 PHSJ-3F pH计);有机质(SOM)采用重铬酸钾容量法-外加热法测定;阳离子交换量(CEC)采用乙酸铵交换法测定[22]。3种土壤的基本理化性质如表1所示,且未检测出TC。

表1 土壤的基本理化性质Table 1 Physicochemical properties of soils
1.2 生物质炭
1.2.1 生物质炭制备
水稻秸秆和猪粪风干、研磨过2 mm筛备用。将上述生物质填充到30 mL瓷坩埚中并加盖以限制氧气供应,然后在马弗炉中700℃加热2 h。待冷却后取出,过100目筛备用。根据Peng H.B.等[23]的方法,采用14% H3PO4溶液将上述生物质炭进行改性。简而言之,在25℃下将20 g生物炭浸入到40 mL 14% H3PO4溶液,浸泡24小时后,用蒸馏水洗涤,直到上清液的pH稳定(接近7.0),弃去上清液,将生物炭在105℃下烘箱干燥过夜[23-24]。在后续研究中,将改性后的水稻秸秆和猪粪生物炭分别记录为RCA和SCA。
1.2.2 生物质炭的表征
生物质炭的比表面积采用比表面仪(美国,Micromeritics,ASAP2460)测定;表面官能团利用傅里叶变换红外光谱仪(FTIR,美国,PerkinElmer Frontier)进行分析;样品中C、H、O和N元素的百分含量通过元素分析仪(中国,YX-CHN5000)测定;扫描式电子显微镜(SEM-EDS,德国,Zeiss Sigma300)被用于分析RCA和SCA的表面形貌特征;零点电荷 pH(pHPZC)根据 Jang H.M.等[25]的方法测定。
1.3 吸附试验
1.3.1 吸附动力学
土壤吸附TC采用OECD振荡批处理法[26]。土壤中添加生物质炭的浓度(W/W)为2%,添加生物质炭的土壤置于振荡器上反复震荡24 h,使生物质炭与土壤颗粒充分混合均匀。分别称取0.50 g土壤和0.30 g含2% RCA或SCA的土壤置于50 mL玻璃离心管中,加入30 mL的TC溶液(300 mg/L)加盖密封,于25℃恒温摇床上以200 r/min的速度振荡10 min、20 min、30 min、60 min、2 h、4 h、12 h、24 h、48h、72h、96h,振荡完成后,以 3000r/min 离心 10min,过0.45 μm滤膜。滤液用紫外分光光度计(上海元析,V-5000)在360 nm波长下测定过滤后水样中TC的含量。各处理组设置3个平行。
1.3.2 吸附等温线
称取不同量含有0%和2%两种生物炭的土壤于一系列玻璃离心管中,加入30 mL浓度为0、60、80、100、120、160、200、250 和 300 mg/L 的 TC 溶液,加盖密封于25℃恒温摇床上以200 r/min的速度振荡至平衡时间。振荡完成后按上述方法测定TC浓度。各处理组设置3个平行。
1.4 pH的影响
分别称取0.05 g含SCA和RCA为0%和2%的3种不同土壤于一系列玻璃离心管中,加入30 mL pH 分别为 2、3、4、5、6、7、8、9、10 和 11 的 TC 溶液(以0.1 mol/L的HCl和0.1 mol/L的NaOH的调节),其浓度为120 mg/L;将离心管置于25℃恒温摇床上以200 r/min的速度振荡至平衡时间,振荡完成后按上述的方法测定TC浓度。各处理组设置3个平行。
1.5 数据处理与吸附模型
数据处理和绘图采用Excel 2016(美国,Microsoft)和 OriginPro 2017(美国,Origin Lab)。
土壤对溶液中TC的吸附量为:

其中,Qe与Qt分别为饱和吸附量和t时的吸附量,V是溶液的体积,C0是初始溶液的浓度,mg/L;Ct是吸附平衡时溶液浓度,mg/L;m是土壤质量,g。
吸附动力学数据采用准一级式(3)、准二级(式4)和Elovich模型(式5)拟合,依次如下。
拉格朗日伪一级动力学模型:

伪二级动力学模型:

Elovich模型:

式中:Qe与Qt分别为饱和吸附量和t时的吸附量,mg/g;K1为准一级速率常数,h-1;K2为准二级速率常数,g/(mg·h);α为化学吸附速率常数;β为表面覆盖度吸附常数[27]。
吸附等温线数据采用 Freundlich(式6)和Langmuir(式7)模型进行拟合,依次如下。

式中:Kf为Freundlich吸附常数,反映了吸附剂与吸附质的结合程度;n和吸附强度相关;Qmax为最大饱和吸附量,mg/g;KL为吸附与解吸速率常数的比值,即Langmuir吸附常数[28]。
2 结果与分析
2.1 生物质炭的性质
两种生物炭的表面积、孔容、元素组成、灰分含量和零点电荷pH值如表2所示。由表2可以看出,RCA的比表面积(372.21 m2/g)高于SCA(319.04 m2/g),但RCA的孔容(0.23 cm3/g)略低于 SCA(0.25 cm3/g)。从元素组成结果可知,RCA的C、H、O、和N含量均低于SCA,但二者的H/C比率接近。从灰分的结果来看,RCA的灰分含量(55.27%)高于SCA的灰分含量(43.98%)。另外,由表2可知,两种改性炭的pHPZC值非常接近7。

表2 生物质炭的性质Table 2 Characteristics of biochars
从图1中可以看出两种改性生物炭的FTIR光谱信息相似,主要波段出现在3 436 cm-1(-OH)、1 591 cm-1(芳香族C=O,C=C)、1 400 cm-1(C-O)和1 050 cm-1(SiO32-),表明 RCA 和 SCA 的表明官能团均可能以芳环为骨架,存在羟基、酚类、醚等含氧光能团。
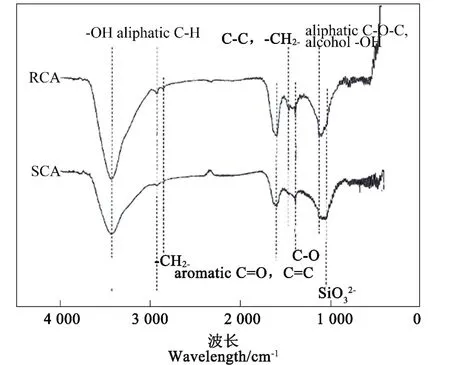
图1 秸秆生物质炭(RCA,a,b)和猪粪生物质炭(SCA,c,d)的 SEM-EDS 图像Figure 1 SEM-EDS image of rice straw derived biochar(RCA,a,b) and swine manured derived biochar (SCA,c,d)
两种生物质炭的SEM-EDS如图2所示。从图2a和2c可知,两种生物质炭的元素组成大致相同,其中C、O、Si的含量较高,与FTIR的结果相符。另外,SEM图可以看出RCA表面粗糙,且多孔结构更加明显(图2b);SCA表面则相对光滑平整,形状也更加规则,主要展现出明显的管状结构(图2d)。

图 2 秸秆生物质炭(RCA,a,b)和猪粪生物质炭(SCA,c,d)的 SEM-EDS 图像Figure 2 SEM-EDS image of rice straw derived biochar (RCA,a,b) and swine manured derived biochar (SCA,c,d)
2.2 生物炭添加对不同土壤吸附TC的影响
2.2.1 吸附动力学
图3为土壤和生物质炭+土壤体系对TC的吸附动力学。在土壤体系中,黄壤土(图3a)和紫色土(图3c)在0~2 h内对TC的吸附量可达到平衡吸附量的90%,在24 h内基本达到平衡;水稻土(图3b)在0~10 min内吸附TC十分迅速,吸附量在首10 min内可达到平衡吸附量的90%,且在2 h内基本能达到吸附平衡。在生物质炭+土壤体系中,黄壤土+生物质炭(图3a)和紫色土+生物质炭(图3c)在0~8 h内对TC的吸附量可达到平衡吸附量的85%,72 h时基本达到平衡;水稻土+生物质炭(图3b)对TC的吸附仍然十分迅速,在0~1 h内的吸附量约达到平衡吸附量的88%,在12 h基本达到吸附平衡。另外,由图3可知,RCA和SCA添加对同一土壤吸附TC的平衡时间和吸附速率的影响十分接近。
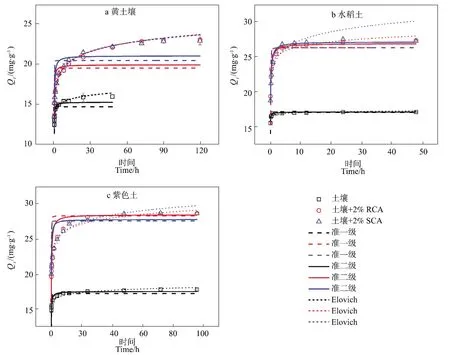
图3 土壤体系与生物质炭+土壤体系对TC的吸附动力学(初始浓度为300 mg/L,温度为25℃)Figure 3 Adsorption kinetics of TC to soils and soils amended with biochar addition(initial concentration 300 mg/L temperature 25℃)
为了更好地描述土壤体系与生物质炭+土壤体系对TC的吸附动力学过程,准一级、准二级和Elovich模型分别用于拟合吸附数据,拟合结果如表3所示。对黄壤土和紫色土而言,Elovich模型对数据拟合度最高(R2为0.92~0.99),其次为准二级模型(R2为 0.74~0.97),最后为准一级模型(R2为 0.34~0.91)。不同于黄壤土和紫色土,准二级模型对水稻土吸附TC拟合度最高(R2为0.95~0.98),其次为准一级模型(R2为 0.64~0.88),最差为 Elovich 模型(R2为0.41~0.85)。相对于土壤体系而言,添加了RCA和SCA的土壤体系对TC的吸附量更高。

表3 吸附动力学参数Table 3 Parameters of sorption kinetics
2.2.2 吸附等温线
3种土壤以及生物质炭+土壤体系对TC的吸附等温线如图4所示。相对土壤体系而言,RCA和SCA的添加提高了3种土壤对TC的吸附容量。另外,从图中可以看出,等量RCA和SCA的添加对TC吸附量的影响十分接近。为进一步明确RCA和SCA添加对土壤吸附TC的影响,Freundlich和Langmuir模型被用于拟合吸附等温线数据,拟合参数见表4。对黄壤土和紫色土而言,Freundlich模型对数据拟合度更高,拟合R2为0.91~0.98,而Langmuir模型对数据拟合的R2仅为0.75~0.94。不同于黄壤土和紫色土,Freundlich模型(R2为0.91~0.99)和 Langmuir模型(R2为 0.97~0.99)均能很好地拟合水稻土对TC的吸附等温线数据。相对于土壤体系而言,添加了RCA和SCA的土壤体系的Kf以及Qmax值较高。

图4 添加RCA和SCA的不同土壤对TC的吸附等温线(25℃)Figure 4 Sorption isotherm of TC to different soils amended with RCA and SCA (25℃)

表4 添加生物质炭的不同土壤吸附TC的等温线模型参数Table 4 Fitted parameters of sorption isotherm model for TC sorption to soils amended with biochar
2.3 pH对生物质炭+土壤体系吸附TC的影响
pH对土壤以及生物质炭+土壤体系吸附TC的影响如图5所示。在pH为2~11之间,pH对黄壤土吸附TC的影响基本表现为先增加再减少,黄壤土对TC吸附的最大值(22.33 mg/g)在pH为9左右,而最小值(7.10 mg/g)在pH为11左右。生物质炭+黄壤土对TC的吸附趋势与黄壤土的趋势基本保持一致,且RCA和SCA对TC吸附量的影响基本相当。在pH为9时,黄壤土+2%RCA和黄壤土+2%SCA对TC的吸附量分别为27.26 mg/g和26.19 mg/g;在pH为11时,添加RCA和SCA黄壤土对TC的吸附量分别为10.59 mg/g和14.78 mg/g。
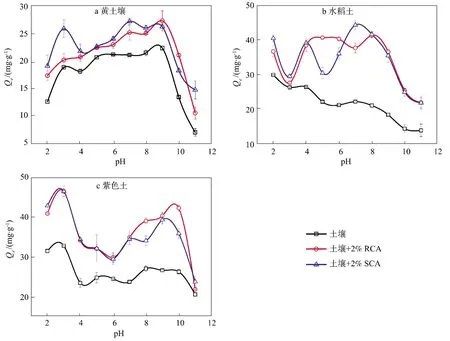
图5 pH对添加RCA和SCA的不同土壤吸附TC的影响(初始浓度120 mg/L,温度25℃)Figure 5 Effect of pH on the sorption of TC to soils amended with different RCA and SCA (initial concentration 120 mg/L temperature 25℃)
pH对水稻土吸附TC的影响表现为吸附量随着pH的增加而降低,吸附量的最大值(29.99 mg/g)出现在pH为2左右,最小值(13.92 mg/g)出现在pH为11左右。不同于水稻土体系,生物质炭+水稻土体系对TC的吸附量随着pH值的增加表现降低-增加-降低-增加-降低。其中,水稻土+2%RCA对TC吸附的最大值(41.44 mg/g)在pH为8左右,而水稻土+2%SCA对TC的吸附最大值(44.42 mg/g)在pH为7左右;相同的是,添加RCA和SCA的水稻土对TC的吸附最小值依然出现在pH为11左右,分别为21.97 mg/g和21.89 mg/g。
在pH为2~11之间,pH对紫色土吸附TC的影响表现为增加-降低-增加-降低,其中紫色土对TC吸附最大值(32.97 mg/g)出现在pH为3附近,吸附最小值(20.66 mg/g)出现在pH为11左右。类似地,pH对生物质炭+紫色土体系吸附TC的影响趋势一致,即TC的吸附量随着pH增加表现为增加-降低-增加-降低。其中,添加RCA和SCA的紫色土体系对TC吸附最大值出现在pH为3左右,分别为46.70 mg/g和46.79 mg/g;最小值出现在pH 11左右,分别为21.95 mg/g和23.86 mg/g。
3 讨论
3.1 生物质炭添加对土壤吸附TC的影响
根据吸附动力学结果(图3)可知,3种土壤吸附TC所需的平衡时间并不一致,其中SOM含量最高的水稻土在2 h内可达到吸附平衡,而SOM较低的黄壤土和紫色土需24 h左右达到吸附平衡。该研究结果表明,SOM含量对TC的吸附平衡时间可能具有重要的作用。同时,Liu N.等[29]的研究发现有机蒙脱石对TC的吸附平衡时间比钠基蒙脱石更短,并认为SOM含量对TC吸附平衡时间具有重要的作用。
RCA和SCA添加到土壤中会在一定程度上延长土壤对TC的吸附平衡时间,且增加TC在土壤中的吸附量(表3)。TC被土壤快速吸附的过程主要取决于TC在液膜扩散的过程中发生的化学反应,而慢速吸附过程主要受到微孔扩散这一过程的控制[28]。生物炭具有更发达的孔隙结构,生物炭加入到土壤中会影响TC的微孔扩散过程,从而延长慢吸附的时间,增强TC在土壤中的吸附。另外,Elovich模型拟合结果(表3)表明,RCA和SCA添加降低了3种土壤对TC的化学吸附速率常数和表面覆盖度吸附常数,这从某种程度上可以解释RCA和SCA添加延长了各土壤对TC的吸附平衡时间[27]。同时,由表3可知,准二级模型和Elovich模型可以更好地拟合土壤与生物质炭+土壤体系对TC的吸附数据。准二级和Elovich模型的理论基础主要是以静电作用或共价键等为主的化学吸附,由此可知,土壤或添加了生物质炭的土壤与TC之间可能主要发生化学吸附[27,30]。
相比于Langmuir模型,Freundlich模型对土壤吸附TC的等温线拟合效果更好,说明TC在土壤中的吸附过程是发生在非均匀的表面,并且是一个多分子层的吸附,这主要是由于土壤环境的复杂性而导致的[27]。结合表1和表4可知,SOM含量最高的水稻土对TC的Qmax最大,该结果与Chen X.Y.等[31]的研究结果一致,表明SOM是影响土壤吸附TC的关键环境因子。一般认为,土壤SOM对TCs的吸附主要有3个机理:离子交换、二价阳离子络合作用和氢键作用[32]。质子会和TC中质子化的氨基之间发生离子交换作用;土壤中存在的二价阳离子在低pH的条件下会起到桥梁的作用,通过共价键连接TC和土壤中的腐殖酸(SOM的重要组成部分)形成三元复合体系;腐殖酸中的酸性基团会和TC的极性官能团发生氢键作用[32-33]。因此,高SOM含量的土壤对TC的吸附作用更强。
从图4看,RCA和SCA添加增加了3种土壤对TC的吸附量。在本研究中,RCA和SCA的制备过程经过了H3PO4改性,从而去除了大量的阳离子如 Ca2+、Mg2+和 Na+等(图 2),表明阳离子交换作用可能不能很好地解释生物质炭添加对土壤吸附TC的增强效应。然而,H3PO4改性之后增加了RCA和SCA表面的极性官能团(如-OH)(图1),这可能促使RCA和SCA与TC的电负性原子(O、N)形成氢键,从而增强TC在土壤中的吸附[34-35]。另外,RCA和SCA拥有较大的表面积和较为发达的孔隙结构(表2),这可能导致更多的TC被吸附在RCA和SCA的表面或进入到微孔中被固定,进而增加TC在土壤中的吸附量[12]。
3.2 pH对TC吸附的影响
由于TC特殊的两性结构(pKa1=3.3,pKa2=7.7,pKa3=9.7),因此,TC在不同pH条件下的存在形态也不同,具体表现为阳离子态H3TC+(pH<3.3)、中性态H2TC0(3.3<pH<7.7)、阴离子态HTC和TC2(pH>7.7)[36]。另外,土壤表面电荷也可能随着溶液pH值变化而发生改变[31]。因此,土壤对TC吸附量随pH的变化规律可以用TC与土壤之间的离子交换作用、静电吸引或排斥等作用来解释[31,37]。
图5表明各土壤吸附TC的最小值出现在pH 11。在pH 11时,TC以阴离子形式存在,与此同时,土壤表面带负电荷[31,37]。因此,在静电排斥作用下,各土壤对TC的吸附量最低。然而,各土壤对TC吸附的最大值出现的pH却不同。在pH 9时,黄壤土对TC的吸附量最大,其原因可能是在较高pH条件下黄壤土中的金属矿物与TC形成复合体系,从而导致TC吸附量的增加。比如,Zhou Y.Y.等[27]发现在低pH下,Cu2+能抑制土壤对TC的吸附;在pH高于5.5时,Cu2+作为土壤与TC之间的桥梁,促进了土壤对TC的吸附。不同于黄壤土,水稻土与紫色土对zTC吸附的最大量出现在pH 2和3左右。当pH<3时,TC以阳离子形式存在,且水稻土与紫色土的CEC相对较高,因此,阳离子交换作用较强,进而导致TC的吸附量增加。
尽管RCA和SCA添加增加了各黄壤土和紫色土对TC的吸附量,但并未显著地改变TC吸附量随pH变化的规律(图5a和图5c)。然而,RCA和SCA使水稻土吸附TC的最大值从pH 2转变为pH 8和7(图5b),而该pH值与黄壤土和紫色土对TC吸附最大值较为接近。值得注意的是,黄壤土和紫色土均为酸性土壤,而水稻土为碱性土。由此可知,生物质炭的添加可能改变pH对土壤吸附TC的影响。据Chen X.Y.等[31]的研究报道,TC在酸性土壤上的吸附机理主要为疏水作用,而在碱性土壤上的吸附主要为阳离子交换作用。由此推断,RCA和SCA添加可能促使碱性土对TC的主要吸附机理由阳离子交换转变为疏水作用。
如前所述,H3PO4改性导致RCA和SCA的阳离子金属减少,因此,生物质炭的添加对土壤通过阳离子交换作用吸附TC的影响可能不大。另一方面,吸附动力学结果表明土壤和添加生物质炭的土壤对TC的吸附可能主要是以静电作用或共价键等为主的化学吸附,表明静电作用或共价键等作用可能是导致生物质炭改变TC吸附量随pH变化规律的原因。
4 结论
①RCA和SCA添加促使3种土壤吸附TC的平衡时间从2~24 h增加至12~72 h,且增加了对TC的吸附容量。准二级模型和Elovich模型可以较好地拟合吸附动力学数据,表明土壤吸附TC可能主要是以静电作用或共价键等为主的化学吸附。
②RCA和SCA添加导致3种土壤对TC的吸附量增加,且Freundlich模型可以较好地描述TC在土壤上的吸附行为,进一步表明离子交换和络合作用等可能是土壤吸附TC的主要机制。
③RCA和SCA添加并未显著改变黄壤土和紫色土(酸性土壤)中TC吸附量随pH变化的规律,但却改变了水稻土(碱性土壤)中TC吸附量随pH变化的规律,表明RCA和SCA的添加可能更容易改变碱性土对TC的在不同pH下吸附行为。

