胶质瘤组织UCH37表达水平与病人预后的相关性
乔建新 刘熙鹏 段升强 刘 明 曹 兵
胶质瘤是常见的中枢神经系统肿瘤,在脑肿瘤中占比超过50%,约82%为胶质母细胞瘤,具有侵袭性强、复发率高的特点,5年生存率仅4.7 %[1]。胶质瘤发生、进展、复发机制复杂,与多种蛋白、基因改变有关。研究表明,去泛素化酶与泛素化酶相互作用,对癌基因、抑癌基因具有调节作用,参与肿瘤进展[2]。泛素化羧基末端水解酶37(ubiquitin C-terminal hydrolase 37,UCH37)是去泛素化酶的重要组成部分,与多种恶性肿瘤有关[3~5]。本文探讨脑胶质瘤组织UCH37表达变化及其与病人预后的关系。
1 资料与方法
1.1 标本来源 纳入标准:年龄≥18岁,病理证实为脑胶质瘤;手术前后病例资料齐全;精神状态、认知功能正常,能配合检查;知晓研究内容,并签署同意书。排除标准:患有其他部位原发性肿瘤;术前进行放、化疗;既往有颅脑损伤史;患肝、肾、心等脏器疾病。
选取2017年6月至2019年6月手术切除的脑胶质瘤组织104例,其中男55例,女49例;年龄40~73岁,平均(56.49 ±12.15 )岁;肿瘤直径1~6 cm,平均(3.23 ±1.21 )cm;WHO分级Ⅰ级32例,Ⅱ级43例,Ⅲ级29例;星形胶质细胞瘤48例,少突胶质细胞瘤27例,室管膜瘤18例,其他11例;肿瘤全切除49例,非全切除55例;术后放疗81例;发生癫痫20例。选取64例瘤旁组织作为对照。
1.2 免疫组化法检测UCH37蛋白表达水平 组织块制备成石蜡块,切片厚度4μm。脱蜡后,3%过氧化氢灭火内源性酶,PBS清洗3次。用PBS在高压下反应3 min、冷却20 min进行抗原修复。5%胎牛血清封闭10 min,加入一抗4℃下过夜,PBS清洗3次,加入二抗,37℃反应30 min。加入链球菌亲和素(经辣根酶化后)37℃反应30 min,PBS清洗4次。DAB显色,经苏木素复染后,显微镜下观察。
根据文献[6]报道方法判定染色结果:选择高倍镜(×400)4个视野,进行染色计分(无染色、轻微褐色、中度褐色以及深褐色分别计0、1、2、3分)和阳性细胞率计分(阳性细胞≤20%、20%~75%、75%~90%、>90%分别计0、1、2、3分),两项评分的乘积即为目的基因表达分值,0~4分低表达,6~9分高表达。
1.3 qRT-PCR检测UCH37 mRNA表达水平 提取蜡块方标本总RNA,然后逆转录成cDNA,参考说明书进行扩增,反应条件为95℃3 min,95℃20 s,60℃20s,68℃20s,共30个循环。PCR扩增引物由赛默飞世尔公司设计:UCH37上游引物为5'-TGTCTCATGGAAAGCGACCC-3',下 游 为5'-GCCACTTGAAAAGAAAAATTAACCC-3'。以β-actin为内参,上游引物为5'-CGTCTTCCCCTCCATCGT-3',下游为5'-GAAGGTGTGGTGCCAGATTT-3'。通过2-△△Ct值表示UCH37基因相对表达量。
1.4 随访 术后随访18个月,记录生存、死亡情况。1.5 统计学方法 采用SPSS 20.0 软件分析;计数资料行χ2检验;计量资料以表示,用t检验;采用多因素logistic回归分析死亡的危险因素;采用Kaplan-Meier绘制生存曲线;绘制受试者工作特征曲线(receiver operating characteristic,ROC)曲线分析UCH37评估预后的效果;P<0.05 为差异有统计学意义。
2 结果
2.1 脑胶质瘤组织UCH37的表达情况 脑胶质瘤组织UCH37高表达率(59.62%,62/104)明显高于瘤旁组 织(17.19 %,11/64;P<0.05 )。脑 胶 质 瘤 组 织UCH37 mRNA表达量[(2.68 ±0.75 )]明显高于瘤旁组织(0.83 ±0.09 ;P<0.001 )。
2.2 预后影响因素分析104例中,死亡20例,存活84例。单因素分析显示,年龄、肿瘤直径、病理分级、肿瘤切除程度、UCH37表达水平、颅内压增高与术后死亡有关(P<0.05;表1)。多因素logistic回归分析显示,年龄≥60岁、肿瘤直径≥3 cm、病理分级Ⅲ级、肿瘤非全切除、UCH37高表达是脑胶质瘤术后死亡的独立危险因素(P<0.05;表2)。
2.3 UCH37表达水平与病人生存期的关系104例中,UCH37高表达62例,低表达42例。高表达组中位生存期(9个月)较低表达组(13个月)明显缩短(P<0.05,图1)。
2.4 UCH37 mRNA表达量对预后的评估价值ROC曲线分析显示,UCH37 mRNA评估术后病人死亡的最佳界值为2.725 ,曲线下面积为0.797 (95%置信区间0.695 ~0.899 ),敏 感 度 为70.00 %,特 异 度 为70.10%。见图2。
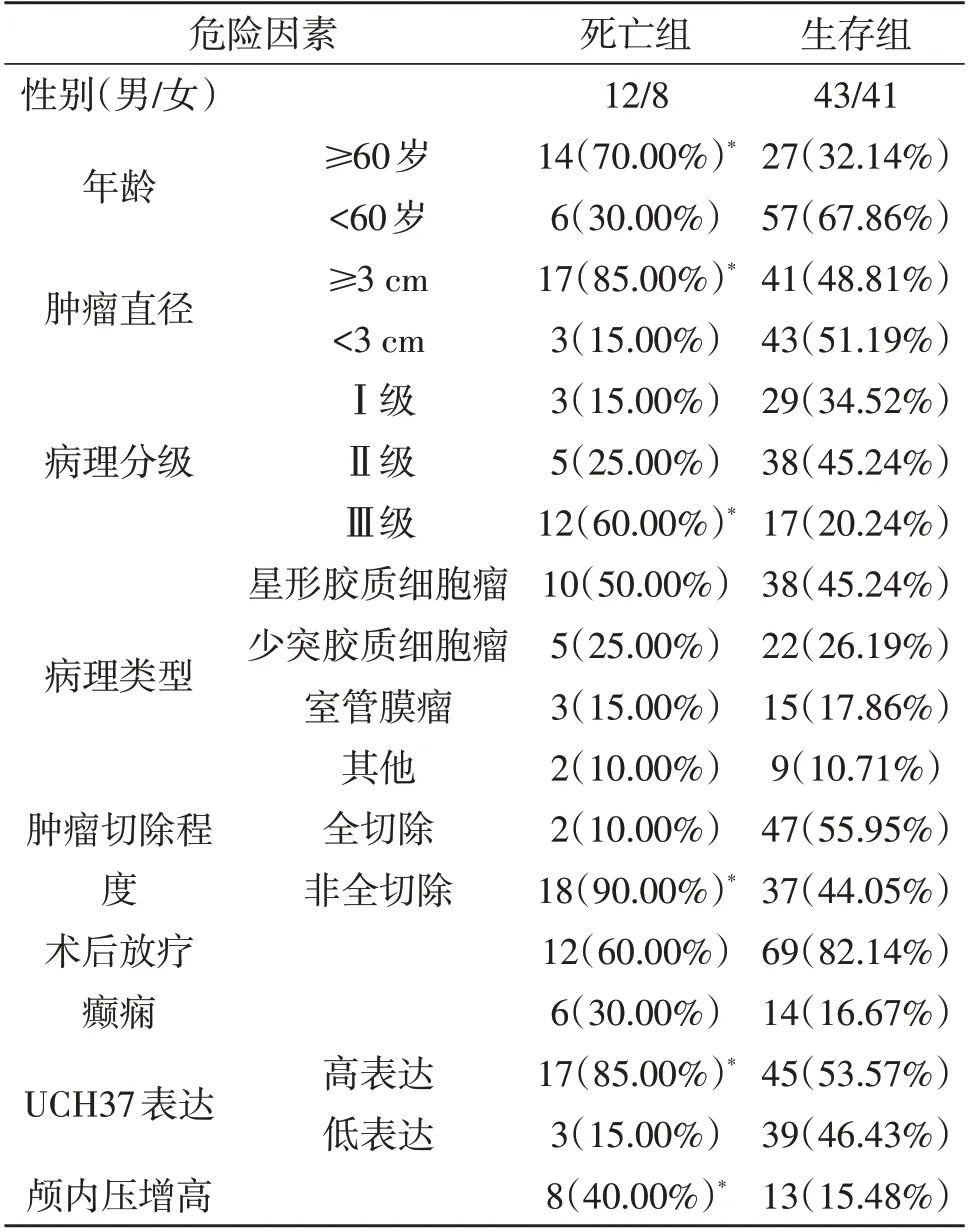
表1 本文104例胶质瘤预后影响因素的单因素分析(例)
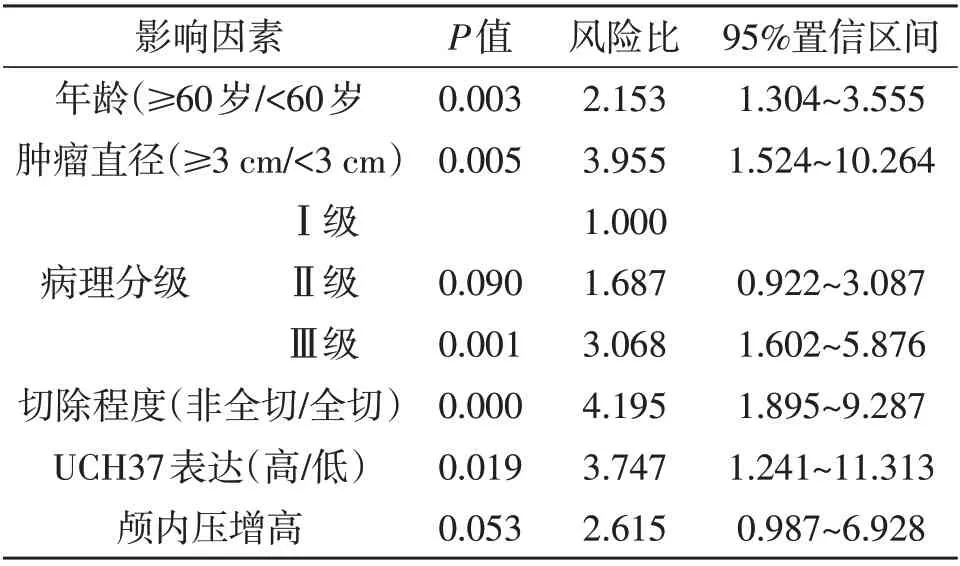
表2 本文104例胶质瘤预后影响因素的单因素Cox比例回归风险模型分析
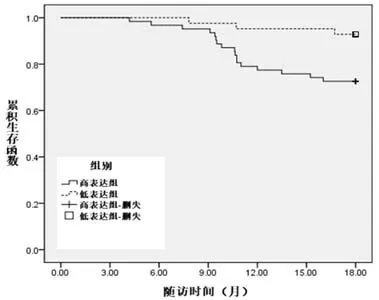
图1 胶质瘤组织UCH37表达水平与病人预后关系的生存曲线分析
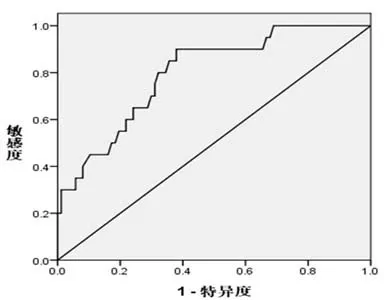
图2 胶质瘤组织UCH37 mRNA水平评估病人术后死亡的ROC曲线
3 讨论
目前,胶质瘤的发病机制尚未彻底明确,但与家族遗传、离子辐射等有关,而肿瘤侵袭机制主要与机体免疫力、肿瘤微环境等有关[7]。脑胶质瘤的手术切除具有一定的难度,部分病人还会出现化疗耐药、放疗抵抗等情况,导致肿瘤复发风险增高,预后欠佳[8]。明确脑胶质瘤进展机制,可为胶质瘤的治疗提供指导。近年来,临床研究认为,UCH37参与肿瘤进展。王丽娟等[9]发现,UCH37在恶性黑素瘤组织中呈高表达,其高表达与淋巴结转移、肿瘤分期密切相关。刘华柱和邓明明[10]研究提示,结肠癌组织UCH37为高表达,对肿瘤细胞增殖有促进作用。本文结果显示,胶质瘤组织UCH37呈高表达。UCH37是泛素羧基末端水解酶家族的一员,能够对蛋白远端的多聚亚基进行拆分,使蛋白质降解受到抑制。研究表明,UCH37能通过阻止泛素化调节因子2与Smad7相结合,抑制二者复合物形成,使Ⅰ型转化生长因子-β(transfor ming growth factor-β,TGF-β)受体免于泛素化,导致TGF-β表达上调[11]。李钦涛等[12]研究显示,恶性胶质瘤组织TGF-β表达水平较瘤旁组织明显增高。另有学者发现,正常脑组织无TGFβ表达或表达量极低,而脑胶质瘤可见TGF-β过表达,PI3K、Smad等信号通路发生变异后,能诱导TGF-β促进肿瘤细胞分化、增殖,增强胶质瘤的侵袭性与恶变程度[13]。这提示胶质瘤UCH37过表达,可能通过上调TGF-β表达,促进胶质瘤发生、进展。
UCH37对脑胶质瘤预后有较大影响。本文结果显示,UCH37高表达是脑胶质瘤病人术后死亡的独立危险因素,而且UCH37高表达病人生存期明显缩短,胶质瘤组织UCH37 mRNA水平对预后评估效果较好。这表明UCH37与脑胶质瘤预后有关。UCH37促进肿瘤细胞增殖的机制可能与其底物相结合有关,促使泛素分子水解,与之结合的底物包括转录因子、酶等,部分底物是抑癌基因或癌基因产物,一旦UCH37与癌基因底物结合,则能促进肿瘤细胞增殖,抑制肿瘤细胞凋亡,导致病情进一步恶化,增加死亡风险[14]。研究表明,UCH37可以对Tcf7DNA结合通路进行调控,使Wnt信号通路活化,发挥促肿瘤进展作用[15]。这表明UCH37高表达能加速肿瘤恶化,这对病人预后不利。
综上所述,脑胶质瘤组织UCH37呈高表达,是影响术后病人死亡的独立危险因素,临床可通过测定UCH37水平对预后进行预测。

