重组猪α干扰素的安全性及体外抗病毒效果评价
刘延亭 ,宫瑞雪 ,张美美 ,代发文,赵宝凯
(1.北京大伟嘉生物技术股份有限公司 100091;2. 沧州伟嘉畜牧有限公司 061199;3. 乐山师范学院 614099;4. 沈阳伟嘉牧业技术有限公司 110144 )
干扰素( Interferon,IFN) 是一种由同属动物细胞产生,具有抗病毒作用的分泌性糖蛋白,目前被认为是先天免疫反应的重要组成部分,也是病毒感染的第一道防线[1]。IFN 因在抗病毒、免疫调节、抗肿瘤等方面具有较好的效果被视为人和动物某些疾病和病毒感染的首选治疗性药物,特别是近些年在治疗严重急性呼吸综合征(SARS)和新型冠状病毒[2-3](2019-nCoV)上面显示出的突出效果,已越来越受到科学家们的重视。猪伪狂犬病毒(PRV)、猪流行性腹泻病毒(PEDV)和猪繁殖与呼吸综合征病毒(PRRSV)是目前除非洲猪瘟病毒外,威胁我国猪群健康的三个最主要病毒,虽然市场上有较多疫苗种类可供选择,但仍然无法阻止猪场,特别是小规模猪场不定时疫病的暴发,尤其是冬季的PEDV,已对很多养殖场造成了严重的经济损失。因此,在使用疫苗正常免疫的同时,研究相关抗病毒细胞因子的抗病毒效果就显得很有必要,而猪Ⅰ型干扰素中IFN-α因能诱导启动全身性和系统性的先天性免疫反应[4],已成为多数养殖人的第一选择。
1 材料与方法
1.1 材料
1.1.1 菌株 猪α干扰素原核重组表达载体pET-32a-PoIFN-α,为本公司实验室构建、保存。
1.1.2 病毒 水泡性口炎病毒(VSV)、猪伪狂犬病毒(PRV)、猪流行性腹泻病毒(PEDV)NB株、猪繁殖与呼吸综合征病毒(PRRSV)等均为本实验室保存。
1.1.3 细胞 MDBK细胞,购自中国兽医药品监察所。ST、PK15、vero、Marc145细胞均为本试验保存。
1.1.4 其他试剂 胎牛血清(FBS)和DMEM高糖培养基,均购自Gibco公司;内毒素去除试剂盒和内毒素凝胶法检测试剂盒,均购自南京金斯瑞生物科技有限公司;酵母粉、胰蛋白胨购自OXIOD公司;镍胶购自康为世纪有限公司;Tris、氯化钠等购自国药。
1.2 方法
1.2.1 重组蛋白表达与纯化 将含pET-32a-PoIFN-α的菌种按培养基总体积的0.5%接种LB液体培养基,同时加入终体积100μg/ml的氨苄青霉素, 37℃、200 r/min培养至菌液OD600nm达0.4~0.6左右时,加入IPTG至终浓度为0.5mM,28℃、200 r/min诱导过夜,收集菌体。离心获得的沉淀用pH7.9的Tris-HCl缓冲液重悬,超声破碎后再次离心,上清液用0.45μm滤器过滤,按照亲和层析镍柱纯化说明书进行纯化,洗脱液进行SDS-PAGE测定纯度。
1.2.2 内毒去除与生物学活性检测 将目的蛋白洗脱液经ToxinEraserTM树脂吸收后,再洗脱浓缩,用ToxinSensor™凝胶法内毒素检测试剂盒检测样品中的内毒素含量。并参考《中国药典(2010版)》附录“干扰素生物学活性测定法(细胞病变抑制法)”,以牛肾细胞(MDBK)和水泡性口炎病毒(VSV)为评价体系,测定纯化重组蛋白PoIFN-α的生物学活性。
1.2.3 安全性测定 采用小鼠试验法,每批样品用5只小鼠,注射前每只小鼠称体重,应为18~22g。每只小鼠腹腔注射供试品0.5mLl,观察7d。观察期内,小鼠应全部健存,且无异常反应,到期时每只小鼠体重均应增加,同时设注射DMEM工作液对照组。
1.2.4 体外抗病毒效果评价
1.2.4.1 培养细胞 用含10%FBS的DMEM工作液分别稀释ST、Marc145和Vero细胞消化液,调整细胞浓度为105/mL,各接种于96孔细胞培养板中,每孔100μLl,于37℃、5%二氧化碳条件下培养6h。
1.2.3.2 干扰素稀释 用含7%FBS的DMEM工作液将去除内毒素的重组PoIFN-α做10-1、10-2、10-3、10-4稀释。
1.2.3.3 接种干扰素 弃去96培养板内培养液,加入干扰素稀释液,每孔100μL,每个稀释度做6个重复,同时设阴性和病毒阳性对照,37℃、5%二氧化碳条件下继续培养18h。
1.2.3.4 病 毒 稀 释 用 含2%FBS的DMEM工 作 液 分别 稀 释PRV、PRRSV和PEDV至 预 定 浓 度,即PRV至100TCID50/0.1mL、PRRSV至100TCID50/0.1mL、PEDV至100TCID50/0.1mL。
1.2.3.5 接种病毒 弃去96孔培养板内上清液,每孔分别加入100μl各病毒稀释液,阴性对照孔加入100μL 含2%FBS的DMEM工作液,于37℃、5%二氧化碳条件下培养24~48h。
1.2.3.6 观察病变情况,记录结果。
2 试验结果
2.1 重组纯化蛋白检测结果 重组蛋白用SDS-PAGE电泳结合Bio-Rad Image Lab软件确定蛋白纯度。样品上样量不低于1μg,经SDS-PAGE电泳、染色和脱色之后,电泳胶上均只有与目的蛋白分子量相符的条带,看不到明显的杂蛋白条带,且Image Lab软件分析的纯度均在90.0%以上,测定结果见图1。
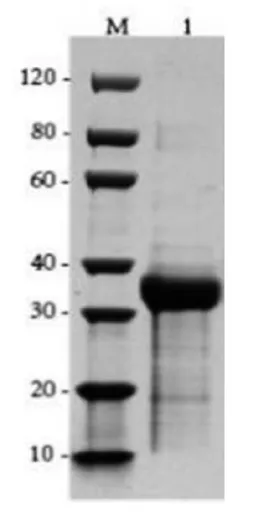
图1 PoIFN-o重组蛋白纯度SDS-PAGE鉴定图
2.2 内毒素及生物学活性测定结果 经ToxinSensor™凝胶法内毒素检测试剂盒检测,去内毒素样品纯化液中的内毒素含量为50EU/mL;经细胞病变抑制法测定生物学活性为1.4×109.0U/mL。
2.3 安全性测定结果 试验组5只小鼠,试验过程当中,体重均有增加,证明纯化的重组PoIFN-α蛋白对动物安全,与对照组无差异。具体结果见表1。
表1 安全性测定结果统计表
2.4 体外抗病毒效果评价结果 重组PoIFN-α蛋白体外抗病毒观察结果,具体见表2。从结果可知,在体外,重组PoIFN-α蛋白对PRV、PRRSV和PEDV均有一定的抑制或延缓病毒增殖的效果。其中,对PEDV的抑制效果最好,重组蛋白即使1000倍稀释仍然能够完全抑制PEDV的增殖;重组蛋白高浓度(10倍稀释)时,对PRRSV也具有完全抑制其增殖的效果。

表2 重组PoIFN-α蛋白体外抗病毒效果评价汇总结果
3 讨论
干扰素是所有抗病毒药物中最为广谱、高效、生物学活性广泛的特效治疗性药物。除了日常临床中应用于抗病毒作用外,还具有调节动物机体免疫应答,增强细胞和体液免疫反应的特点,可以刺激多种免疫细胞如NK 细胞、T 细胞、巨噬细胞的产生,如用作灭活疫苗佐剂或免疫增强剂[5-7],对于疫苗的免疫效果具有正向的促进作用。考虑到通过基因工程手段获得的猪用干扰素无论是含量或是活性,均高于机体受病毒或其他干扰素诱生剂刺激产生的干扰素,因此重组猪α干扰素具有极大的研究及推广潜力。

