营养不良对腹膜透析患者生存及心功能的影响*
区景运,关素娟,苏惠姬,张海红,谭晓军,彭 璇
(1.广东省开平市中心医院肾内科 529300;2.广州医科大学附属第二医院肾内科,广州 510260)
近年来,我国终末期肾脏病(end-stage renal disease,ESRD)患者数量约100~200万,已成为重要的公共卫生健康问题。腹膜透析是ESRD主要的替代治疗方式之一,具有简单便捷、居家治疗、安全有效等优势。全国透析登记系统数据显示,我国腹膜透析患者在2018年底已超过86 000例[1]。随着腹膜透析技术的不断发展和进步,患者的生活质量及存活率得到提高,腹膜透析相关的急性并发症、技术失败的发病率明显下降,但慢性及远期并发症的发生率也同时增高,腹膜透析患者的长期生存率仍远低于一般正常人群,而心血管疾病是透析患者死亡的首要原因。
既往研究提示,营养不良是腹膜透析最常见的并发症之一[2]。很多因素均可造成腹膜透析患者营养不良,包括能量和蛋白质的摄入不足[3],蛋白质丢失增多,透析充分性不足造成的毒素潴留及微炎症状态,以及精神、经济压力导致焦虑[4]、抑郁情绪所致的食欲减退。据报道,在我国腹膜透析人群中,营养不良的发生率为18%~75%。其中,老年患者营养不良的发病率明显高于青年患者[5]。国际肾脏营养与代谢协会专家将慢性肾脏病营养不良状态命名为“蛋白质-能量消耗”(protein-energy wasting,PEW)。既往在维持性血液透析人群中进行的研究发现PEW的比例高达75%,而腹膜透析患者80%~85%存在不同程度的PEW,与住院率和死亡率密切相关,严重影响患者的生存预后[6]。本研究将探讨营养不良对持续性非卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)治疗患者预后及心脏结构和功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月1日至2018年12月31在开平市中心医院行CAPD治疗并规律随访的130例患者为研究对象。根据PEW诊断是否患有营养不良分为非营养不良组(n=88)和营养不良组(n=42)。纳入标准:(1)年龄大于或等于18岁;(2)规律CAPD时间大于或等于3个月;(3)签署书面知情同意书。排除标准:(1)既往肾移植或维持性血液透析病史(≥3个月);(2)合并恶性肿瘤患者;(3)急性心力衰竭及明显水肿患者;(4)数据缺失者;(5)合并心脏瓣膜病、心肌梗死者。
1.2 方法
1.2.1相关定义与公式
(1)PEW诊断标准:①血清生化指标:清蛋白小于38 g/L,前清蛋白小于0.3 g/L,总胆固醇小于1 g/L。②体重:BMI<23 kg/m2;3个月体重下降超过5%,或6个月体重下降超过10%;机体总脂肪含量小于10%。③肌肉量:肌肉消耗,即3个月肌肉量减少超过5%,或6个月减少超过10%;上肢中部肌围减少大于10%(相对于正常人群的中位水平);净生成肌酐水平,即测定24 h尿肌酐或滤器后透析液中的肌酐,受肌肉量和饮食中肉类量的影响。④饮食摄人:透析患者饮食中的蛋白质摄入小于0.8 g·kg-1·d-1或CKD 2~5期患者饮食中蛋白质摄入小于0.6 g·kg-1·d-1(至少持续2个月);能量摄入小于25 kcal·kg-1·d-1(至少持续2个月)。以上4条标准至少满足3条,且每条中至少满足1个点。(2)糖尿病诊断标准:空腹血糖大于或等于7.0 mmol/L或餐后血糖大于或等于11.1 mmol/L或使用降糖药/胰岛素控制血糖。(3)心脑血管疾病合并症:心绞痛、心肌梗死、冠状动脉搭桥术、血管成形术、慢性心力衰竭、脑梗死、脑出血、外周血管疾病史。(4)心血管相关死亡:由于急性心肌梗死、充血性心力衰竭、心搏骤停、心律失常、脑出血、脑梗死、外周血管疾病导致的死亡[7]。(5)尿素总清除率(Kt/Vurea):Kt/Vurea=7×(腹膜尿素清除指数+残肾尿素清除指数)。(6)残余肾小球滤过率(rGFR):rGFR=(肌酐清除率+尿素清除率)/2。
1.2.2资料收集
(1)所有腹膜透析患者均使用百特公司生产的双袋CAPD系统,每天接受腹膜透析液2 000 mL×4袋的透析治疗,记录患者初始接受CAPD治疗3个月后的基线资料,包括人口学资料、原发病(是否合并糖尿病及心血管疾病)、临床及实验室检查结果[血红蛋白、清蛋白、总胆固醇、三酰甘油、超敏C反应蛋白(hs-CRP)]等资料。(2)所有患者在CAPD治疗后6个月行心脏彩色多普勒超声检查,测量左心室舒张末期内径(LVEDd)、左心室后壁厚度(LVPW)、室间隔厚度(IVSTd)和射血分数(EF)。所有患者均随访至死亡、或退出腹膜透析、或转至其他中心,随访时间截至2018年12月31日。
1.3 统计学处理
2 结 果
2.1 两组一般资料比较
两组性别、合并糖尿病比例、清蛋白、总胆固醇、hs-CRP、Kt/Vurea、rGFR比较,差异有统计学意义(P<0.05),见表1。
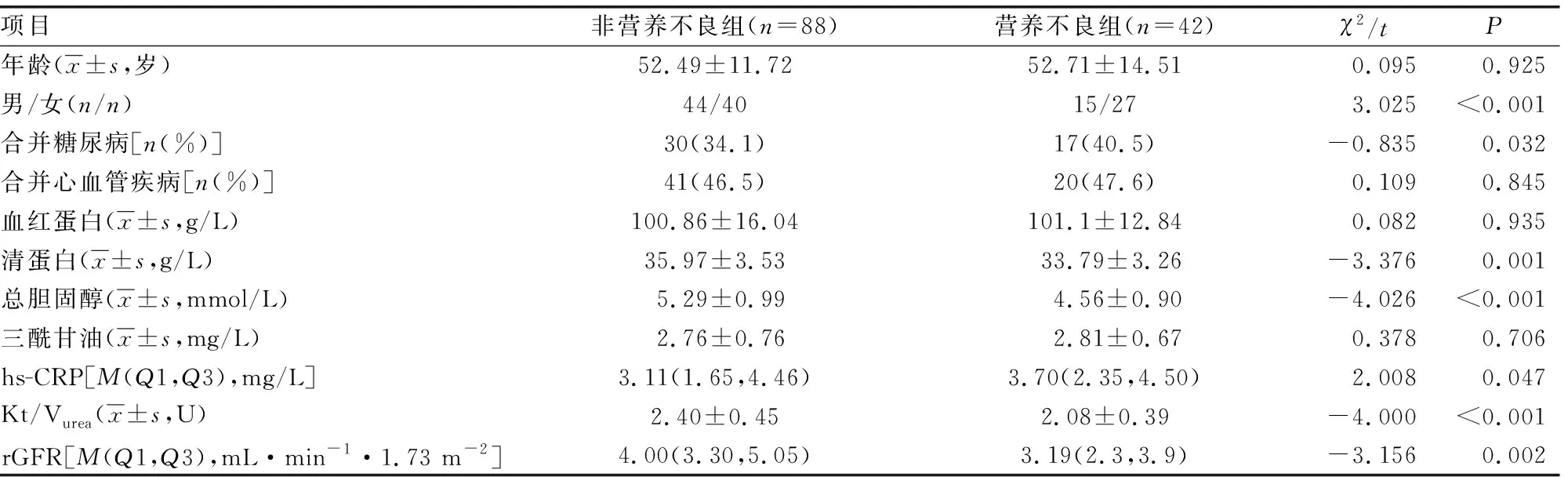
表1 两组一般资料比较
2.2 患者转归情况
经过36.4个月中位随访后共28例(21.0%)患者死亡,其中19例(67.8%)死于心脑血管疾病,5例(18.7%)死于感染相关性疾病,2例(7.1%)因其他原因死亡(包括恶液质、消化道出血、恶性肿瘤、多器官衰竭等),2例(7.1%)死亡原因不明。
2.3 PEW与腹膜透析患者全因死亡及心血管死亡关系分析
Kaplan-Meier生存曲线分析显示营养不良组全因死亡率及心血管死亡率均较非营养不良组升高(P<0.05),见图1、2。

图1 腹膜透析患者全因死亡生存曲线图
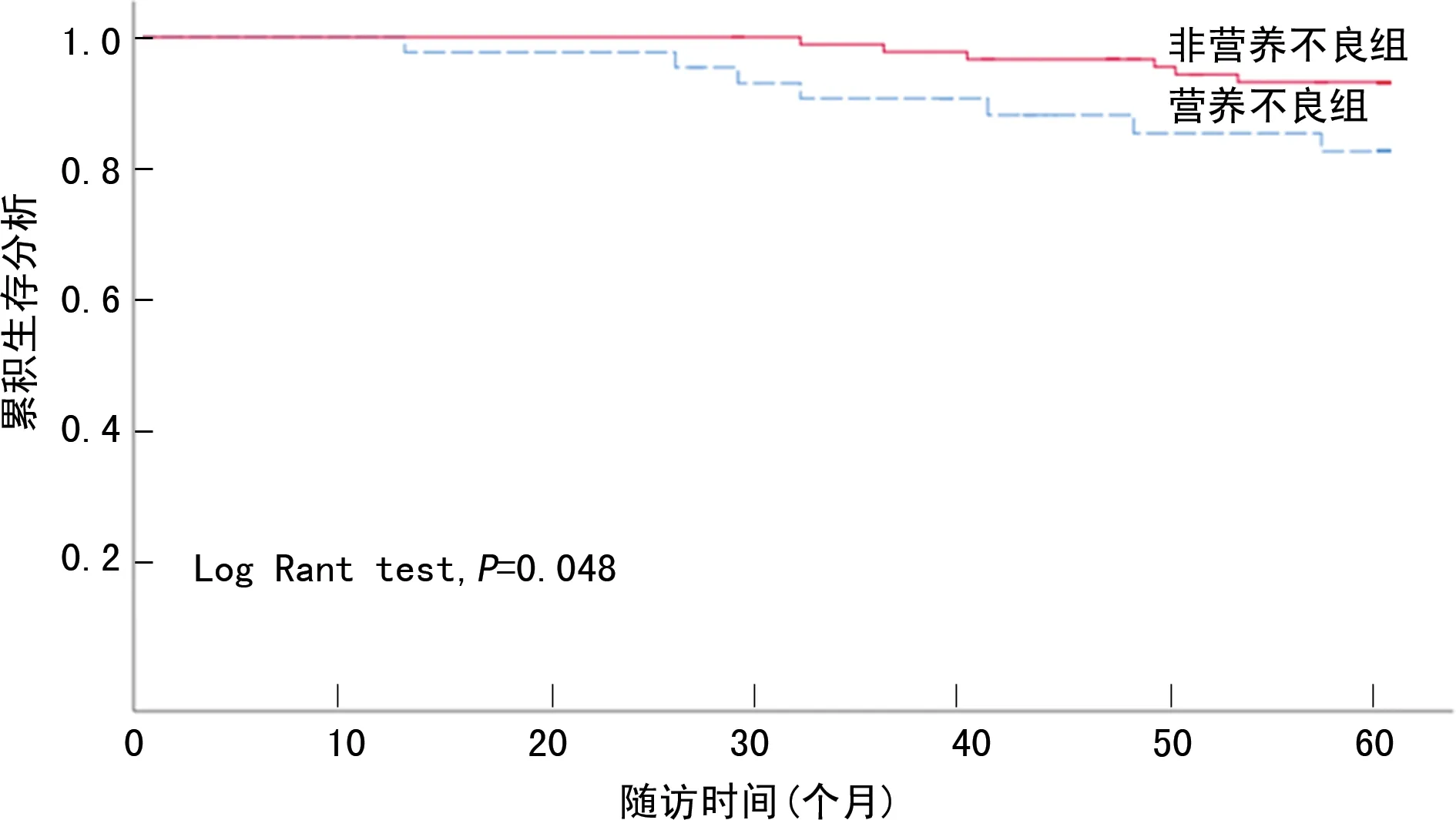
图2 腹膜透析患者心血管死亡生存曲线图
2.4 两组心脏结构和功能比较
腹膜透析后6个月,与非营养不良组比较,营养不良组LVEDd增厚,EF下降,差异有统计学意义(P<0.05),见表3。

表2 两组心脏结构和功能比较
3 讨 论
近年来,研究发现在接受维持性透析的ESRD患者人群中,PEW的发生率逐年提高,据报道,国内维持性血液透析患者PEW的发生率为39.1%,其严重程度与患者预后密切相关,而腹膜透析较血液透析能够更好地保护残余肾功能,滤过大分子的炎性因子,改善患者的营养状况。与之前的研究结果相似,本研究结果也显示CAPD患者中仍存在较高的营养不良发生率(32.3%),而透析龄长、低蛋白血症、透析不充分、微炎症状态是透析患者发生营养不良的危险因素。本研究数据显示,与非营养不良组比较,营养不良组年龄更大,合并糖尿病的比例更高,清蛋白、总胆固醇、Kt/Vurea及rGFR更低,而hs-CRP水平更高。究其原因,可能因为PEW的发生主要由于蛋白质摄入不足、营养物质丢失过多、脂质合成和分解代谢失衡、残余肾功能下降、炎症状态等多方面的原因引起。而多项研究均发现,糖尿病肾病患者PEW发生率高,考虑与胰岛素抵抗、肌肉蛋白分解加快等相关。
国内外现有的研究结果表明,营养不良与透析患者的预后相关,本研究也印证了相同的结果,营养不良组全因死亡率较非营养不良组高(P<0.05)。结合既往研究及两组基线资料,考虑与患者的心理状态、电解质代谢紊乱、年龄等因素密切相关。例如,抑郁症患者及老年患者的营养不良的发病率更高[8-9],而营养不良可能引起低钾、低镁等电解质紊乱,影响患者预后。更为重要的是,大量研究已证明,心血管疾病是ESRD患者的主要并发症,同时也是ESRD患者死亡的首要原因[10],在本研究中,存在PEW的腹膜透析患者较不存在PEW的腹膜透析患者心血管死亡率更高,进一步分析两组心脏的结构及功能,结果发现与非营养不良组比较,腹膜透析后6个月营养不良组LVEDd增厚、EF下降。许多研究都认为左心室肥大是透析患者预后不良的有力预测指标[11]。在腹膜透析人群中,营养不良、微炎症状态及心血管疾病之间密不可分,互为因果,是腹膜透析患者全因死亡及心血管死亡的独立危险因素。究其原因,一方面,存在心血管疾病的患者也更容易出现营养不良,例如心力衰竭患者常出现呼吸困难,用力呼吸会消耗大量的能量,同时肠道水肿及肝功能受损亦会引起患者恶心、纳差,并导致营养物质的吸收不良;另一方面,蛋白质及能量供给不足也会影响到心肌细胞的能量供给,导致细胞收缩功能下降[12-13]。
有学者提出,针对PEW的治疗应从多方面进行,包括加强饮食指导、口服营养剂等方式进行营养补充[14-15]。在维持性血液透析人群中,存在吞咽困难、厌食及口服营养剂不耐受的患者,可选择鼻肠管等方式进行肠内营养,但该方式在腹膜透析患者人群中是否同样适用,仍待进一步研究。此外,运用氨基酸腹膜透析液、适当的体育锻炼也被认为可在一定程度增加患者的蛋白质合成,更好地维持肌肉含量,进而改善患者营养不良的状态。
综上所述,腹膜透析患者PEW发病率高,与患者长期预后密切相关,应给予足够的重视,早期进行筛查,定期进行评估,并尽早采取手段进行干预治疗。

