CIP2A和FOXA1在直肠癌中的表达关系及诊断价值*
靳迎春,周 津,崔 颖
(新疆军区总医院消化内科,乌鲁木齐 830000)
直肠癌是世界范围内较为常见的恶性肿瘤之一,近年来,中国的直肠癌发病率、病死率均有所上升[1]。因此,早诊断、早治疗对于直肠癌患者具有重要的临床意义。蛋白磷酸酶2A癌性抑制因子(CIP2A)是一种普遍存在于恶性肿瘤中的致癌因子[2],报道称,CIP2A可与癌转录因子c-Myc蛋白特异性结合,抑制c-Myc蛋白水解,促进细胞增殖及恶性转化,加速体内肿瘤形成[3]。叉头盒蛋白(FOXA1)是转录因子FOX家族成员之一,最早在果蝇体内发现[4],后发现其可与新陈代谢相关基因的启动子结合,在调控癌细胞信号通路和活性方面发挥重要作用[5]。有研究发现,FOXA1在乳腺癌中通过抑制上皮间质转化作用参与癌症的发展过程,在乳腺癌组织中阳性表达率降低预示预后良好[6]。有关CIP2A、FOXA1在直肠癌中的研究国内外鲜有报道,因此,本研究通过检测CIP2A、FOXA1在直肠癌患者组织中的表达水平,分析二者与临床病理间的关系,预测其对直肠癌的诊断价值,以期为临床诊断提供新的指导依据。
1 资料与方法
1.1 一般资料
选取2017年6月至2019年9月在本院胃肠肿瘤外科诊治的63例直肠癌患者为研究对象,其中男41例,女22例,年龄31~76岁,平均(57.81±6.43)岁。所有患者均获病理诊断,且行直肠癌根治术。收集癌组织和癌旁组织标本,标本采集方法:癌组织取自癌中心部位,癌旁组织取自距肿瘤边缘5 cm处肉眼可见无瘤组织,组织大小约为1 cm×1 cm×1 cm,所有组织采集后贴好标签均置于液氮中保存。
纳入标准:(1)术前未经化疗或放疗处理;(2)均为首次治疗;(3)非急诊手术病例;(4)临床资料完整。排除标准:(1)合并严重心、肝、肾等重要脏器损害者;(2)严重基础代谢疾病患者;(3)合并传染性疾病患者;(4)合并精神障碍、癔症等。患者及家属均知情同意本次研究并自愿签署知情同意书。本研究获得本院伦理委员会审核批准。
1.2 材料与试剂
免疫组织化学试剂盒、DBA染色剂购自上海古朵生物科技有限公司,兔抗人CIP2A多克隆抗体、兔抗人FOXA1多克隆抗体均购自北京索莱宝科技有限公司;TRIzol试剂、反转录试剂盒、PCR扩增试剂盒购自北京博奥森生物科技有限公司。
1.3 方法
1.3.1细胞培养
人直肠癌细胞系SW480、SW620、HCT-15细胞及HIEC健康人肠上皮细胞株购自中国科学院细胞库,用含10%胎牛血清的RPMI-1640培养液(美国Gibcp公司)置于含体积分数5% CO2的37 ℃培养箱中进行培养,每1~2天传代1次,传代时吸取瓶中培养液,轻轻吹打瓶壁,使细胞脱落形成单个细胞悬液,取对数期细胞进行检测。
1.3.2免疫组织化学法检测CIP2A和FOXA蛋白表达
本研究采用免疫组织化学法,用癌旁正常直肠组织做阴性对照,操作步骤严格按照说明书进行。在低倍镜下选择3个不重复的视野,在高倍镜下计数100个细胞中阳性细胞所占比例,取3个视野作平均值。
采用半定量方法对CIP2A、FOXA1阳性结果进行判定:按细胞染色强度计分:细胞未着色计0分,淡黄色计1分,棕黄色计2分,棕黑色计3分;按阳性细胞所占百分比计分:阳性细胞为0计0分,<25%计1分,25%~50%计2分,>50%计3分。染色强度与阳性细胞所占百分比乘积≥2分判定为免疫组织化学阳性(+),否则为阴性(-)。
1.3.3实时荧光定量反转录-聚合酶链式反应(qRT-PCR)检测CIP2A和FOXA1 mRNA的相对表达水平
利用qRT-PCR检测CIP2A和FOXA1的mRNA表达水平。取液氮保存的组织50~100 mg研磨,或取各组细胞,加入TRIzol溶液1 mL裂解,提取总RNA。利用NanoDropND-1000分光光度仪(NanoDrop Tech,美国)检测RNA浓度。使用PrimeScript RT反转录试剂盒将RNA反转录为cDNA,反转录试剂盒、PCR扩增试剂盒均严格按照说明书操作步骤执行。CIP2A和FOXA1均以GAPDH为内参。引物序列由生工生物工程公司合成,见表1。用2-ΔΔCt法计算CIP2A和FOXA1 mRNA表达水平。

表1 引物序列
1.4 统计学处理
2 结 果
2.1 直肠癌组织和癌旁组织中CIP2A和FOXA1表达情况比较
CIP2A和FOXA1在直肠癌组织中的阳性表达率分别为82.54%(52/63)和80.95%(51/63),明显高于癌旁组织的12.70%(8/63)和11.11%(7/63),差异有统计学意义(P<0.05)。见图1、表2。
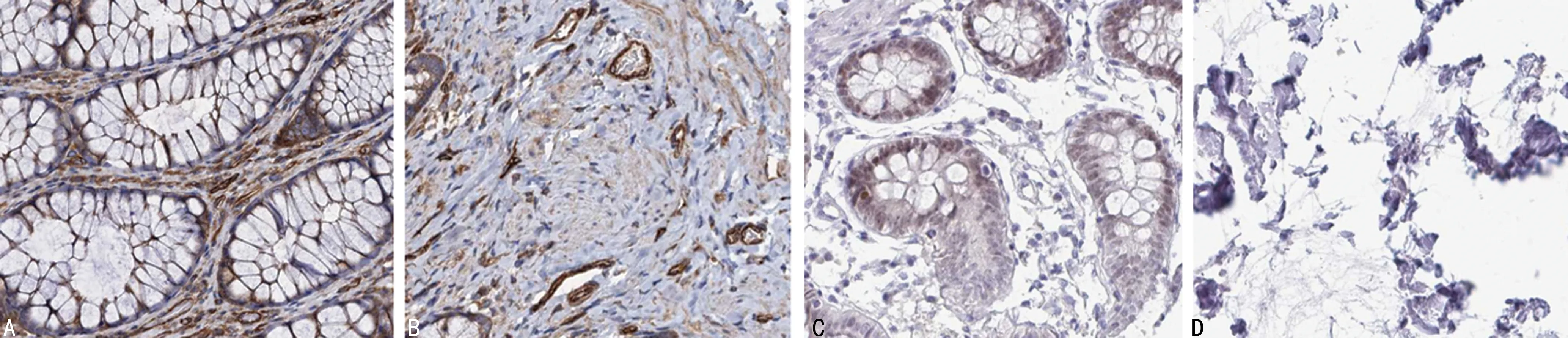
A:CIP2A在癌旁组织中的表达;B:CIP2A在直肠癌组织中的表达;C:FOXA1在癌旁组织中的表达;D:FOXA1在直肠癌组织中的表达。

表2 人直肠癌细胞及健康人肠上皮细胞中CIP2A、FOXA1 mRNA及蛋白的表达
2.2 人直肠癌细胞及健康人肠上皮细胞中CIP2A、FOXA1 mRNA及蛋白的表达
CIP2A、FOXA1 mRNA及蛋白在人直肠癌细胞中的表达水平均明显高于健康人肠上皮细胞(P<0.05),在不同株癌细胞中的表达差异无统计学意义(P>0.05),见表2、图2。
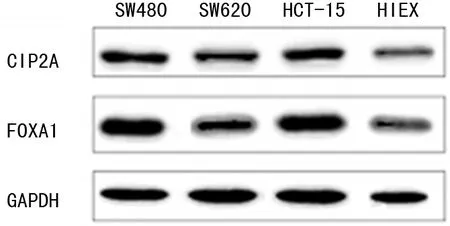
图2 人直肠癌细胞及健康人肠上皮细胞中CIP2A、FOXA1的表达情况
2.3 CIP2A和FOXA1表达水平与直肠癌患者临床病理特征的关系
CIP2A和FOXA1表达水平与患者年龄、性别、肿瘤大小无关(P>0.05),与TNM分期、分化程度和淋巴结是否转移有关(P<0.05),见表3。
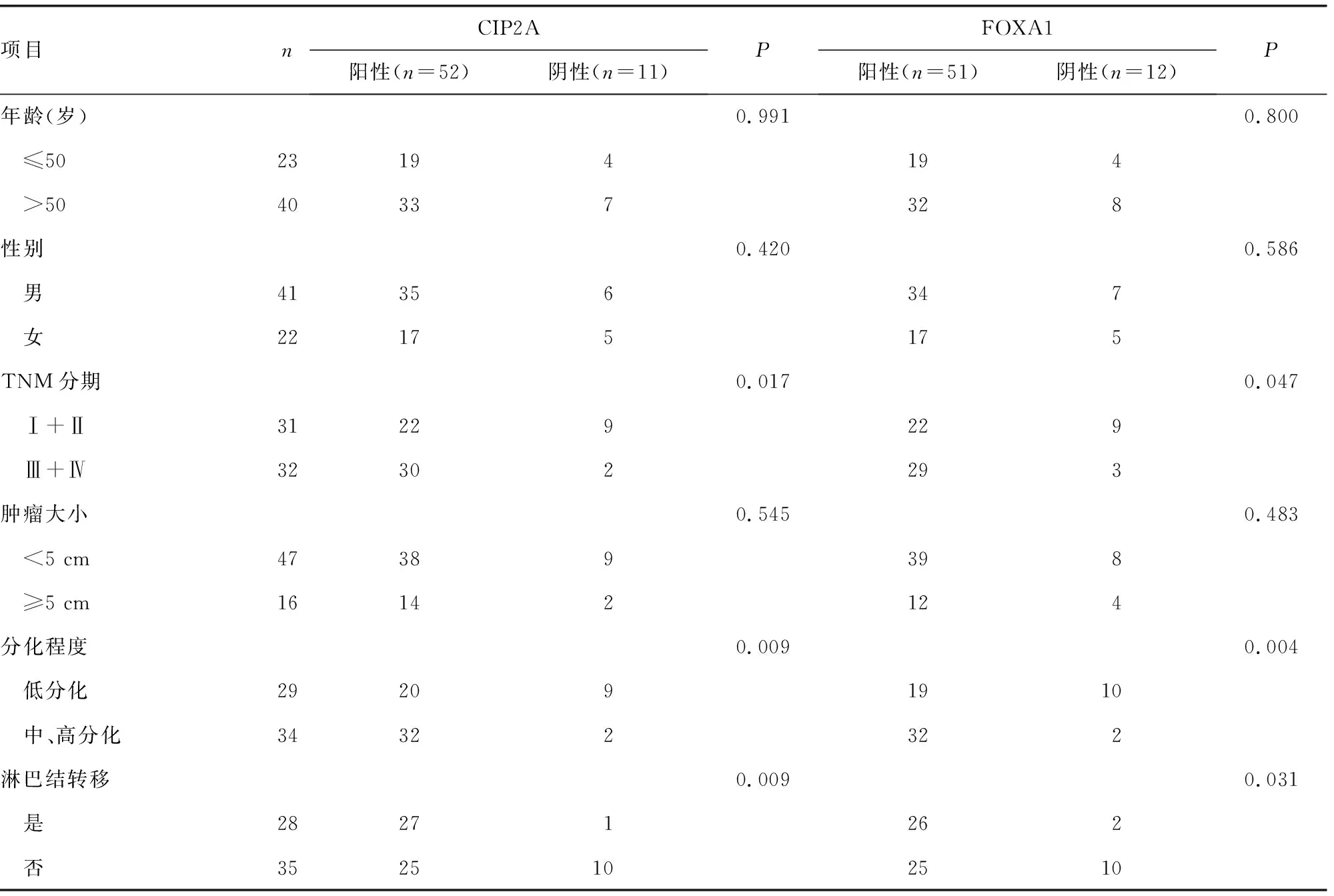
表3 CIP2A和FOXA1表达水平与直肠癌患者临床病理间的关系(n)
2.4 直肠癌组织和癌旁组织中CIP2A和FOXA1 mRNA表达水平
直肠癌组织中CIP2A和FOXA1 mRNA表达水平均显著高于癌旁组织(P<0.05),见表4。

表4 直肠癌组织和癌旁组织中CIP2A、FOXA1 mRNA表达水平比较
2.5 CIP2A和FOXA1对直肠癌的诊断价值
ROC曲线结果显示,CIP2A诊断直肠癌的曲线下面积(AUC)为0.854(95%CI:0.781~0.911),截断值为1.40,约登指数为0.651,其灵敏度、特异度分别为66.67%、91.84%;FOXA1诊断直肠癌的AUC为0.904(95%CI:0.839~0.950),截断值为1.19,约登指数为0.667,其灵敏度、特异度分别为84.13%、82.54%;两者联合诊断直肠癌的AUC为0.936(95%CI:0.905~0.958),约登指数为0.794,其灵敏度、特异度分别为92.06%、87.30%。见图3。
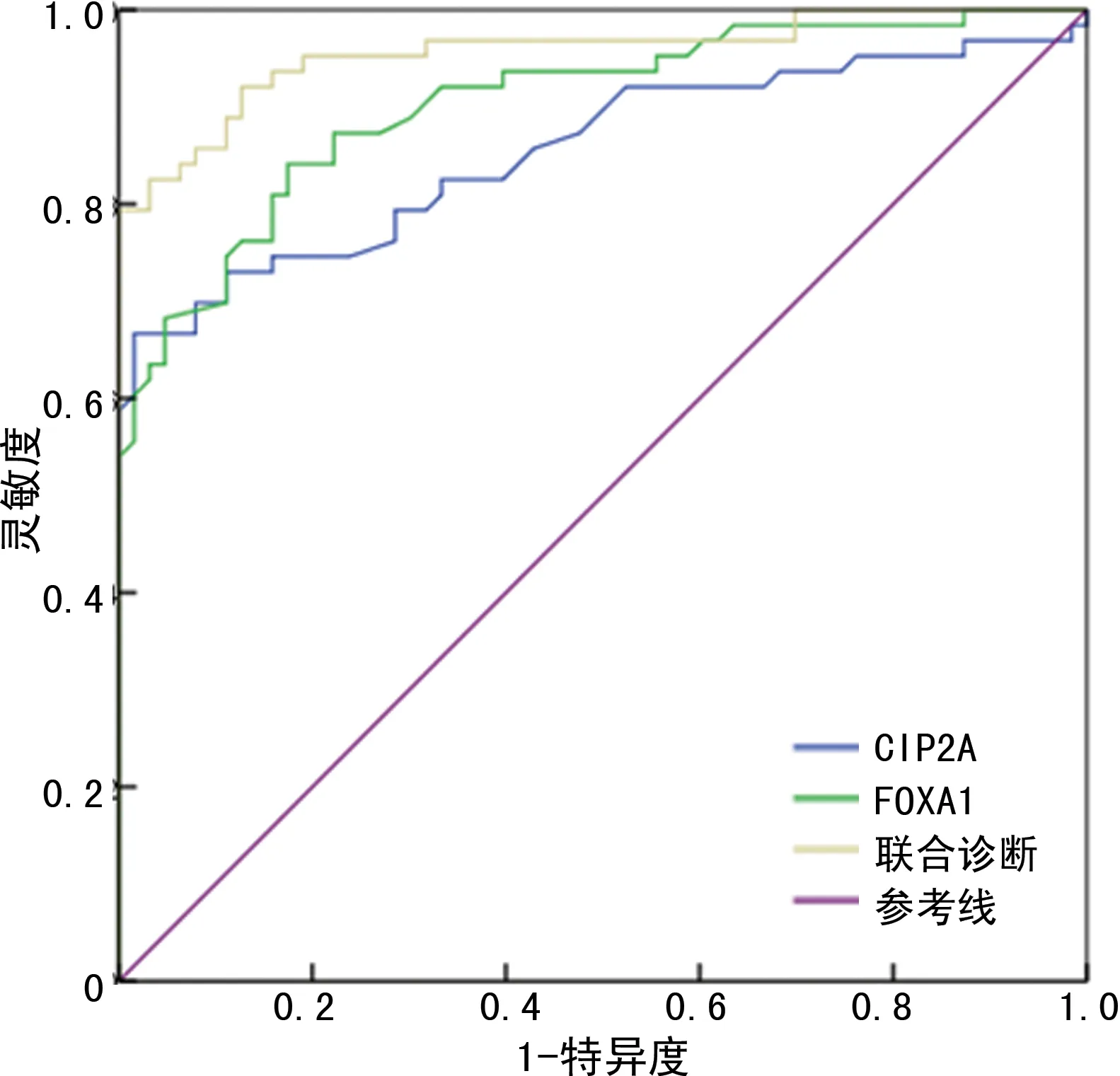
图3 CIP2A、FOXA1诊断直肠癌的ROC曲线
3 讨 论
直肠癌是一种常见恶性肿瘤,手术切除是临床上常用的治疗方法,但术后患者易发生远处转移,复发率较高,预后差[7]。因此,寻找有效标志物评估患者病情对临床诊断和治疗干预具有重要意义。
CIP2A由KIAA1524基因编码,该基因位于3号染色体上,由21个外显子组成,主要在细胞质中表达[8]。报道称,CIP2A在正常肠组织或黏膜中不表达或低表达,在肠癌等肿瘤疾病中高表达[9]。黄文峰等[10]研究发现,CIP2A在大肠癌组织中表达阳性率为66.33%,与大肠癌TNM分期呈正相关,COX回归分析显示其高表达可能是评估患者预后不良的独立危险因素,提示CIP2A可作为监测及判断大肠癌预后的指标。戈锐等[11]研究表明,结直肠癌患者癌组织中CIP2A及c-Myc表达均升高,并揭示了其促肿瘤生长的可能途径,可能与细胞周期调控蛋白基因的遗传性改变有关。大量研究表明,CIP2A作为肿瘤抑制因子,通过与其对应靶基因共同作用,减少细胞生长阻滞,过表达可能促进细胞增殖、分化[11]。本研究结果显示,CIP2A在直肠癌组织中的阳性表达率为82.54%,显著高于癌旁组织的12.70%,直肠癌组织中CIP2A mRNA表达水平显著高于癌旁组织,进一步细胞实验结果表明,CIP2A在直肠癌细胞中的表达水平明显高于正常细胞,且与患者TNM分期、分化程度和淋巴结转移有关,提示CIP2A可能参与直肠癌细胞的增殖、分化,进而影响直肠癌的发生、发展过程。
人类FOXA1基因位于染色体14q12-q13,其蛋白质由472个氨基酸组成,相对分子质量为50×103。研究发现,FOXA1可通过与染色体特异性结合,释放DNA结合位点,进而调控细胞增殖、凋亡、转化及信号传导等过程[12]。LAURA[13]研究发现,发生FOXA1基因突变的患者,前列腺特异性抗原复发时间缩短,提示FOXA1突变可能对ERG融合相关前列腺癌有一定的预后价值。FOXA1是FOX家族中重要成员之一,是一种典型的与细胞增殖有关的转录因子,已有报道称其在卵巢上皮癌[13]、非小细胞肺癌[14]的发生、发展中发挥重要作用。
ZHANG等[15]采用免疫组织化学法检测发现,FOXA1在结直肠腺瘤组织、结直肠癌黏膜、正常结直肠黏膜中的阳性表达率依次降低且差异显著,提示FOXA1可能参与结直肠腺瘤的癌变。本研究结果显示,FOXA1在直肠癌组织中的阳性表达率为80.95%,显著高于癌旁组织的11.11%,直肠癌组织中FOXA1 mRNA表达水平显著高于癌旁组织,且与患者TNM分期、分化程度和淋巴结转移有关,细胞实验证实FOXA1在直肠癌细胞中的表达水平明显高于正常肠上皮细胞,提示FOXA1过表达可能起促癌作用,参与直肠癌的发生、发展过程。
本研究还探究了CIP2A、FOXA1表达水平对直肠癌的诊断价值,ROC曲线结果显示,CIP2A、FOXA1诊断直肠癌的AUC分别为0.854、0.904,当CIP2A相对表达水平高于1.40,FOXA1相对表达水平高于1.19时,发生直肠癌的概率增加,提示CIP2A、FOXA1对直肠癌的发生具有一定的诊断价值;为更好诊断直肠癌,作CIP2A、FOXA1二者联合诊断,结果显示联合诊断直肠癌的AUC为0.936,此时灵敏度和特异度分别为92.06%、87.30%,提示CIP2A、FOXA1二者联合诊断直肠癌的价值更高。
综上所述,CIP2A、FOXA1在直肠癌组织中呈高表达,且与患者TNM分期、分化程度和淋巴结转移密切相关,提示CIP2A、FOXA1在直肠癌的发生、发展过程中起重要作用,对直肠癌具有一定的诊断价值,可作为临床诊断和治疗的分子标志物,有望成为直肠癌患者治疗上的新靶点。

