PTEN基因mRNA在卵巢癌组织中的表达及其对卵巢癌的诊断价值
方 燕,陈建欧,郑旭旭
(温州市中医院病理科,浙江 温州 325000)
卵巢癌是女性发生率较高的生殖器官恶性肿瘤,其发病率仅次于宫颈癌及子宫体癌[1]。目前,临床上对于卵巢癌发病机制尚未阐明,普遍认为与遗传因素、内分泌因素等有关,临床表现多以疼痛为主,部分患者可伴有下腹包块、月经不调等[2]。PTEN基因是除p53基因外的第二大抑癌基因,主要定位于在10号染色体上,具有双重特异性[3]。研究表明,PTEN的脂质磷酸酶活性拮抗磷脂酰肌醇-3-激酶(PIEK)/AKT/mTOR途径抑制肿瘤细胞的生长和存活[4]。故PTEN的突变与缺失能参与多种肿瘤细胞的发生、发展,促进细胞凋亡,诱导细胞周期的停止,且PTEN基因的低表达或缺失与肿瘤的进展和不良预后存在相关性。此前研究证据提示,PTEN基因突变及表达能直接参与卵巢癌的发生、发展,能通过多种途径调控细胞的增殖与迁移[5]。因此,本研究以卵巢癌及良性上皮性卵巢肿瘤患者为对象,探讨卵巢癌患者PTEN基因突变情况、mRNA表达水平及其对卵巢癌的临床诊断价值,现报道如下。
1资料与方法
1.1一般资料
选择2016年1月至2020年2月在温州市中医院进行诊治的卵巢癌患者58例为观察组,观察组年龄介于28~52岁,平均年龄(35.79±5.73)岁;肿瘤直径介于2~7cm,平均直径(4.34±0.63)cm;组织学分型为:浆液性囊腺癌21例,粘液性囊腺癌18例,卵巢内膜性癌14例,透明细胞癌5例;组织分化程度为:高分化7例,中分化37例,低分化14例;临床分期为:Ⅰ~Ⅱ期34例,Ⅲ~Ⅳ期24例。选择同期进行治疗的良性上皮性卵巢肿瘤患者71例为对照组,对照组年龄介于29~53岁,平均年龄(36.11±5.74)岁。研究对象的纳入标准为:①符合卵巢癌和良性上皮性卵巢肿瘤的诊断标准[6];②均行手术治疗,术中留取病灶组织;③均完成PTEN基因突变及mRNA水平测定,且患者均可耐受;④对本研究知情且同意参加者。排除标准:①合并认知功能异常、自身免疫系统疾病者;②患者留取病灶组织前已接受激素或放化疗治疗;③合并精神异常、其他部位肿瘤或严重肝肾功能异常者。经对比,两组患者的一般资料无统计学差异(P>0.05),具有可比性。本研究方案已经由温州市中医院伦理委员会审核及批准,且所有研究对象均已签署知情同意书。
1.2检测方法
1.2.1 PENT基因突变测定
所有患者均行手术治疗,且术中留取病灶组织,并将获得的组织立即放置在液氮中,完成30min速冻后,将其放置在-70℃冰箱中;部分病灶组织采用浓度为10.0%甲醛溶液固定,常规石蜡包埋后,制备4μm切片备用。采用实时荧光定量PCR技术完成不同组织中PTEN基因突变部位,并完成扩增,正向引物:5′-TCCAATAGAAAAATGGTG-3′;反向引物:5′-TGCCCCGATGTAATAAAT-3′;引物长度196nt。取上述经PCR扩增的引物3μL,根据1∶5的比例放置在变性剂(含有甲酰胺98.0%、NaOH溶液200mmol/L、EDTA 20mmol/L、溴酚蓝0.05%及二甲苯青0.05%)中充分混合,在98℃下完成10min变性,完成后立即完成5min水浴。取上述获得的混合溶液,完成聚丙烯酰胺凝胶电泳,从而获得银染显带,将DNA异常的扩增产物送外检,完成相应序列的测定[7]。
1.2.2 PENT mRNA表达水平测定
取上述分离的组织标本,向标本中加入Trizol 500μL,充分混合后转移到离心管1.0mL,振荡5min后,静置。向各组标本中加入氯仿200μL,振荡15s,静置5min后离心15min,离心速度12 000rpm。完毕后加入预冷的乙醇(浓度为75.0%)1mL,常温下放置7min至干燥,经紫外分光度仪A260下测定吸光度值。采用实时荧光定量PCR技术测定各组样品中PENTmRNA的表达水平。根据实验需要完成PCR参数设置:30℃下10min;42℃下30min;99℃下5min;5℃下5min,合计完成循环35个,72℃下10min延长,获得最终产物并放入1.5%琼脂凝胶电泳,β-actin为内对照,引物见表1[8]。

表1 PTEN mRNA引物设计
1.3观察指标
①观察卵巢癌组织中PTEN基因突变情况;②对比观察组和对照组的PTEN mRNA水平差异;③收集患者的年龄、病理类型、分化类型及临床分期,比较观察组不同年龄、分化类型、病理组织类型及临床分期下PTEN mRNA水平差异;④绘制受试者工作特征(receiver operating characteristic,ROC)曲线,分析PTEN mRNA水平在卵巢癌患者中的诊断效能。
1.4统计学方法
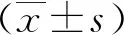
2结果
2.1 卵巢癌组织中PTEN基因突变
58例卵巢癌组织中,有35例检出PTEN基因突变,均为外显子5突变,多分布在中分化及低分化癌中;其中卵巢内膜性癌11例,透明细胞癌4例,浆液性囊腺癌13例,粘液性囊腺癌7例。突变部位为外显子5第5位密码子T→C,见图1。

注:突变部位为PTEN基因外显子5第5位密码子T→C。
2.2两组患者PTEN mRNA水平的比较
观察组PTEN mRNA水平为显著低于对照组(0.334±0.097 vs 0.831±0.109,t=6.391,P<0.001),见表2。

表2 两组PTEN mRNA水平的比较
2.3不同病理特征下卵巢癌患者的PTEN mRNA表达水平
不同年龄分层下,卵巢癌患者的PTEN mRNA水平无显著差异(t=0.334,P=0.691)。不同分化类型及病理组织类型分层下,卵巢癌患者的PTEN mRNA水平分布具有显著统计学差异(F=7.891、7.998,P<0.001)临床分期为Ⅰ~Ⅱ期的卵巢癌患者PTEN mRNA水平显著高于Ⅲ~Ⅳ期患者(t=6.143,P<0.001),见表3。

表3 不同病理特征下卵巢癌患者的PTEN mRNA表达水平比较
2.4 PTEN mRNA水平对卵巢癌的诊断价值
ROC曲线结果显示,PTEN mRNA水平诊断卵巢癌的AUC为0.873(P<0.05),最优截断点的诊断灵敏度和特异度分别为85.71%、71.23%,见图2。
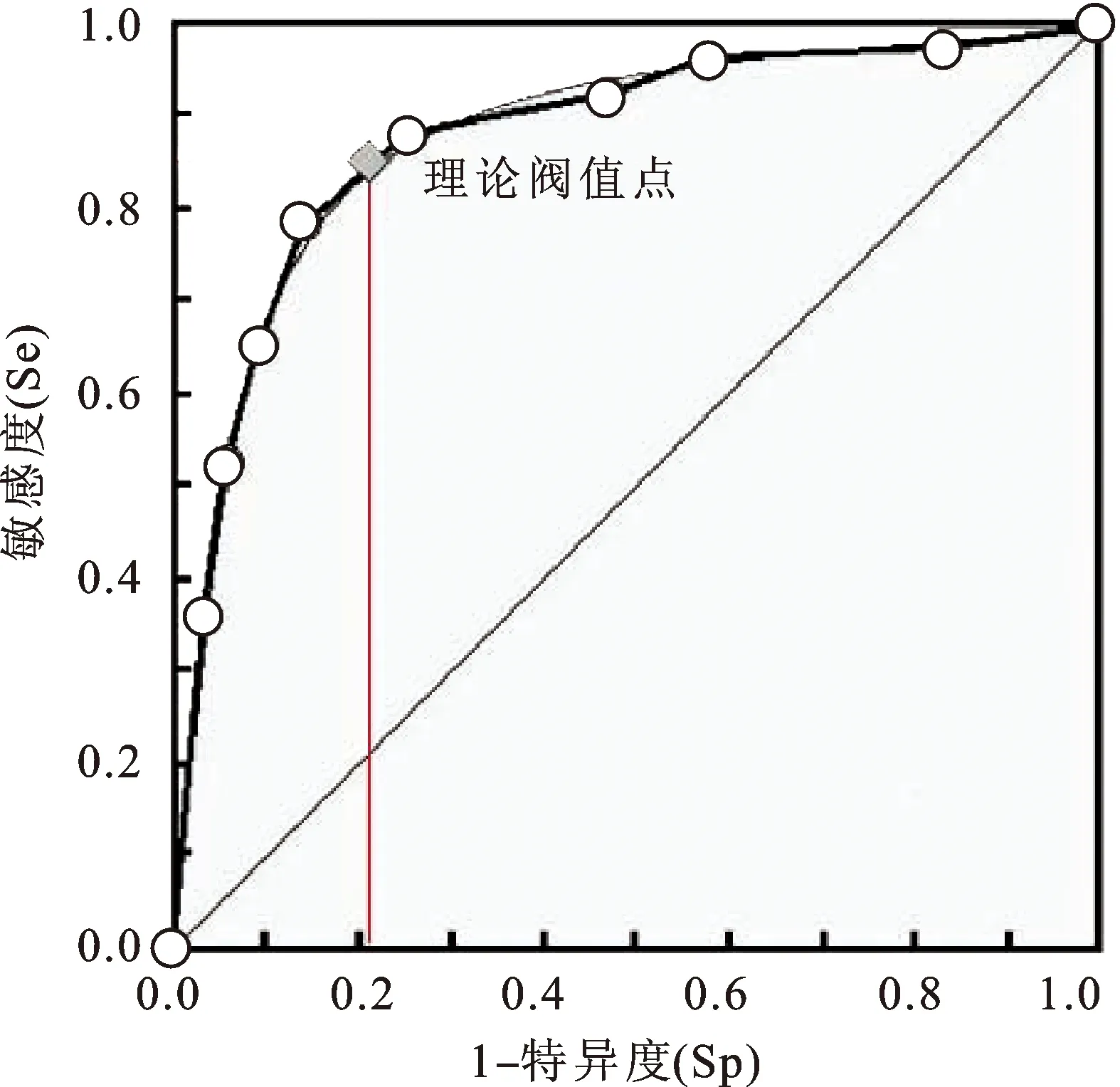
图2 PTEN mRNA水平诊断卵巢癌的ROC曲线
3讨论
3.1 PTEN基因在卵巢癌细胞中的突变
卵巢癌是女性发生率较高的生殖系统恶性肿瘤,其发病率仅次于宫颈癌、子宫癌,具有较高的死亡率[9]。既往研究表明[10],恶性肿瘤的发生与细胞凋亡存在紧密的联系。PTEN基因属于人体中较为常见的抑癌基因,位于染色体10q23,含9个外显子和8个内含子,其编码的蛋白与张力蛋白、辅助蛋白相似[11]。既往研究表明[11],PTEN基因编码的蛋白能提高相关蛋白活性,能影响磷酸丝氨酸/苏氨酸和磷酸酪氨酸残基脱磷酸化,可负性调节细胞的运动、浸润与转移。此外,PTEN还具有脂质磷酸酶活性,通过一系列作用使细胞周期阻滞在G1期,并诱导细胞凋亡[12]。PTEN基因能借助多种信号通路、途径等抑制细胞的增殖活性,故其突变多与肿瘤的发生发展密切相关。本研究中,58例卵巢癌组织中检出35例携带PTEN基因突变,多分布在中分化、低分化癌中,且均为外显子5突变。此前研究证据也表明,PTEN基因外显子5突变将改变编码产物的磷酸酶结构域,进而使其功能异常[13]。
3.2 PTEN mRNA在卵巢癌组织中的表达及意义
本研究结果显示,观察组PTEN mRNA水平低于对照组(P<0.05),说明PTEN基因在卵巢癌患者中呈低表达水平。且本研究还发现,卵巢癌组织中PTEN mRNA表达水平与患者的分化类型、病理组织类型及临床分期密切相关,低分化、Ⅲ~Ⅳ期及卵巢内膜性癌患者的PTEN mRNA表达水平显著下调,提示其表达水平或可反映患者的疾病严重程度,可用于辅助判断患者的病理分型、分化程度及临床分期,进而用于指导临床诊疗。且本研究结论与此前类似研究结论较为一致[14]。其原因可能降低细胞粘附和凋亡、提高细胞运动性和增值、促进心血管形成等过程相关[12]。但仍需开展更多大样本研究,进一步明确PTEN mRNA表达水平与患者的分化类型、病理组织类型及临床分期的量化关系,助力卵巢癌个体化治疗。
3.3 PTEN mRNA水平对卵巢癌的诊断价值
为了进一步分析PTEN mRNA对卵巢癌的诊断价值,本研究进一步构建ROC曲线,结果显示,PTEN mRNA水平诊断卵巢癌的AUC为0.873(P<0.05),最优截断点的诊断灵敏度和特异度分别为85.71%、71.23%,提示较高的诊断价值。故临床上应加强卵巢癌患者的PTEN基因测定,以便于评估患者分期、疾病严重程度,并根据测定结果制定治疗方案,促进患者恢复。
综上所述,卵巢癌患者常伴有PTEN基因突变,该基因mRNA水平可能因分化类型、病理组织类型及临床分期的分布而异,且对卵巢癌的诊断具有重要价值,有望成为卵巢癌治疗的新靶点。

