拉米呋定治疗2岁以下婴幼儿乙型病毒性肝炎3例
金永红,龚敬宇,黎佳琪,张梅虹
(1.复旦大学附属金山医院儿科,上海 201508;2.复旦大学附属儿科医院肝病科,上海 201102)
乙型病毒性肝炎是指乙型肝炎病毒(hepatitis B virus,HBV)感染所引起的肝脏坏死性炎症。在感染高发地区,大多数的感染始于幼年。据报道,1岁前、5岁前、成人期感染乙肝病毒者发展至慢性感染的概率分别为90.00%,25.00%~50.00%和5.00%~10.00%[1]。慢性乙型肝炎患者中大约25%的患者可发展至肝硬化和肝细胞肝癌。据初步统计,我国现有1.25亿慢性感染患者。定期监测,合理有效的抗病毒治疗将有助于改善这部分患者的预后,减少并发症的发生。目前已知,慢性乙肝病毒感染的自然病程分为4个期,免疫耐受期表现为HBV-DNA增高,谷丙转氨酶(ALT)正常或轻度增高;免疫清除期表现为ALT升高,乙肝病毒e抗原(HBV surface antigen,HBeAg)转阴,血清学转换,HBV-DNA降低进入病毒低复制期,部分患者在发生血清学转换后如再次出现HBV-DNA升高和肝脏功能受损,即进入HBeAg阴性的肝炎再活动期[2]。大多数围产期感染的患者首先进入免疫耐受阶段,至青春期前后进入免疫清除期。在此期前肝脏并没有明显的炎症表现,无需治疗而且随着乙肝疫苗免疫接种和乙肝高价免疫球蛋白母婴阻断的实施,围产期感染率已有明显下降,因此对于婴幼儿的抗病毒治疗目前研究很少,各国指南也没有明确的推荐。但是当孕母HBeAg阳性和乙肝病毒复制高度活跃时,有可能会导致母婴阻断失败[3-4],而且有少部分患者会在青春期前甚至婴幼儿期进入自发性免疫清除阶段,机体免疫系统开始识别乙肝病毒,攻击受感染的肝细胞,肝脏出现坏死性炎症,炎症持续的时间和强度与乙肝病毒相关并发症肝硬化和肝细胞肝癌的发生密切相关。有研究显示,3岁前出现HBeAg血清学转换同时伴有严重肝损伤的患者发生儿童期肝癌的危险性明显升高,据报道3.00%~5.00%和0.01%~0.03%的慢性感染者会在成人前发生肝硬化和肝癌[5-7]。因此对围产期感染的患者给予密切监测,选择恰当的时机及时清除,永久性抑制乙肝病毒,缩短和减轻肝脏炎症反应的时间和强度十分必要。现选取2014年1月至2016年12月间在复旦大学附属金山医院儿科和复旦大学附属儿科医院就诊的3例乙型病毒性肝炎患儿,将使用拉米呋定治疗前后的肝功能、HBV-DNA和乙肝血清学标志物的变化做一分析回顾。
1资料与方法
1.1研究对象
2014年1月至2016年12月在复旦大学附属金山医院儿科和复旦大学附属儿科医院就诊的3例乙型病毒性肝炎患儿。
1.2病例资料
3例患儿均为婴儿期起病,病例1、病例2均为女性,入院时分别为4月龄和8月龄,病例3为男性,入院时为8月龄,孕母均为乙肝大三阳患者,患儿出生后24小时内均正规接种乙肝高价免疫球蛋白和乙肝疫苗。3例患儿生后常规随访肝功能发现ALT升高,病例1同时伴有胆汁淤积表现。3例患儿经过实验室检查排除其他病毒细菌感染,血串联质谱、尿液气象质谱、甲状腺功能和血糖均正常,除外其他代谢性肝病。病例1和病例2 HBsAg、HBeAg、乙肝病毒核心抗体(HBcAb)均阳性,病例3 HBeAg阴性,3例患儿HBV-DNA滴度测定均在3×106IU/mL以上,其中病例1行经皮肝穿刺肝脏活组织检查,检查发现肝小叶结构紊乱伴点状坏死,门管区中度炎症伴界面肝炎和桥接坏死,诊断为慢性乙型病毒性活动性肝炎。3例患儿经过临床观察3~5个月,ALT和HBV-DNA滴度无下降趋势。
1.3研究方法
在家属或者监护人知情同意的基础上,给予3例患儿口服拉米呋定3mg·kg-1·d-1,记录其用药前后肝功能的各项指标、HBV-DNA、乙肝血清学标志物的变化。
2结果
病例1在服药2周后HBV-DNA降至检测下限(<1.0×103IU/mL);3个月后ALT正常,HBeAg血清学转换,HBsAg转阴;4个月HBsAb阳性;治疗9个月停药,停药2年6个月后复查肝功能正常,HBsAb阳性,HBV-DNA滴度正常。病例2在服药10周后HBV-DNA滴度降至正常;服药20周ALT降至正常;8个月HBeAg血清学转换,HBsAb阳性;服药20个月,停药1年后复查肝功能正常,HBsAg阴性,HBsAb阳性,HBV-DNA正常。病例3在服药3周后HBV-DNA降至正常;9个月ALT恢复正常,目前HBsAg、HBcAb阳性,HBeAg、HBeAb均阴性,目前仍在服药随访中。3例患儿生长发育同正常同龄儿,服药期间未发现白细胞计数异常和肌酸激酶升高等药物不良反应。3例患儿临床资料和使用拉米呋定前后的肝功能、病毒血清学标志物改变见表1~表3。

表1 3例患儿临床资料
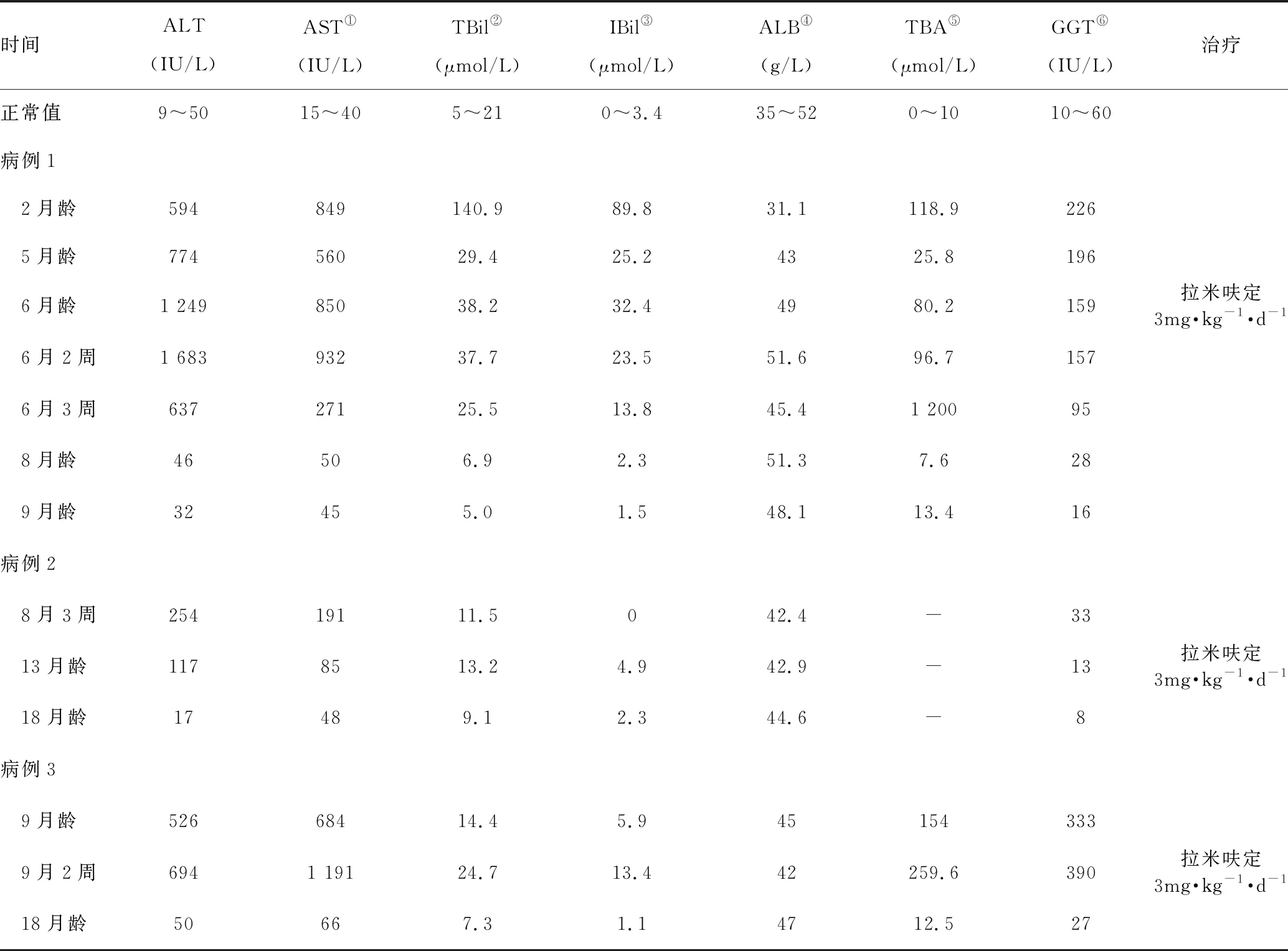
表2 3例患儿服用拉米呋定前后肝功能各项指标变化
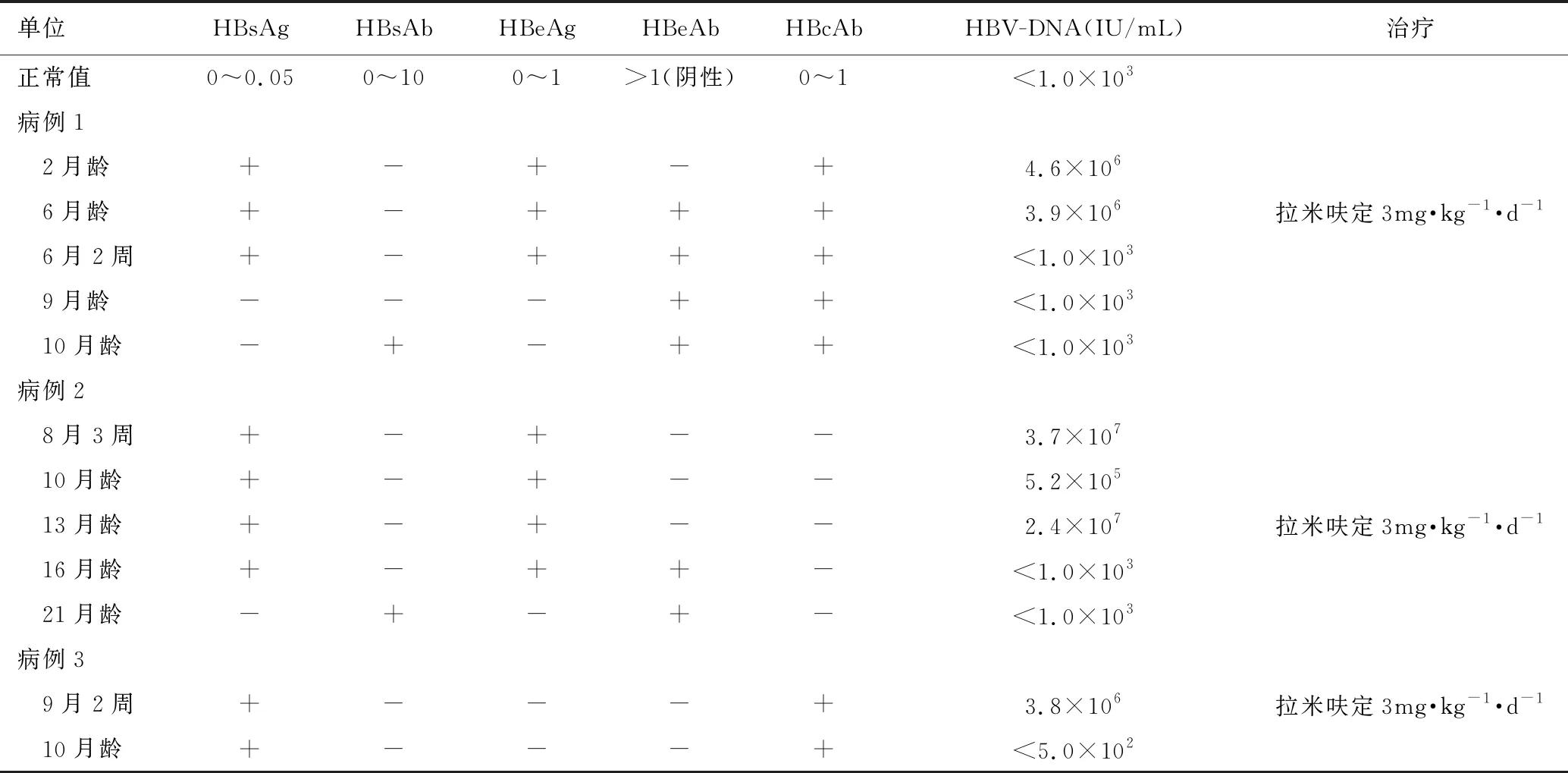
表3 3例患儿服用拉米呋定前后各项乙肝血清学标志物变化
3讨论
3.1国内外研究现状
关于乙型病毒性肝炎的抗病毒治疗,无论是治疗的适应症还是药物选用和治疗疗程,国际国内各指南对2岁以下儿童均没有推荐,对2岁以上儿童的推荐也尚未完全统一。亚太肝病研究学会(APASL)2015年慢性乙肝防治指南推荐[8]:慢性HBV感染患者ALT水平持续升高[正常高限(ULN)的2倍,观察间隔至少1个月]和HBV-DNA(HBeAg阳性时>20 000IU/mL,HBeAg阴性时>2 000IU/mL),则可开始治疗。美国肝病学会(AASLD)2015年乙肝治疗指南[9]推荐:ALT水平>1.3ULN且持续6个月以上和HBV-DNA可测的HBeAg阳性2~18岁儿童应进行抗病毒治疗,以获取持续的HBeAg血清学转换。我国2019版《慢性乙型肝炎防治指南》指出血清HBV-DNA阳性的慢性HBV感染者,若其ALT持续异常(>ULN)且排除其他原因导致的ALT升高,建议抗病毒治疗[2]。有关儿童乙肝抗病毒治疗药物的选择,目前美国食品药品监督管理局(FDA)批准用于儿童患者治疗的药物包括普通干扰素-α(≥1岁)、恩替卡韦(≥2岁)和韦瑞德(≥2岁,且体质量≥10kg)[10-11]。干扰素-α是最早批准的抗乙肝病毒的治疗药物之一,优点是疗程确定、疗效持久,可用于1岁以上不存在失代偿肝硬化的儿童,但属于注射用药,因此患者依从性不佳[12];核苷类药物拉米呋定早已被批准用于2岁以上儿童,由于发生耐药基因屏障较低,目前不推荐作为一线用药。2008年阿德福韦被批准用于12岁以上的儿童。2014年恩替卡韦和替诺福韦分别被批准用于2岁和12岁以上儿童。APASL和欧洲肝病学会(ESPGHAN)推荐干扰素-α用于1岁以上儿童,拉米呋定用于3岁及以上儿童,阿德福韦酯(ADV)和富马酸丙酚替诺福韦片(TAF)可用于12岁以上儿童,恩替卡韦可用于16岁以上儿童。我国已批准TAF用于青少年(≥12岁,且体质量≥35kg)。聚乙二醇干扰素-α-2a(Peg-IFN-α-2a)可用于≥5岁慢性乙型肝炎患者[10]。但目前为止2岁以下婴幼儿的抗病毒药物选择不管国内还是国际上均仍无明确推荐。
3.2研究原理和机制
本研究的3例患儿均在婴儿期开始出现肝炎活动,各项检查除外其他代谢性和感染因素,明确为乙肝病毒感染引起的婴儿期急性肝功能受损。特别是病例1经过临床观察4个月,HBV-DNA滴度居高不下,ALT持续增高,提示肝细胞损伤严重,炎症反应剧烈,肝功能濒临失代偿,此期如果不给予抗病毒治疗,及时减轻和缩短炎症反应的强度和持续时间,发生肝硬化和肝功能失代偿的危险性将明显增加。病例2经过随访观察5个月,ALT始终高于正常上限2倍,提示肝细胞炎症持续,且HBV-DNA滴度一度下降后又增高,提示有向慢性化进展的倾向。病例3为HBeAg阴性的活动性肝炎,HBV-DNA和ALT持续不降。为了进一步避免乙肝相关并发症的发生,在家属知情同意的基础上,我们给予了抗病毒治疗。拉米呋定是第一个被批准用于抗乙肝病毒治疗的核苷类药物,优点是口服用药,耐受性好,不会增加肝硬化患儿出现失代偿的风险,但是长期使用会增加耐药突变,发生血细胞减少,肌酶增高等不良反应。
3.3研究的重要性和结果
虽然各指南推荐1岁以上患儿可选用干扰素,但是由于病例1存在失代偿风险,其他病例因为依从性问题均不适合,故本研究中的3例患儿均选用口服拉米呋定治疗,治疗一段时间后病情迅速得到了改善。病例1、病例2目前已成功停药,各项指标均正常,病例3目前治疗还在继续。3例患儿生长发育均正常,且无药物不良反应发生,说明拉米呋定可作为婴幼儿期乙肝病毒性肝炎急性加重时抗病毒治疗用药选择之一。
3.4研究的复杂性及可能原因
但是鉴于拉米呋定的不良反应和有可能产生耐药性等因素,在治疗开始前必须对患儿的年龄、疾病严重程度、取得疗效的可能性及合并症和患儿家长的意愿等进行综合考虑。
3.5由研究得到的提示
大部分的围产期感染者在青春期前后进入自发性免疫清除期,3岁前出现自发性免疫清除的患者每年不到2%。但是有一小部分患者会在此期前出现ALT升高等肝炎急性加重的表现,临床表现可不明显,如果不及时发现,很可能患者会因为炎症反应的持续而直接导致乙肝相关并发症如肝硬化和肝癌的发生,病例2和病例3均是在定期随访时发现转氨酶升高,因此对于围产期感染者应定期检测乙肝病毒学标志物、肝功能和HBV-DNA十分重要。
3.6本研究的不足之处及今后的探索
本文为婴幼儿期特别是2岁以下乙肝病毒性肝炎患者的口服抗病毒治疗进行了有益的探索,发现经过选择的患者,口服拉米呋定抗病毒治疗可以取得很好的效果,达到临床治愈的标准,没有明显的副作用。但由于病例数量较少,作为常规推荐仍需慎重,这需要我们在今后的临床实践过程中通过更多的临床研究加以证实。

