延龄草苷通过上调miR-1247-3p表达减轻高糖诱导的视网膜血管内皮细胞损伤
马金兰 王青 牛浩宇
1青海大学附属医院眼科(西宁810001);2青海大学医学院眼科(西宁810001)
糖尿病视网膜病变(DR)是糖尿病常见的并发症之一,也是导致成年人失明的主要原因[1]。目前,DR 的发病机制尚未明确,且缺乏有效的治疗药物,一般认为持续的高血糖诱导的视网膜血管内皮细胞损伤是其发生的基础[2]。延龄草苷是延龄草的主要活性成分之一,具有抗炎、抗癌等功效[3-4]。研究[5]显示,延龄草苷可通过调控Sirtl/NFκB 信号通路提高过氧化氢诱导的PC12 细胞抗氧化能力,并降低细胞炎性因子表达,保护PC12 细胞损伤。但目前,延龄草苷是否影响高糖诱导的视网膜血管内皮细胞损伤尚未明确。
微小RNA(miRNA)是一类小分子非编码RNA,在细胞氧化应激、炎症反应及凋亡中发挥重要作用[6-8]。研究[9]显示,过表达miR-1247-3p 可减少氧-糖剥夺/复氧处理的神经细胞凋亡,减轻缺血再灌注脑损伤。但目前,miR-1247-3p 对高糖诱导的视网膜血管内皮细胞损伤的影响也还未知。本研究以人视网膜血管内皮细胞(HRVEC)为研究对象,主要观察了延龄草苷对高糖诱导的HRVEC 细胞氧化应激和凋亡的影响及其能否调控miR-1247-3p 表达发挥作用,以期为DR 的治疗提供新途径。
1 材料与方法
1.1 细胞和试剂人视网膜血管内皮细胞(HRVEC),上海雅吉生物科技有限公司;延龄草苷,纯度≥98%,上海钰博生物科技有限公司;胎牛血清(FBS),杭州四季青;DMEM 培养基,北京索莱宝;Trizol 试剂、逆转录试剂盒和PCR 试剂盒,大连宝生物;和LipofectamineTM2000 试剂盒,美国Invitrogen 公司;PCR 引物、miR-1247-3p 模拟物(mimcs)、模拟对照序列(miR-NC)、miR-1247-3p 抑制剂(anti-miR-1247-3p)、抑制剂阴性序列(antimiR-NC),上海生工,丙二醛(MDA)、超氧化物歧化酶(SOD)和活性氧(ROS)试剂盒,南京建成;二喹啉甲酸(BCA)蛋白检测试剂盒和Annexin VFITC/PI 凋亡试剂盒;上海碧云天;兔抗人B 淋巴细胞瘤-2(Bcl-2)、B 淋巴细胞瘤-2 相关蛋白(Bax)和甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体,美国Santa Cruz 公司。
1.2 方法
1.2.1 细胞培养和转染用含10 % FBS 的DMEM培养基培养HRVEC。将HRVEC 接种于6 孔板中(1 × 105个/孔),用LipofectamineTM2000 脂质体法,分别转染miR-1247-3p mimcs、miR-NC 组、anti-miR-1247-3p、anti-miR-NC。转染6 h 后,更换培养基。再培养24 h,收集细胞用于后续实验。
1.2.2 分组处理未转染的HRVEC 细胞及转染后的细胞接种于24 孔板中(2.5×104个/孔)。未转染的HRVEC 细胞分为对照组(细胞用常规培养基培养)、高糖组(细胞用含30 mmol/L[10]葡萄糖的培养基培养)、高糖+延龄草苷低剂量组(5 μmol/L[5]延龄草苷与30 mmol/L 葡萄糖共同培养)、高糖+延龄草苷中剂量组(10 μmol/L 延龄草苷与30 mmol/L 葡萄糖共同培养)和高糖+延龄草苷高剂量组(20 μmol/L延龄草苷与30 mmol/L葡萄糖共同培养)。转染miR-1247-3p mimcs、miR-NC 的细胞用含30 mmol/L 葡萄糖的培养基培养,记为高糖+miR-1247-3p、高糖+miR-NC。转染anti-miR-1247-3p、anti-miR-NC 的细胞用含20 μmol/L 延龄草苷与30 mmol/L 葡萄糖的培养基共同培养。每组设3 个复孔。培养24 h 后,检测以下指标。实验重复3 次。
1.2.3 DCFH-DA 法检测ROS细胞培养后,弃培养基,加入2 mL终浓度为10 μmol/L的DCFH-DA工作液,孵育40 min,收集细胞,流式细胞仪检测荧光强度,其中激发波长488 nm,发射波长520 nm。
1.2.4 酶联免疫吸附法检测MDA 和SOD细胞培养后,收集细胞,加裂解液裂解,3 500 r/min 离心10 min,上清液-20 ℃保存备用。分别利用MDA 和SOD试剂盒,检测上清液中MDA含量和SOD活力。
1.2.5 流式细胞仪检测细胞凋亡细胞培养后,收集细胞,PBS 清洗2 次,利用Annexin V-FITC/PI试剂盒,上流式细胞仪检测细胞凋亡。
1.2.6 实时荧光定量PCR(RT-qPCR)检测miR-1247-3p 表达Trizol 试剂提取细胞中总RNA,逆转录为cDNA,行PCR 扩增。扩增程序:95 ℃10 min,95 ℃10 s,58 ℃30 s,72 ℃30 s,共35 个循环。引物序列:miR-1247-3p 上游5'-CAGTGC ATAGCCACGTAACG-3',下游5'-GCCGTAACCACTAATCCG-3';内参U6 上游5'-CTGAACAGGTCCCTAAGCTAC-3',下游5'-CGTAATCCGTGACTGCTCG-3'。2-△△Ct法计算miR-1247-3p 相对U6 的表达量。
1.2.7 Western blot 法检测Bax 和Bcl-2 蛋白表达RIPA 试剂提取细胞中总蛋白,经BCA 法定量、SDS-PAGE 电泳、转膜和封闭后,分别于Bax 和Bcl-2 一抗孵育液中,4 ℃孵育过夜。再于山羊抗兔孵育液中,37 ℃孵育1 h。加化学发光试剂避光显影,曝光拍照。
1.3 统计学方法GraphPad Prism 7.0 软件分析实验数据。计量资料以均数±标准差表示。两组间比较采用独立样本t检验;多组间比较用单因素方差分析,进一步两两比较用t检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 延龄草苷对高糖诱导的HRVEC 氧化应激的影响与对照组比较,高糖组ROS 和MDA 水平升高(P<0.05),SOD 活性降低(P<0.05)。与高糖组比较,高糖+延龄草苷不同剂量组ROS 和MDA水平降低(P<0.05),SOD 活性升高(P<0.05),且不同剂量组间各检测指标两两比较差异有统计学意义(P<0.05)。见表1。
表1 延龄草苷对高糖诱导的HRVEC 氧化应激的影响Tab.1 The effect of trillin on oxidative stress of HRVEC induced by high glucose±s

表1 延龄草苷对高糖诱导的HRVEC 氧化应激的影响Tab.1 The effect of trillin on oxidative stress of HRVEC induced by high glucose±s
注:与对照组比较,*P <0.05;与高糖组比较,#P <0.05;与高糖+延龄草苷低剂量组比较,&P <0.05;与高糖+延龄草苷中剂量组比较,$P <0.05
ROS 水平(%)SOD 活性(U/mg)MDA 含量(nmol/mg)100.00±7.52169.39±10.845.49±0.54 292.36±15.47*47.57±4.56*24.79±2.07*剂量组228.50±14.22#84.08±6.79#19.92±1.15#剂量组179.33±11.78#&113.65±8.87#&14.68±1.13#&分组对照组高糖组高糖+延龄草苷低高糖+延龄草苷中高糖+延龄草苷高剂量组F 值P 值128.39±11.30#&$351.355<0.001 143.32±9.19#&$298.045<0.001 8.33±0.79#&$366.982<0.001
2.2 延龄草苷对高糖诱导的HRVEC 凋亡的影响与对照组比较,高糖组细胞凋亡率和Bax 蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05)。与高糖组比较,高糖+延龄草苷不同剂量组细胞凋亡率和Bax 蛋白水平降低(P<0.05),Bcl-2 蛋白水平升高(P<0.05),且不同剂量组间各检测指标两两比较差异有统计学意义(P<0.05)。见图1、表2。
表2 延龄草苷对高糖诱导的HRVEC 凋亡的影响Tab.2 The effect of trillin on the apoptosis of HRVEC induced by high glucose±s

表2 延龄草苷对高糖诱导的HRVEC 凋亡的影响Tab.2 The effect of trillin on the apoptosis of HRVEC induced by high glucose±s
注:与对照组比较,*P <0.05;与高糖组比较,#P <0.05;与高糖+延龄草苷低剂量组比较,&P <0.05;与高糖+延龄草苷中剂量组比较,$P <0.05
分组对照组高糖组高糖+延龄草苷低剂量组高糖+延龄草苷中剂量组高糖+延龄草苷高剂量组F 值P 值凋亡率(%)8.04±0.77 34.23±3.01*25.98±2.22#17.49±1.72#&11.59±1.15#&$272.506<0.001 Bcl-2 蛋白0.67±0.05 0.22±0.02*0.34±0.03#0.46±0.03#&0.58±0.05#&$203.625<0.001 Bax 蛋白0.29±0.02 0.81±0.06*0.68±0.04#0.55±0.03#&0.38±0.03#&$274.682<0.001
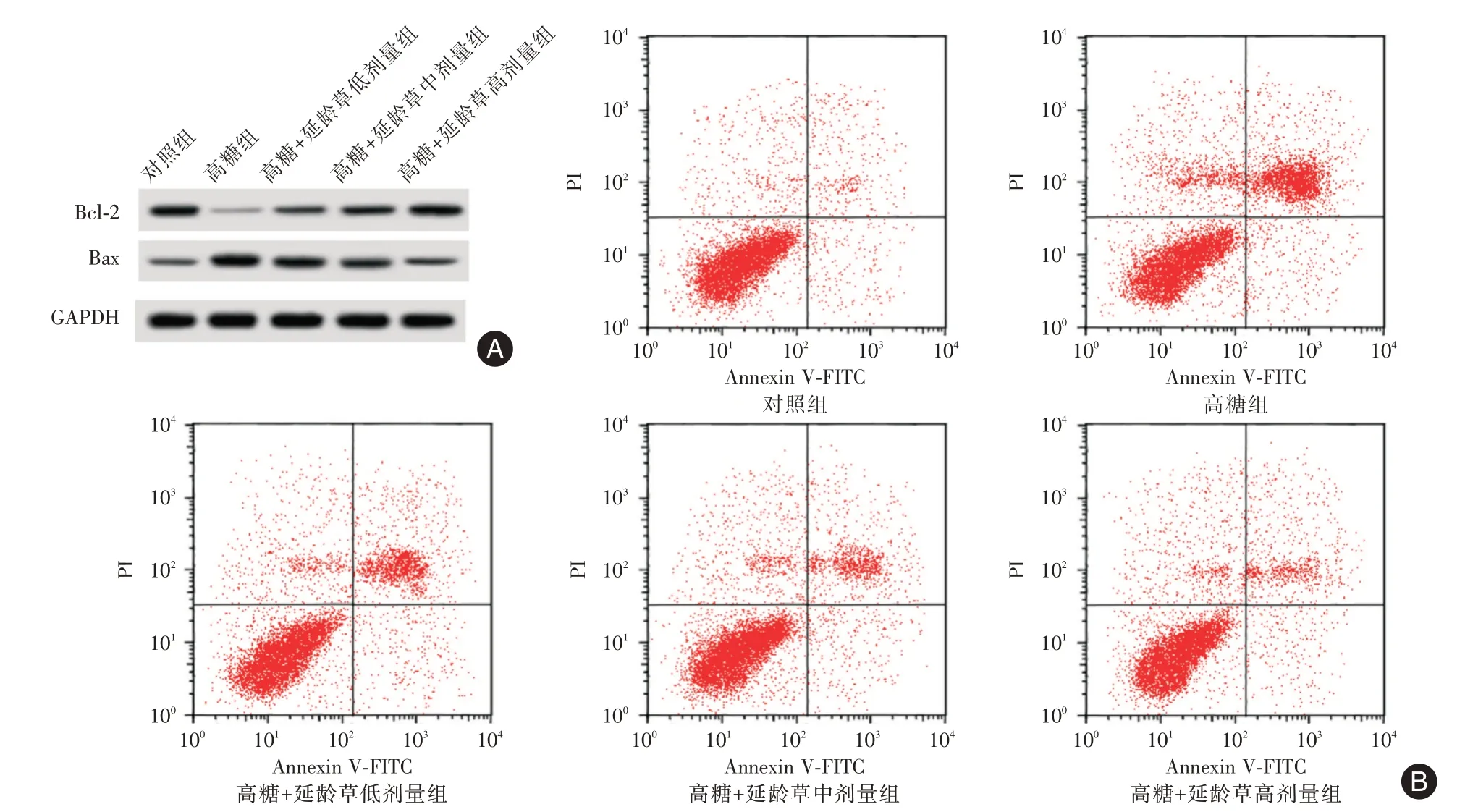
图1 延龄草苷对高糖诱导的HRVEC 凋亡及Bcl-2、Bax 蛋白表达的影响Fig.1 The effect of trillin on the apoptosis of HRVEC induced by high glucose and the protein expression of Bcl-2 and Bax
2.3 延龄草苷对高糖诱导的HRVEC中miR-1247-3p 表达的影响与对照组比较,高糖组miR-1247-3p 水平降低[(0.41 ± 0.04)vs.(1.00 ± 0.07),t=21.954,P<0.05]。与高糖组比较,高糖+延龄草苷不同剂量组miR-1247-3p 水平升高[(0.57±0.04)、(0.69±0.05)、(0.87±0.05)vs.(0.41±0.04),t=8.485、13.119、21.552,均P<0.05],且不同剂量组间各检测指标两两比较差异有统计学意义(P<0.05)。
2.4 miR-1247-3p 过表达对高糖诱导的HRVEC氧化应激的影响与高糖+miR-NC 组比较,高糖+miR-1247-3p 组ROS 和MDA 水平降低[(146.74 ±13.65)vs.(297.29±19.17)、(12.15±0.89)vs.(26.78±2.71),t= 19.192、15.387,均P<0.05],miR-1247-3p 水平和SOD 活性升高[(2.50 ± 0.21)vs.(1.00 ±0.04)、(124.56±9.55)vs.(45.91±4.17),t=21.050、22.642,均P<0.05]。
2.5 miR-1247-3p 过表达对高糖诱导的HRVEC凋亡的影响与高糖+miR-NC 组比较,高糖+miR-1247-3p 组细胞凋亡率和Bax 蛋白水平降低[(14.80± 1.15)vs.(36.83 ± 3.02)、(0.45 ± 0.03)vs.(0.84 ±0.06),t= 20.452、17.441,均P<0.05],Bcl-2 蛋白水平升高[(0.54±0.03)vs.(0.21±0.02),t=27.458,P<0.05]。见图2。

图2 miR-1247-3p 过表达对高糖诱导的HRVEC 凋亡及Bcl-2、Bax 蛋白表达的影响Fig.2 The effect of overexpressing miR-1247-3p on the apoptosis of HRVEC induced by high glucose and the protein expression of Bcl-2 and Bax
2.6 抑制miR-1247-3p 表达逆转延龄草苷对高糖诱导的HRVEC 损伤的影响与高糖+延龄草苷+anti-miR-NC 组比较,与高糖+延龄草苷+anti-miR-1247-3p 组miR-1247-3p 水平降低[(0.38±0.04)vs.(1.00±0.05),t=29.048,P<0.05],ROS 和MDA 水平升高[(246.79±11.84)vs.(124.27±10.22)、(17.79± 1.70)vs.(8.13 ± 0.84),t= 23.500、15.283,均P<0.05],SOD 活性降低[(58.94 ± 5.73)vs.(144.37 ±14.29),t=16.647,P<0.05],凋亡率和Bax 蛋白水平升高[(27.34 ± 2.37)vs.(10.67 ± 1.13)、(0.71 ±0.05)vs.(0.36±0.03),t=19.047、18.007,P<0.05],Bcl-2蛋白水平降低[(0.28±0.02)vs.(0.59±0.05),t=17.270,P<0.05]。见图3。

图3 抑制miR-1247-3p 逆转延龄草苷对高糖诱导的HRVEC 凋亡及Bcl-2、Bax 蛋白表达的影响Fig.3 Inhibiting miR-1247-3p reversed the effect of trillin on the apoptosis of HRVEC induced by high glucose and the protein expression of Bcl-2 and Bax
3 讨论
糖尿病视网膜病变的早期特征为视网膜血管内皮细胞损伤,而持续的高血糖是诱导其发生的主要原因[11-12]。因此,采取有效的措施抑制或降低高血糖诱导的视网膜血管内皮细胞损伤对于糖尿病视网膜病变的治疗具有积极意义。作为延龄草的主要活性成分,延龄草苷发挥多种药理功效。研究[13]显示,延龄草苷可通过激活AMPK/Sirt1通路抑制肺组织中炎性反应和氧化应激反应,进而降低脑缺血再灌注继发肺损伤;延龄草苷可抑制脊髓组织中的氧化应激反应,减轻大鼠脊髓损伤[14]。但目前,延龄草苷对高糖诱导的视网膜血管内皮细胞损伤的影响和分子机制还未知。
糖尿病视网膜病变的发病机制十分复杂,其中氧化应激导致的视网膜血管内皮细胞损伤是其机制之一[15]。正常生理条件下,机体内的氧自由基处于动态平衡,而在病理状态下,自由基的生成和清除平衡被打破,细胞内的SOD 等抗氧化酶的活性降低,造成ROS 含量升高,引起细胞内发生脂质过氧化反应,加剧细胞损伤[16]。MDA 是脂质过氧化产物之一,可间接反映脂质过氧化水平[18]。本研究显示,高糖诱导HRVEC 细胞后,细胞中ROS和MDA 水平升高,而SOD 活力降低,与相关报道结果一致[19],表明高糖诱导HRVEC 细胞产生了氧化应激反应;而延龄草苷可降低高糖诱导的HRVEC 细胞中ROS 和MDA 水平,并提高SOD 活力,说明其可抑制高糖诱导的HRVEC 细胞氧化应激反应。
氧化应激可进一步诱导细胞凋亡。Bax和Bcl-2是细胞凋亡的重要调控分子,Bax 表达升高促进细胞凋亡,而Bcl-2 表达升高则抑制细胞凋亡[20-21]。本研究显示,高糖可能通过调控Bax/Bcl-2 促进HRVEC 细胞,与相关报道结果一致[22];不同剂量的延龄草苷干预后,高糖诱导的HRVEC 细胞凋亡及Bax 蛋白表达降低,而Bcl-2 蛋白表达升高,表明延龄草苷可有效降低高糖诱导的HRVEC 细胞凋亡。
miRNA 广泛存在于真核生物中,参与调控细胞的增殖、凋亡、氧化应激等生理或病理过程,与人类多种疾病的发生发展密切相关[23-24]。研究显示,过表达miR-1247-3p 可减轻缺氧/复氧(H/R)诱导的心肌细胞H9c2 损伤,为急性心肌梗塞的治疗提供了分子靶点[25]。本研究结果显示,高糖可抑制HRVEC 细胞中miR-1247-3p 的表达,而过表达miR-1247-3p 可降低高糖诱导的HRVEC 细胞氧化应激和凋亡,提示miR-1247-3p 可作为治疗糖尿病视网膜病变的分子靶点。本研究还显示,延龄草苷可剂量依赖性促进高糖诱导的HRVEC 细胞中miR-1247-3p 表达,而抑制miR-1247-3p 表达则逆转了延龄草苷对高糖诱导的HRVEC 细胞氧化应激和凋亡的抑制作用,提示延龄草苷通过上调miR-1247-3p 表达来减轻高糖诱导的HRVEC 细胞损伤。
综上所述,延龄草苷可有效抑制高糖诱导的HRVEC 细胞氧化应激和凋亡,减轻细胞损伤,其可能通过上调细胞中miR-1247-3p 表达来发挥作用,具有研发为治疗糖尿病视网膜病变药物的潜在价值。本研究接下来将进一步探究miR-1247-3p 靶基因及下游信号通路对高糖诱导的HRVEC细胞损伤的影响,并通过动物实验进一步验证延龄草苷对糖尿病视网膜病变发生发展的影响和作用机制。

