载脂蛋白M对肾小管上皮细胞增殖凋亡的影响
白亚萍,裴文俊,吴亚丽,闵 娇,花长春,刘 洁,章 尧
(皖南医学院 1.安徽省生物大分子研究重点实验室;2.生物化学与分子生物学教研室;3.药学院;4.临床医学院;5.医学影像学院,安徽 芜湖 241002)
近年来,急性肾损伤和慢性肾病对人类产生了严重威胁并被上升为世界性公共卫生问题[1]。研究表明,肾小管上皮细胞(renal tubular epithelial cells,RTECs)的状态在慢性肾脏疾病进展过程中发挥着重要作用,其强调受损的RTECs可以直接促进间质炎症和纤维化的发展[2]。此外,RTECs的异常凋亡水平或坏死是急性肾损伤早期的主要特征之一[3]。
作为载脂蛋白家族成员之一,载脂蛋白M(apolipoprotein M,ApoM)的研究主要集中在糖脂代谢及抗动脉粥样硬化方面[4]。前期研究发现ApoM基因的下调促进了小鼠肾小球系膜细胞的凋亡[5],但ApoM的表达水平对RTECs的影响尚无报道。值得注意的是,ApoM主要在肝实质细胞和RTECs中高表达[6-7]。本研究将系统地探究ApoM基因下调对RTECs增殖及凋亡的影响,为肾脏疾病的防治提供新的理论依据,并进一步丰富ApoM的功能研究。
1 材料与方法
1.1 实验动物 委托上海南方模式生物研究中心,利用Crispr-Cas9 技术构建 ApoM(+/-)模型小鼠模型;实验用野生型小鼠购自南京青龙山。成年C57BL/6J雄性和雌性ApoM(+/-)小鼠(3~4月龄)通过合笼繁育获得ApoM基因纯合子(-/-)小鼠。本研究动物实验方案经皖南医学院实验动物福利与伦理委员会批准。
1.2 C57BL/6J小鼠鼠尾基因型鉴定 取16只8周龄左右的C57BL/6J小鼠,剪其尾巴放至1.5 mL EP管中,加入裂解液A和蛋白酶K,55℃金属浴过夜直至其完全裂解,加入无水乙醇和裂解液B。将上述液体转移至DNA纯化柱中,6 000 r/min离心,加洗涤液>Ⅰ6 000 g/min离心,加洗涤液Ⅱ18 000 r/min离心,弃收集管液体,18 000 g空离1 min,将DNA纯化柱转移到一新EP管上,加入洗脱液,静置3 min,所得液体即为总DNA。将上述提取的DNA进行PCR扩增,所需的引物为ApoM F:5′-AAGTCT-TTGAGTAGGTGGGTCGC-3′,ApoM R:5′-AGAGCCGGCAGCCATGATGA-3′,将PCR产物进行琼脂糖凝胶电泳后进行凝胶成像并分析。
1.3 尿蛋白、尿肌酐和尿酸检测 取8周龄的ApoM-/-小鼠和WT小鼠各5只,禁食24 h后置于代谢笼中并收集尿样。利用尿蛋白试剂盒(南京建成,Cat:C035-2-1)进行尿蛋白检测;利用尿肌酐试剂盒(南京建成,Cat:C011-1-1)检测尿肌酐;利用尿酸试剂盒(南京建成,Cat:C012)测定尿酸。
1.4 RTECs原代培养 每组选取3只8周龄的WT和ApoM-/-小鼠,原代培养前禁食12 h,颈椎脱臼处死,沿小鼠背部双肾区剪开,无菌取出双肾,反复冲洗,剔除肾蒂及其包膜,横切面解剖双肾,将肾皮质与肾髓质沿隐约的细线分离,随后分离肾皮质到新的装有DMEM的培养基,剪碎约1~2 mm2,与培养液转移至离心管,1 500 r/min离心5 min。弃上清,加0.1%Ⅱ胶原酶37℃水浴30 min。细胞筛双重过滤,终止液终止消化。滤液经离心后,弃上清液,加入原代培养基,重悬,放入恒温CO2细胞培养箱,48h后换液,观察细胞状态。
1.5 免疫荧光 待细胞密度长至约50%,弃培养基,PBS洗涤3次,4%多聚甲醛固定,封闭1 h,一抗4℃孵育过夜(一抗为CK18抗体原液与一抗稀释液,比例为1>∶>200,ABclonal Cat:A1022),第2天PBS洗涤,加荧光二抗(二抗为原液与抗体稀释液,比例为1>∶>100,proteintech Cat:SA00013-2),避光孵育90 min,DAPI染液孵育8 min,PBS洗涤。使用激光共聚焦显微镜(LEICA SP8)进行拍摄观察。
1.6 EdU实验 EdU试剂盒购自广州锐博(C10310-1),取各组对数生长期细胞,加入试剂A,孵育2 h,4%多聚甲醛固定,2 mg/mL甘氨酸孵育5 min后,PBS洗涤,加入0.5% TritonX-100的PBS渗透剂孵育10 min;PBS洗涤1次;加入试剂B孵育30 min;渗透剂清洗2次,1×Hoechst 33342反应液孵育 0.5 h,PBS洗涤;使用荧光倒置显微镜(Olympus,日本)进行观察并分析。
1.7 Western blot 细胞在RIPA裂解液和PMSF中溶解,Nano2000微量分光光度计测定蛋白质浓度。8%或15%的凝胶电泳,然后转移到PVDF膜,一抗孵育过夜,在室温下对应二抗孵育2 h,洗涤后进行成像,Image J分析灰度值。一抗:ApoM(中国,ABclonal,A5336)、Caspase 3(英国,abcam,ab13847)、Caspase 9(英国,abcam,ab52298)、Bax(美国,CST,2772S)、Bcl 2(美国,CST,3498S)、β-actin(美国,Sigma,A1978),二抗:山羊抗兔(biosharp,BL003A),羊抗小鼠(biosharp,BL001A)。
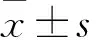
2 结果
2.1 ApoM-/-小鼠鉴定 利用Crispr/Cas9基因组靶向编辑技术,将重组质粒纯化后注射到C57BL/6J雌鼠的受精卵的胞质中,并将受精卵移植到同品系假孕小鼠输卵管内。构建ApoM基因敲除的杂合子小鼠模型(图1A);通过合笼繁育ApoM-/-小鼠;利用基因组DNA小提抽提试剂盒提取小鼠鼠尾DNA并进行分析,结果提示ApoM上下引物跨越整个ApoM基因缺失的区域,其片段长度为53 bp,WT小鼠能获得一条340 bp条带,而ApoM-/-可获得一条约290 bp的条带,为此,可初步判断出各小鼠的基因型(图1B);本研究进一步利用Western blot方法检测ApoM-/-及WT小鼠肾脏中ApoM蛋白的表达水平,结果提示WT小鼠中ApoM基因表达水平高于ApoM-/-小鼠(图1C)(t=6.227,P<0.05)。
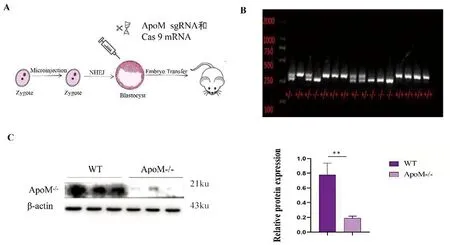
图1 ApoM基因敲除小鼠模型的构建及鉴定
2.2 ApoM-/-小鼠肾脏功能受损情况 收集各组小鼠的尿液,发现ApoM-/-小鼠尿液较WT小鼠增多(图2A);将各组尿液进行尿肌酐、尿蛋白及尿酸的检测,结果显示ApoM-/-小鼠的尿蛋白(t=9.320,P<0.01)、尿酸(t=4.063,P<0.01)及尿蛋白与尿肌酐比值(t=8.234,P<0.01)均增高,提示ApoM基因的缺失导致小鼠重吸收功能障碍(图2B~D)。
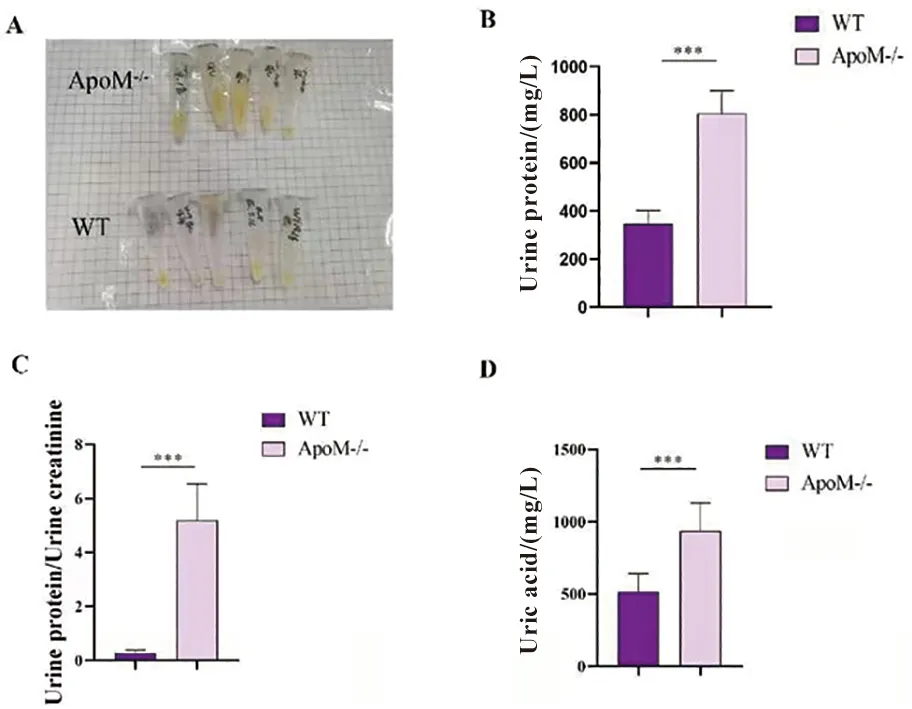
图2 ApoM基因敲除对小鼠尿液及肾功能的影响
2.3 ApoM-/-小鼠RTECs原代培养及鉴定 为了更贴近实际地反映细胞的生理状态,我们进行了RTECs的原代培养及纯度鉴定工作。选取WT小鼠及ApoM-/-小鼠各3只,提取肾小管上皮细胞节段,待24~48 h贴壁后荧光倒置显微镜明场(10×10)观察其状态(图3A、B)。CK18免疫荧光鉴定F1代细胞,判定细胞纯度,结果显示约98%以上细胞为RTECs(图3C)。
图3 小鼠RTECs原代培养及鉴定
2.4 ApoM基因缺失抑制m-RTECs的增殖并上调其凋亡水平 为探究ApoM基因缺失对m-RTECs的影响,本研究进行了EdU增殖试验及凋亡相关蛋白的检测。与WT组相比,ApoM-/-组细胞的增殖活力下降(图4A)(t=6.835,P<0.01);Western blot方法检测WT组及ApoM-/-组凋亡相关关键蛋白,结果提示ApoM基因的缺失导致促凋亡相关蛋白Bax/Bcl-2(t=3.496,P<0.05)、Cleved-caspase9(t=4.045,P<0.05)及Cleved-caspase3(t=4.388,P<0.05)表达水平上升(图4B)。
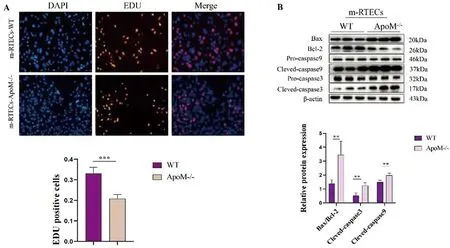
图4 ApoM基因缺失抑制m-RTECs增殖并上调其凋亡水平
3 讨论
关于ApoM的研究目前多集中在肝脏的糖脂代谢及抗动脉粥样硬化方面。虽然ApoM在肝脏和RTECs均表达丰度,但与肝脏大量相关研究不同的是,其与RTECs之间的关联性鲜有报道。本研究显示ApoM-/-组小鼠尿蛋白增高(图2B),提示ApoM基因的敲除造成了小鼠肾小球滤过功能损伤,这与我们前期发现ApoM基因下调导致肾小球系膜细胞功能受损的结果相符[5]。ApoM-/-组小鼠尿量增多(图2A)的原因可能有两种,一是原尿中的蛋白增多导致小管液溶质浓度增高形成渗透性利尿,二是RTECs受损导致肾小管重吸收功能障碍。离体水平的实验结果表明,ApoM-/-组的增殖活力较WT组下降明显(图4A)并具有更高的凋亡水平(图4B)。因此,ApoM在维持肾小球滤过和肾小管重吸收功能的稳态中起重要作用。
RTECs的损伤既是慢性肾病和急性肾损伤的病因,也是两者的特征性表现之一[8]。有研究表明,糖尿病患者RTECs的高凋亡水平将加重肾脏损伤,从而进展为糖尿病肾病[9-10]。RTECs凋亡水平的增加降低了肾小管的正常功能,导致肾小管萎缩,促进肾纤维化的发展[11-12]。因此保护RTECs免受反复损伤,恢复健康的肾小管功能可能是各类肾脏疾病治疗的主要任务之一。
另一方面,低密度和极低密度脂蛋白胆固醇水平的升高被认为是肾脏疾病发生的危险因素[13]。而ApoM已被证明参与高密度脂蛋白的形成并能进行胆固醇逆向转运,在抗动脉粥样硬化和维持脂代谢水平方面贡献巨大[14-15]。综上所述,ApoM可能是延缓或治疗肾脏疾病的潜在靶标,深入探究ApoM与RTECs之间的相关性以及ApoM在肾脏疾病发生发展中的作用极具意义,这为肾脏疾病的防治提供了新的思路。

