NecroX-5调节M1巨噬细胞极化减轻急性呼吸窘迫综合征肺损伤的机制
朱丽华,章忠明,李 薇,冯 霞,王 芃,刘兰燕
(1.广西医科大学第一附属医院 a.体检部 健康管理部; b.血液内科,广西 南宁 530021;2.中山大学附属东华医院 传染病科,广东 东莞 523110;3.广西医科大学 基础医学院,广西 南宁 530021)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)为临床常见的急危重症,特征是毛细血管屏障通透性增加,引起连续性肺水肿、气体交换障碍和呼吸窘迫等症状[1-3]。巨噬细胞活化后可被分为两种不同的表型:即具有促炎作用的 M1 型巨噬细胞和具有抗炎作用的M2 型巨噬细胞。研究表明,巨噬细胞可通过调节炎症进程,促进炎症消退和启动肺修复来预防ARDS中的破坏性过程[4-5]。NecroX化合物是一类由吲哚衍生的具有细胞保护作用的细胞渗透性坏死抑制剂,可通过线粒体ROS清除发挥抗氧化活性。NecroX-5可有效抑制氧化应激引起的细胞损伤和死亡[6],并对肝脏疾病和神经退行性疾病等具有治疗作用[7]。本实验通过NecroX-5干预ARDS大鼠探讨其作用,并阐明这种抑制的分子机制。
1 材料与方法
1.1 主要试剂 NecroX-5(美国Biovision),LPS(美国Sigma),TNF-α、IL-6、IL-23、iNOS ELISA检测试剂盒(南京建成),ECL发光液、HE 染色试剂和免疫组化染色试剂(北京索莱宝),RNAiso Plus试剂(美国Thermo Fisher)、SYBR®Prime ScriptTMRT-PCR Kit 试剂盒和SYBR Premix Ex Taq Ⅱ 试剂盒(日本Takara),BCA蛋白定量试剂盒与PVDF膜(上海碧云天),抗体CD86、iNOS、HMGB1、RAGE、β-actin(英国Abcam),FITC标记 CD11c+抗体(美国 BD)。
1.2 实验细胞与动物 巨噬细胞系RAW264.7来源于中国科学院上海细胞库。40只雄性SPF级Sprague-Dawley(SD)大鼠购自广西医科大学实验动物中心,体质量180~220 g。
1.3 动物分组、给药与造模 40 只SD大鼠随机分为对照组、NecroX-5组、LPS组、NecroX-5+LPS组,每组10只。NecroX-5组和NecroX-5+LPS组大鼠造模前7 d腹腔内注射NecroX-5(10 mg/kg)诱导大鼠ARDS模型,每天1次,连续7 d,对照组和LPS组同时注射等量生理盐水。7 d后,LPS组和NecroX-5+LPS组大鼠以2 mg/kg 剂量一次性尾静脉注射LPS,对照组和 NecroX-5组大鼠同时注射等量生理盐水,造模后24 h进行各项检测。
1.4 肺泡灌洗液(BALF)收集与酶联免疫吸附法(ELISA)检测 10%水合氯醛腹腔注射麻醉大鼠,将其四肢及头部固定,消毒后打开胸腔暴露气管,在左主支气管下端切一“十”字形小口,插入插管后进行结扎固定,使用注射器将生理盐水注入肺部进行灌洗,轻柔按摩胸前区,30 s后缓慢抽回灌洗液,再将抽回的灌洗液缓慢注入,重复3次,直到可见乳白色泡沫状液体表示灌洗成功,收集灌洗液,离心后取上清液,通过ELISA试剂盒检测TNF-α、IL-6、IL-23、iNOS水平。
1.5 HE 染色 处死各组大鼠并摘取肺组织,4%多聚甲醛溶液固定,经梯度酒精脱水、常规石蜡包埋后,切成厚度为4 μm的薄片。苏木精染色5 min,流水冲洗,伊红染色液染色3 min,再次流水冲洗,乙醇进行脱水后自然晾干,二甲苯透明10 min,中性树胶封片,显微镜下观察组织病理形态改变并拍照。
1.6 免疫组化染色 将制备的肺组织石蜡切片脱蜡至水,0.01 mol/L枸椽酸盐缓冲液进行抗原修复,3%过氧化氢溶液阻止内源性过氧化物酶的活性。以CD68+与CD86+为细胞标志物标记巨噬细胞,加入抗体后4℃孵育过夜,次日,PBS 冲洗3 次,滴加二抗室温孵育15 min,PBS 冲洗3次,DAB 显色,经复染、脱水、透明后,中性树胶封片,在电子显微镜下观察,并进行图像采集与分析。
1.7 实时荧光定量PCR 按照RNAiso Plus试剂说明提取肺组织总RNA,按照逆转录试剂盒说明合成cDNA,根据 SYBR Premix Ex Taq Ⅱ试剂盒进行qPCR检测基因 mRNA水平,以GAPDH作为内参。反应条件:95℃预变性3 min(1个循环),95 ℃变性20 s、60 ℃ 退火15 s、72 ℃延伸45 s(40 个循环)。引物由上海生工生物有限公司合成,采用2-ΔΔCt法计算各基因mRNA相对表达量。
1.8 Western blot 肺组织和各组RAW264.7巨噬细胞研磨匀浆,加入RIPA裂解液提取总蛋白,BCA试剂盒测定蛋白浓度。以30 μg蛋白上样通过 10% SDS-PAGE电泳分离,并将分离后的蛋白转移至 PVDF膜。TBST 清洗,5%脱脂奶粉室温封闭2 h,然后加入一抗于4℃孵育过夜。次日,TBST 洗膜后,加入二抗室温孵育2 h,TBST清洗,ECL发光液显影,使用Image J系统对各条带进行定量分析。
1.9 巨噬细胞培养、分组与处理 将RAW264.7 巨噬细胞置于含有10%胎牛血清、1%青霉素-链霉素的DMEM 培养基中,在5%CO2、37℃培养箱中过夜培养。细胞以1×105个/孔的密度接种于12孔板,随机分为对照组(正常培养)、NecroX-5组(加入含20μmol/L NecroX-5培养1 h)、LPS+IFNγ组(加入含100 ng/mL LPS和10 ng/mL IFNγ培养24 h)和NecroX-5+LPS+IFNγ组(加入含20μmol/L NecroX-5培养1 h,再加入含 100 ng/mL LPS和10 ng/mL IFNγ培养24 h)。
1.10 流式细胞术 收集各处理组巨噬细胞,消化并离心,加入200 μL PBS重悬细胞,调整细胞浓度至1×106个/mL,取100 μL细胞悬液,分别加入1 μL大鼠抗小鼠F4/80+CD11b+CD11c+(M1巨噬细胞)与F4/80+CD11b+CD11c-(M2巨噬细胞),4℃避光孵育 30 min,PBS洗涤,每管加入200 μL PBS重悬细胞,吹打混匀后,用流式细胞术进行检测,CD11c+标记百分率代表M1极化比例。
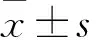
2 结果
2.1 NecroX-5对BALF中TNF-α、IL-6、IL-23与iNOS因子表达的影响 LPS组BALF中TNF-α、IL-6、IL-23、iNOS含量较对照组增加(P<0.05);与LPS组比较,NecroX-5+LPS组TNF-α、IL-6、IL-23及iNOS含量均下降(P<0.05),见表1。

表1 各组大鼠BALF中TNF-α、IL-6、IL-23、iNOS含量比较(n=10,pg/mL)
2.2 NecroX-5对肺组织病理变化的影响 对照组与NecroX-5组大鼠肺组织的肺泡结构清晰,间隔正常,肺泡壁完整,无明显炎细胞浸润现象。LPS组肺组织中可见肺泡结构破坏、断裂,相邻肺泡腔相互融合成肺大疱,出现大量炎性细胞浸润。NecroX-5+LPS组大鼠肺组织肺泡破裂融合以及炎性细胞浸润等情况较LPS组大鼠减轻,见图1。

图1 HE染色检测各组大鼠肺组织病理变化(标尺=50 μm)
2.3 NecroX-5对肺组织中CD68+CD86+阳性表达的影响 与对照组比较,LPS组大鼠肺组织中CD68+CD86+阳性表达升高(P<0.05);NecroX-5+LPS组大鼠肺组织中CD68+CD86+阳性表达较LPS组降低(P<0.05),见图2、表2。

图2 免疫组化染色检测各组大鼠肺组织CD68+CD86+阳性表达(标尺=100 μm)

表2 各组大鼠肺组织中CD68+CD86+阳性表达与iNOS、CD86 mRNA及蛋白表达比较
2.4 NecroX-5对肺组织中 iNOS、CD86 mRNA 与蛋白表达的影响 LPS组肺组织中iNOS、CD86 mRNA与蛋白表达较对照组均增加(P<0.05);NecroX-5+LPS组大鼠肺组织中iNOS、CD86 mRNA 和蛋白表达较LPS组均下降(P<0.05),见图3、表2。

图3 Western blot检测肺组织中 iNOS、CD86 蛋白表达水平
2.5 NecroX-5对肺组织中HMGB1/RAGE信号通路的影响 与对照组比较,LPS组肺组织中HMGB1、RAGE蛋白表达增加(P<0.05);与LPS组比较,NecroX-5+LPS组肺组织中HMGB1、RAGE蛋白表达较LPS组下降(P<0.05),见图4、表3。

图4 Western blot检测肺组织中HMGB1、RAGE 蛋白表达水平

表3 各组大鼠肺组织中HMGB1、RAGE 蛋白表达比较
2.6 各组巨噬细胞表型分析 与对照组比较,LPS+IFNγ组CD11c+标记的M1巨噬细胞百分率升高(P<0.05);与LPS+IFNγ组比较,NecroX-5+LPS+IFNγ组CD11c+标记的M1巨噬细胞百分率下降(P<0.05),见图5、表4。

图5 各组RAW264.7巨噬细胞CD11c+ 表达流式细胞图

表4 各组CD11c+ 标记的RAW264.7巨噬细胞表达与HMGB1、RAGE 蛋白表达比较
2.7 各组巨噬细胞中HMGB1/RAGE信号通路相关蛋白表达检测 与对照组比较,LPS+IFNγ组巨噬细胞中HMGB1、RAGE蛋白表达增加(P<0.05);与LPS+IFNγ组比较,NecroX-5+LPS+IFNγ组巨噬细胞中HMGB1、RAGE蛋白表达下降(P<0.05),见表4、图6。

图6 Western blot检测巨噬细胞中HMGB1、RAGE 蛋白表达
3 讨论
越来越多的证据表明,NecroX-5不仅可以抑制神经元细胞的凋亡,还具有调节免疫系统的作用[8]。>此外,NecroX-5可抑制ROS的产生,在线粒体中表现出抗氧化活性,通过抑制线粒体钙离子单向转运蛋白来防止再氧化损伤[6]。但尚未有研究阐明NecroX-5在ARDS中的保护作用和机制。本研究使用LPS诱导大鼠ARDS,通过肺组织病理检测发现大鼠肺泡结构遭到破坏,并出现大量炎性细胞浸润现象,但经过NecroX-5干预的大鼠肺组织病变现象明显较轻,说明NecroX-5对大鼠ARDS引起的肺损伤具有一定的保护作用。
巨噬细胞作为重要的先天免疫细胞,在炎症环境下可被激活并分化为两种亚型,包括经典激活的巨噬细胞M1和交替激活的巨噬细胞M2。M1巨噬细胞表达CD86等表面标志物,并分泌促炎细胞因子例如iNOS来促进炎症反应并清除病原体,而M2巨噬细胞与免疫调节和耐受性相关,可以表达CD206等表面标志物,可分泌诸如Arg-1等抗炎细胞因子来限制过度的炎症反应,并促进受损组织的修复[5,9-11]。本研究结果表明,在LPS诱导的ARDS大鼠BALF中M1 型巨噬细胞标志物TNF-α、IL-6、IL-23及iNOS的含量升高,同时肺组织中M1巨噬细胞表面标志物CD86表达增加,iNOS、CD86 mRNA与蛋白表达量增加,而通过NecroX-5干预的大鼠BALF中TNF-α、IL-6、IL-23及iNOS的含量均下降,此外,肺组织中CD86表达降低,iNOS、CD86 mRNA与蛋白表达量减少,由此说明巨噬细胞极化在ARDS后炎症反应和肺损伤中发挥重要作用。
本研究通过体外实验进一步观察NecroX-5对RAW264.7巨噬细胞极化的影响。使用LPS和IFNγ诱导体外培养的巨噬细胞向M1型极化,实验结果显示,LPS+IFNγ组细胞中F4/80+CD11b+CD11c+标记的M1巨噬细胞百分率明显升高,而经过NecroX-5预处理后再使用LPS和IFNγ诱导的细胞中F4/80+CD11b+CD11c+标记的M1巨噬细胞百分率明显下降,由此推测NecroX-5可能会减弱LPS+IFNγ诱导的RAW264.7巨噬细胞向M1极化。
为进一步探究NecroX-5发挥作用的可能机制,本研究检测了HMGB1/RAGE信号通路相关分子的表达。实验结果显示,在LPS诱导的ARDS大鼠肺组织中HMGB1、RAGE蛋白表达量增加,而经过NecroX-5干预的ARDS大鼠肺组织中HMGB1、RAGE蛋白表达量则下降。HMGB1是一种DNA结合蛋白,广泛分布在真核生物细胞核中,HMGB1作为一种炎症细胞因子,可以参与巨噬细胞激活与各种免疫疾病的发生发展[12]。HMGB1的促炎作用是通过几种受体介导的,例如TLR2、TLR4和RAGE 受体[13]。其中RAGE是一种跨膜蛋白的免疫球蛋白超家族成员,研究表明,HMGB1可通过调控RAGE受体途径诱导呼吸道炎症和氧化应激损伤[14]。
综上所述,NecroX-5能调控ARDS 过程中M1型巨噬细胞极化,并抑制 ARDS 过程中炎症因子HMGB1、RAGE的表达,使肺组织病理改变减轻,这为NecroX-5应用于 ARDS 临床治疗提供了新的实验基础与依据。

