UPLC-MS/MS法测定包装材料中5种二氨基甲苯的迁移量
李静,张居舟,刘毅,余晓娟
安徽省食品药品检验研究院 安徽国家农副加工食品质量监督检验中心(合肥 230051)
随着欧盟绿色包装法规的实施,食品包装材料中初级芳香胺(PAAs)检测方法的研究日益受到人们的关注。二氨基甲苯类便是禁用PAAs中的一类物质,它包括5种同分异构体,其中2, 4-二氨基甲苯的毒性最大,它对皮肤、黏膜、呼吸道具有刺激性,为致癌物、致突变物[1],已被欧盟法规REACH列入SVHC清单。2, 4-二氨基甲苯是由食品包装材料中残留的未键合的胶黏剂甲苯二异氰酸酯水解产生的[2],它易溶于水、乙醇,极易迁移到食品中,危害人体健康。因此,欧盟(EU)2016/1416[3]与韩国法规[4]规定,复合食品包装材料不可释放出PAAs类物质,特定迁移量均为10 μg/kg;我国规定,2, 4-二氨基甲苯的特定迁移量为4 μg/L[5],该限量比欧盟的要求更严格,且在GB 9685—2016[6]中也未将这5种二氨基甲苯列入可允许使用的范畴。
目前,二氨基甲苯类物质检测方法有GCECD[7-8]、GC-MS[2,4,8,10-11]、LC-MS/MS[12-13]、实时直接分析质谱(DART-MS)法[14]、分子印迹-紫外光谱(MIPs-UV)法[15]等。LC-MS/MS、DART-MS定性可靠、检出限低,具有较好的适用性,但针对食品包装材料中5种二氨基甲苯同分异构体的LC-MS/MS法仍鲜见报道。试验采用UPLC-MS/MS法,能完全分离5种同分异构体,避免了因各同分异构体的质谱特征离子相同而产生的干扰和误判。该方法方便、快捷、灵敏度高、特异性好,能够为生产和监管部门提供可靠的技术保障。
1 试验部分
1.1 仪器与试剂
Agilent 1290-6495超高效液相色谱-三重四极杆质谱仪(美国Agilent公司);XPE205电子天平(梅特勒-托利多公司);移液器(Gilson公司);电热恒温箱(上海三发科学仪器公司);QY-75/126/177C迁移测试池(广州爱测智能科技公司);Milli-Q去离子水发生器(美国Milli-Q公司)。
2, 4-二氨基甲苯(2, 4-TDA,纯度99.8%)、2, 3-二氨基甲苯(2, 3-TDA,纯度99.7%)、2, 5-二氨基甲苯(2, 5-TDA,纯度99.4%)、2, 6-二氨基甲苯(2, 6-TDA,纯度98.9%)、3, 4-二氨基甲苯(3, 4-TDA,纯度99.3%):德国Dr.Ehrenstorfer公司;2, 4-二氨基甲苯-d3(2, 4-TDA-d3,纯度98.2%,加拿大TRC公司);甲酸铵(色谱级,美国ROE公司);甲酸(LC/MS级,美国ACS公司);甲醇(LC/MS级,美国Fisher公司);乙酸、氨水(分析纯,国药集团)。
1.2 标准溶液的配制
标准储备液:称取10.0 mg(精确至0.01 mg)各标准物质,分别置于100 mL容量瓶,用甲醇稀释并定容至刻度,配成100 mg/L的各单标储备液,置于棕色瓶中,于-18 ℃保存。
同位素内标储备液:称取10.0 mg(精确至0.01 mg)2, 4-TDA-d3标准品,置于100 mL容量瓶,用甲醇稀释并定容至刻度,配成100 mg/L的储备液,置于棕色瓶中,于-18 ℃保存。
混合标准系列中间液:分别准确移取1.0 mL各单标储备液,置于10 mL容量瓶,用水定容至刻度,配成10 mg/L混合标准中间液,再用水逐级稀释成20,50,100,200,500,1 000和2 000 μg/L的混合标准系列中间液,置于棕色瓶中,于2~8 ℃避光保存。
同位素内标中间液:精确量取100 μL同位素内标储备液,用水定容至10 mL,配成1 000 μg/L的内标工作溶液,于2~8 ℃避光保存。
混合标准系列工作液:分别量取100 μL混合标准系列中间液,加入100 μL同位素内标中间液,使用空白样品基质定容至10 mL,配成0.2,0.5,1,2,5,10和20 μg/L混合标准系列工作曲线溶液。
1.3 样品前处理
按照GB 5009.156—2016[17]的要求,取已清洁干燥的食品包装材料,取面积大于迁移测试池密封区域的试样,装入预先已达到试验温度的迁移测试池中,加入预先已达到试验温度的4%乙酸溶液,密封。
当被测样品的使用温度低于60 ℃时[5],将装有样品的迁移测试池置于预先调至(60±2)℃的电热恒温箱里,恒温2 h,取出,将4%乙酸溶液转移至烧杯中,冷却至室温,备用。当被测样品使用温度为60~120 ℃时,将装有样品的迁移测试池置于预先调至(120±3)℃的电热恒温箱里,恒温40 min,取出,将4%乙酸溶液转移至烧杯中,冷却至室温,备用。
准确吸取10 mL上述迁移试验溶液于50 mL离心管中,加入100 μL 1 mg/L内标标准溶液,涡旋混匀,用氨水调pH为7.0~8.0,经0.22 μm滤膜后,待仪器测定。
1.4 仪器条件
1.4.1 色谱条件
色谱柱,Waters BEH Phenyl(2.1 mm×50 mm,1.7 μm);流动相,A相为6 mmol/L甲酸铵溶液(pH 4.5),B相为甲醇;梯度洗脱程序见表1;流速,0.3 mL/min;进样量,5 μL;柱温,35 ℃。
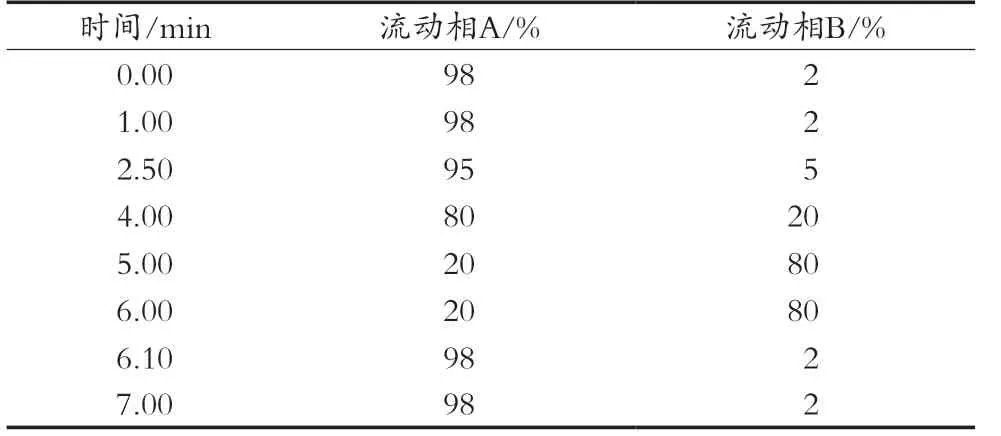
表1 梯度洗脱程序
1.4.2 质谱条件
离子源,电喷雾离子源(AJS ESI);扫描模式,正离子(ESI+);采集方式,多反应监测(MRM);干燥气温度,230 ℃;干燥气流速,18 L/min;雾化气压力,35 psi;鞘气温度,335 ℃;鞘气流速,12 L/min;毛细管电压,3 000 kV;喷嘴电压,500 V;碰撞池加速电压,5 V;定性与定量离子对等参数见表2。

表2 待测物和内标的保留时间及质谱参数
2 结果与讨论
2.1 质谱条件的优化
二氨基甲苯类化合物属于弱碱性物质,选择AJS ESI+扫描方式。这5种二氨基甲苯互为各同分异构体,它们的分子离子峰[M+H]+相同,特征碎片离子也相同,需分别取各单标工作溶液进行全扫描和子离子扫描,并依次优化干燥气温度、干燥气流速、雾化气压力、鞘气温度、鞘气流速、毛细管电压和喷嘴电压,以响应强度相对较低的2, 3-二氨基甲苯优化后的离子源参数为方法的最终质谱条件,选取丰度较强的特征碎片离子分别作为定量及辅助定性离子,进一步优化碰撞能量,形成MRM方法(表2)。
2.2 色谱条件的优化
2.2.1 色谱柱的选择
2, 4-二氨基甲苯与其同分异构体之间的相对分子质量相同、结构相似、极性和溶解性相差不大、质谱的特征离子相同,只有当所有的色谱峰都达到基线分离,才能进行定性定量分析。针对各个化合物的极性强弱及色谱保留机理,试验对C18(2.1 mm×50 mm,1.8 μm)、HILIC(2.1 mm×100 mm,1.7 μm)、Amide(2.1 mm×50 mm,1.7 μm)、Phenyl(2.1 mm×50 mm,1.7 μm)色谱柱进行了筛选,同时结合最佳流动相进行试验,并进一步比较了同填料不同品牌的Waters BEH C18、YMC-Triart C18和Thermo Hypersil-Gold的分离情况,结果表明,待测物在C18柱和Phenyl柱上均能满足分离度要求,在其他填料的色谱柱上不保留或分离效果较差。最终选择峰宽窄且响应强度更高的Phenyl作为色谱分析柱。
2.2.2 流动相的选择
2, 4-二氨基甲苯与其同分异构体的极性均相对较大,且易溶于水、甲醇、乙醇等溶剂,当使用通用的0.1%甲酸/乙腈体系时,无论选择上述哪种类型的色谱柱,待测物均不被保留或者出现色谱峰重叠现象。当使用5 mmol/L乙酸铵/甲醇体系时,在C18和Phenyl柱上各色谱峰峰形均较好,分离情况相同,但2, 3-二氨基甲苯和3, 4-二氨基甲苯峰难以分开;当改变乙酸铵的浓度为10和20 mmol/L时,则峰高随着浓度的升高而略微降低,分离度保持不变。当使用甲酸铵/甲醇体系时,各化合物的响应强度明显增强,但分离度与乙酸铵-甲醇体系相似。于是,试验研究了甲酸铵浓度的影响,分别观察5,6,7,8,10和20 mmol/L甲酸铵溶液的洗脱效果,结果发现当甲酸铵浓度≥6 mmol/L时,随着甲酸铵浓度的增加,各化合物的响应强度已不再增大,但2, 3-二氨基甲苯和3, 4-二氨基甲苯峰仍旧重合。
2.2.3 流动相pH的选择
为将2, 3-二氨基甲苯和3, 4-二氨基甲苯完全分离,试验研究了不同pH的6 mmol/L甲酸铵-甲醇体系中的分离情况。使用甲酸调低pH,当甲酸铵溶液的pH由6.0,5.5,5.0,4.5,4.2和4.0依次降低时,待测物的峰高依次降低,出峰时间随之加快,2, 3-二氨基甲苯和3, 4-二氨基甲苯由重合逐渐分离为两个峰(图1),且pH为4.5,4.2和4.0时分离度均满足要求,考虑到低pH会降低其他化合物的响应强度,并兼顾色谱柱的pH使用范围及寿命,最终选择流动相的pH为4.5。
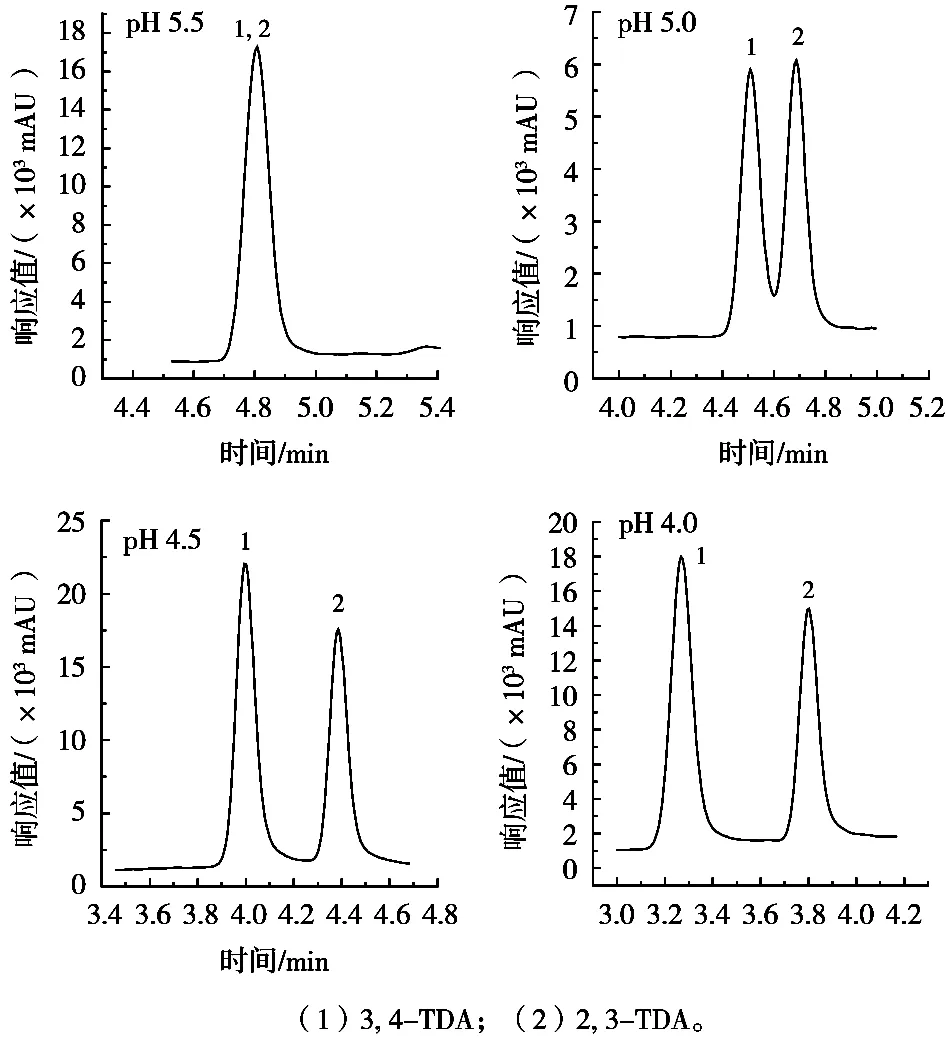
图1 不同pH的流动相对分离效果的影响
2.2.4 洗脱方式的选择
洗脱方式会影响分离度及灵敏度,试验发现,等度洗脱的基线平稳,但保留时间的重现性不稳定;梯度洗脱可缩短分析时间,各化合物响应信号增强显著,且峰的对称性更好(图2)。
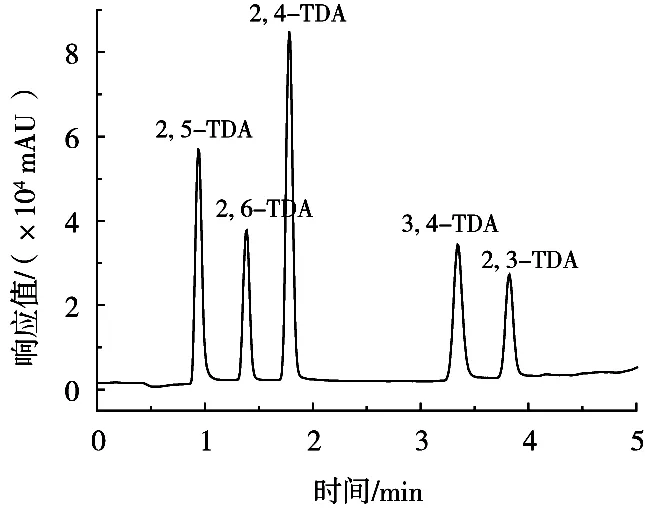
图2 总离子流(TIC)色谱图(2.0 μg/L)
2.2.5 样品试液pH的影响
迁移试验后的样品试液为4%乙酸,用4%乙酸配制标准曲线溶液分析发现,先出峰的2, 5-二氨基甲苯响应强度降低,峰形拖尾严重。如果用氨水将样品试液的pH分别调至5.0,6.0,7.0,8.0,9.0和10.0时,进样分析结果表明,2, 4-二氨基甲苯的响应信号稍微增强,2, 5-二氨基甲苯增强显著,且在试样溶液由中性变至碱性时,强度趋于平缓,峰形对称性良好,而pH对其他化合物的响应强度影响程度甚小,如图3所示。因此,将样品试液pH调至7.0~8.0即可满足检测要求。
图3 样品试液pH对灵敏度的影响
2.3 线性范围、检出限和定量限
样品试液基质能显著影响目标物在色谱柱上的分离行为、峰形及离子化效率等[18]。试验使用调pH后的4%乙酸铵溶液和空白基质样品试液分别配制混合标准工作溶液,考察各待测物的绝对基质效应。结果发现基质效应对2, 4-二氨基甲苯的影响并不明显,但对其他4种同分异构体均有不同程度的抑制效应,故采用空白样品基质溶液配制标准曲线,同时加入适量2, 4-二氨基甲苯-d3作为内标,以消除或补偿基质效应带来的偏差。根据各化合物在总离子流色谱图中的响应强弱,调整各化合物在混合标准溶液中的浓度,配制空白基质混合标准工作液,以定量离子和内标化合物的峰面积比为纵坐标(Y),待测化合物和内标化合物的浓度比为横坐标(X),绘制标准工作曲线,内标法定量。在各化合物的浓度范围内,线性关系良好(r2≥0.998)。
以空白样品基质溶液配制标准曲线的最低点,按1.4小节测定,结果表明,2, 4-二氨基甲苯的检出限(LOD,S/N≥3)和定量限(LOQ,S/N≥10)最低,分别为0.25和0.5 μg/L,其他4种同分异构体的LOD均为0.5 μg/L,LOQ均为1.0 μg/L(表3)。
2.4 方法的回收率与精密度
以阴性食品包装材料为样品进行加标试验,分别添加低、中、高3个浓度水平,每个加标浓度平行测定6次,计算回收率和相对标准偏差(δRSD)。由表3可知各待测物的平均回收率为72%~97%,δRSD(n=6)为2.9%~9.4%。该方法的精密度和准确度均能满足痕量分析的要求。

表3 待测物的方法性能参数
2.5 实际样品检测
实验室随机选取59种市场销售的由纸、塑料薄膜或铝箔经黏合剂(聚氨酯和改性聚丙烯)复合而成的食品包装材料,包括蒸煮袋和普通复合袋,应用该方法进行检测。检测结果发现,检出4个批次的复合包装材料中有2, 4-二氨基甲苯迁移,含量为0.5~2.0 μg/L,其余待测化合物均未检出,阳性样品的TIC图如图4所示。
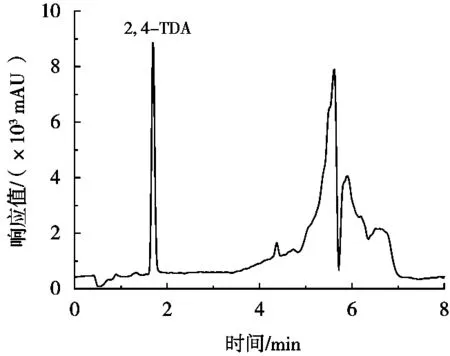
图4 阳性样品的总离子流(TIC)色谱图
3 结论
试验建立了食品包装材料中2, 4-二氨基甲苯及其系列同分异构体迁移量的UPLC-MS/MS同时测定方法。采用迁移测试池进行迁移试验,迁移试液过滤膜后直接进样,前处理操作过程简便快速;优化了的色谱-质谱条件,能够实现各同分异构体在液相色谱柱上的有效分离,内标法定量。该方法定性可靠,定量准确,灵敏度高,可为复合食品包装材料的监督抽查和风险预警提供技术支持。

