巨噬细胞外泌体源miR-223促进胃癌细胞对奥沙利铂的耐药研究
郑培明,李俊蒙,张 鹏,高 岚
1.河南省人民医院检验科,河南 郑州 450003;2.河南省人民医院胃肠外科,河南 郑州 450003
胃癌是全球范围内常见的恶性肿瘤之一,中国是胃癌高发地区,其发病率居恶性肿瘤第3位,死亡率居第2位[1]。由于早诊率低,大多数胃癌患者就诊时已处于晚期,错过了手术机会。以奥沙利铂为基础的化疗是美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐的进展期胃癌患者的一线化疗方案[1-2],然而耐药成为限制患者临床受益、困扰临床医师的一大难题[3]。肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)是肿瘤微环境中免疫细胞的重要组成部分。TAM与肿瘤细胞之间的相互作用促进肿瘤的增殖、转移及耐药等进程[4]。外泌体作为细胞间信息传递的重要媒介,在肿瘤微环境中发挥重要的调控作用[5]。我们的前期研究[6]已证实,胃癌中存在大量TAM,并且可通过外泌体的传递促进胃癌进展。
miRNA是外泌体中非编码RNA的重要组成部分,且发挥着重要的调控作用[7]。我们前期对巨噬细胞来源外泌体miRNA进行芯片分析,结果显示,miR-223表达丰富,miR-223也与多种肿瘤的增殖、转移、耐药等密切相关[8]。本研究拟在前期工作的基础上,探讨巨噬细胞是否通过外泌体传递miR-223促进胃癌细胞对奥沙利铂的耐药及可能的作用机制,旨在为胃癌的防治提供新策略。
1 材料和方法
1.1 细胞系
本实验所使用的单核细胞系THP-1、胃癌细胞系SGC-7901均购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂
细胞培养用的DMEM培养基、RPMI-1640培养基、胎牛血清均购自美国Gibco公司,RNA提取试剂盒购自美国Qiagen公司,mRNA、miRNA反转录试剂盒及SYBR Premix ExTaq实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQPCR)试剂盒购自宝生物工程(大连)有限公司,PCR引物由生工生物工程(上海)股份有限公司合成,transwell小室购自美国Corning公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)及细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,蛋白质印迹法(Western blot)所用FBXW7、MCL1及二抗均购自美国CST公司,GAPDH抗体购自英国Abcam公司,白细胞介素-4(interleukin-4,IL-4)、IL-13等细胞因子购自美国PeproTech公司,LipofectamineTM3000转染试剂购自美国Thermo Fisher公司,miRNA mimics、inhibitor及阴性对照均购自广州锐博生物技术有限公司,Alexa Fluor 488 Phalloidin购自美国Life Technologies公司;常规生化试剂购自上海碧云天生物技术有限公司。
1.3 实验方法
1.3.1 细胞培养
胃癌细胞培养使用DMEM培养基,THP-1细胞用RPMI-1640基础培养基悬浮培养,添加10%的胎牛血清(fetal bovine serum,FBS)、100 U/mL青霉素和100 μg/mL链霉素。所有细胞均在37 ℃、CO2体积分数为5%的恒温箱中温育培养。巨噬细胞的诱导极化:THP-1细胞先加320 nmol/L佛波酯(phorbol-12-myristate 13-acetate,PMA),刺激6 h后加入IL-4(20 ng/mL)+IL-13(20 ng/mL),继续培养48 h。细胞共培养实验采用0.4 μm的transwell小室,提前1 d将需要共培养的胃癌细胞接种至24或12孔板中,待细胞贴壁后加入transwell小室,小室上层接种预先刺激诱导好的巨噬细胞,共培养48 h后收集下层胃癌细胞,用于后续功能试验。
1.3.2 外泌体的分离与鉴定
分离:收集巨噬细胞培养基5 0 mL,2 000×g离心10 min收集上清液,10 000×g离心30 min收上清液,用0.22 μm滤膜过滤1次,100 000×g离心90 min,用磷酸盐缓冲液(phosphate-buffered saline,PBS)重悬后洗涤1次,100 000×g离心70 min,得到纯度较高的外泌体,最后用PBS重悬。透射电镜:吸取样品10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液,吸取醋酸双氧铀10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液,常温干燥数分钟,上机80~120 kⅤ成像观察外泌体的形态。胃癌细胞与巨噬细胞来源外泌体共培养时,首先检测纯化外泌体浓度,然后按1×105个细胞加10 μg外泌体的比例进行共培养。
1.3.3 miR-223 mimics和inhibitor转染
Cy 3 标记的mi R-223 mimics、mi R-223 inhibitor 及相应的阴性对照由广州锐博生物技术有限公司合成,使用转染试剂LipofectamineTM3000转染巨噬细胞。收集转染后的巨噬细胞培养上清液并分离外泌体,然后将其加入胃癌细胞的培养基中。使用Alexa Fluor 488 Phalloidin标记F-actin从而显示细胞骨架,然后通过共聚焦显微镜观察胃癌细胞中是否有Cy3红色荧光。采用CCK-8及凋亡实验观察转染miR-223 inhibitor巨噬细胞来源外泌体共培养的胃癌细胞对奥沙利铂的化疗敏感性。
1.3.4 CCK-8实验
稀释胃癌细胞使其培养液浓度为3×104个细胞/mL,每孔100 μL加到96孔板中,待细胞贴壁生长后加入不同浓度的奥沙利铂,每个浓度每组实验接种5个复孔。48 h后进行细胞活性检测。每次测试加10 μL CCK-8(按1∶10)至待测孔中,混匀,在37 ℃、CO2体积分数为5%的细胞培养箱中放置1~2 h,在酶标仪上测定450 nm处的吸光度(D)值,不同组孔的D值减去空白对照孔的D值的差值反映细胞数量。最后根据实验结果比较各组间差异。所有实验均独立重复3次。
1.3.5 细胞凋亡实验
②数据资源预处理。这个时期是整个数据挖掘过程中最为重要的时期,经过对各种相关数据资源的转化、剖析与处理,不但能让数据更易于被识别,更能切实提升数据挖掘的成效。给后期相关数据的分析与挖掘提供便利,提高数据处理的精准性。比如,依据计算机互联网系统数据包中的端口信息、IP地址、等,对各类数据资源进行分类处理与集合整理,为将来的数据挖掘做好铺垫工作。
用于凋亡检测的胃癌细胞预先与巨噬细胞或巨噬细胞来源外泌体进行共培养,然后加入既定浓度的奥沙利铂作用48 h。胰酶消化细胞,制备单细胞悬液,并进行细胞计数。吸取1×106个细胞加入到5 mL流式细胞术所用试管中。吸取100 μL的细胞悬液至新的流式管中,分别加入5 μL FITC-Annexin Ⅴ和5 μL 7-AAD。轻轻混匀后室温避光反应15 min。每管中加入400 μL 1×结合缓冲液,并在1 h内上机检测。分别计算早期凋亡和中晚期凋亡比例,比较分析各组间差异。
1.3.6 RTFQ-PCR实验
总RNA的提取采用Qiagen试剂盒,mRNA的反转录采用PrimeScriptTMRT Master Mix,miRNA的反转录采用Mir-X miRNA First-Strand Synthesis,PCR按SYBR RTFQ-PCR Kit试剂盒说明书操作,mRNA检测以GAPDH为内参,miRNA检测以U6作为内参,使用7900HT RTFQPCR System(美国Applied Biosystems公司)进行扩增反应,最后使用公式2-ΔΔCt进行不同组间基因表达差异的比较。
1.3.7 Western blot
首先采用含蛋白酶抑制剂的十二烷基硫酸钠(sodium dodecylsulphate,SDS)裂解液裂解细胞及外泌体收集蛋白,采用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度后配置10%的SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)胶80 Ⅴ电泳,半干转印仪转膜、封闭后4 ℃一抗温育过夜,磷酸盐吐温缓冲液(phosphate buffered saline with Tween,PBST)洗膜后温育荧光二抗,用ODYSSEY红外成像系统扫描聚偏二氟乙烯(polyvinylidene fluoride,PⅤDF)膜成像。
1.3.8 血浆标本的收集与分离
分别收集2020年5月—2020年9月河南省人民医院收治的30例胃癌初诊患者及20名同年龄段健康体检者血液标本,两步法分离血浆,4 ℃下3 000×g离心10 min,第2次4 ℃下12 000×g离心10 min,收集上清-80 ℃保存直至外泌体分离。
1.4 统计学处理
2 结果
2.1 巨噬细胞通过外泌体直接传递miR-223至胃癌细胞
首先通过透射电镜、粒径分析技术对巨噬细胞来源外泌体进行鉴定,观察到分离得到的外泌体具有典型的茶杯样结构,大小为80~100 nm,符合外泌体的典型特征(图1A、B)。巨噬细胞转染荧光标记的Cy3-miR-223后分离外泌体并与SGC-7901共培养,采用荧光显微镜在SGC-7901中观测到红色荧光,对照组无荧光(图1C)。RTFQ-PCR检测胃癌细胞中miR-223的表达水平,发现与巨噬细胞共培养后SGC-7901细胞miR-223的表达水平显著升高(7.48±0.66),而用GW4869阻断外泌体分泌后SGC-7901细胞miR-223的表达水平无明显变化(1.49±0.18)(图1D)。SGC-7901细胞直接与巨噬细胞来源外泌体共培养后miR-223的表达水平显著升高(8.52±0.77)(图1E),差异有统计学意义(P<0.05)。
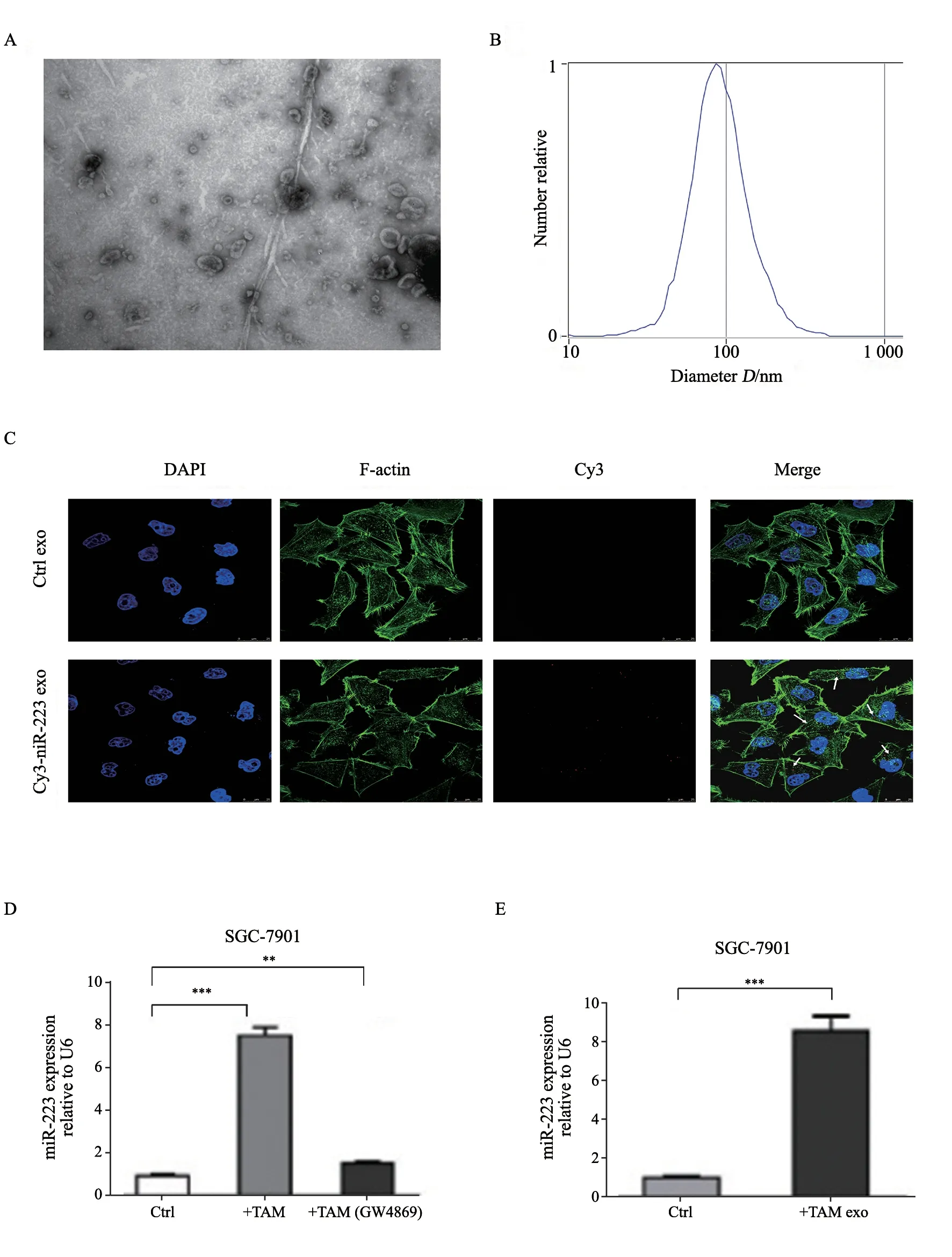
图1 巨噬细胞通过外泌体直接传递miR-223至胃癌细胞Fig.1 Macrophages transmit exosomal miR-223 to gastric cancer cells directly
2.2 巨噬细胞外泌体源miR-223促进胃癌细胞对奥沙利铂的耐药
胃癌细胞SGC-7901与巨噬细胞共培养后,其对奥沙利铂的敏感性降低,半数抑制浓度(half inhibition concentration,IC50)明显升高(12.45±2.29),而用GW4869阻断外泌体分泌后IC50降至正常(5.06±0.29)(图2A)。进一步实验表明,胃癌细胞SGC-7901与巨噬细胞来源外泌体共培养后,其对奥沙利铂的敏感性降低,IC50明显升高(9.77±1.17),而当巨噬细胞转染miR-223拮抗剂后,胃癌细胞SGC-7901 IC50无明显改变(4.79±0.26)(图2B)。此外通过流式细胞术检测细胞凋亡,发现与巨噬细胞来源外泌体共培养后,SGC-7901凋亡率显著下降[(12.5±0.3)%],而当巨噬细胞转染miR-223拮抗剂后,SGC-7901凋亡率无明显改变[(28.7±0.4)%](图2C)。RTFQ-PCR检测发现,与巨噬细胞来源外泌体共培养后,SGC-7901细胞miR-223水平显著升高(9.33±1.02),转染miR-223拮抗剂后,miR-223表达水平恢复正常(1.43±0.45)(图2D)。
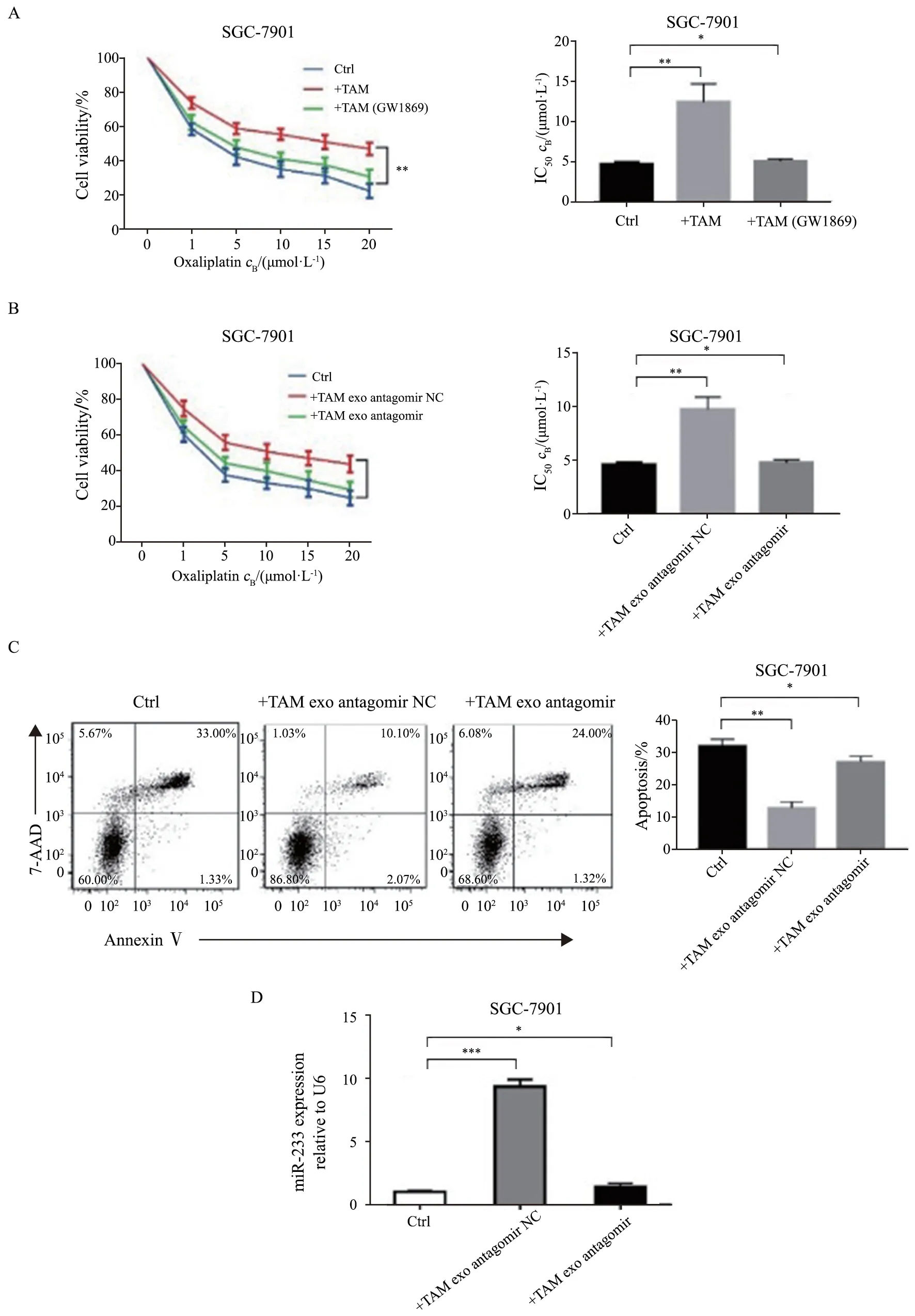
图2 巨噬细胞外泌体源miR-223促进胃癌细胞对奥沙利铂的耐药Fig.2 Exosomal transfer of TAM-derived miR-223 confers oxaliplatin resistance to gastric cancer cells
2.3 外泌体源miR-223促进胃癌细胞对奥沙利铂耐药的机制
之前的研究[9-10]表明,FBXW7是miR-223的重要靶向分子标志物之一,并且在包括胃癌在内的多种肿瘤耐药中发挥重要作用,通过调控MCL1的降解影响细胞凋亡。RTFQ-PCR及Western blot结果显示,与巨噬细胞及其来源外泌体共培养后,SGC-7901细胞FBXW7的表达水平显著下降,MCL1蛋白的表达水平升高,用GW4869阻断巨噬细胞外泌体分泌或转染miR-223拮抗剂后,FBXW7及MCL1蛋白的表达水平无明显变化(图3)。
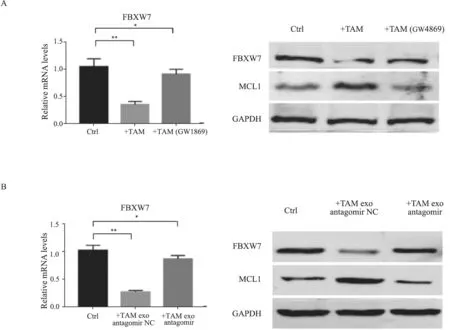
图3 巨噬细胞通过外泌体传递miR-223促进胃癌奥沙利铂耐药的机制Fig.3 Mechanism of TAM-derived exosomal miR-223 promoting oxaliplatin resistance in gastric cancer cells
2.4 血浆外泌体源miR-223在胃癌患者中的表达水平
通过RTFQ-PCR检测不同胃癌患者及健康对照者血液标本中外泌体源miR-223的表达水平,结果表明,肿瘤组患者血浆中外泌体源miR-223的表达水平显著高于健康对照组,而对奥沙利铂耐药的胃癌患者血浆中外泌体源miR-223的表达水平显著高于化疗敏感组(1.28±0.45vs0.51±0.33)(图4)。
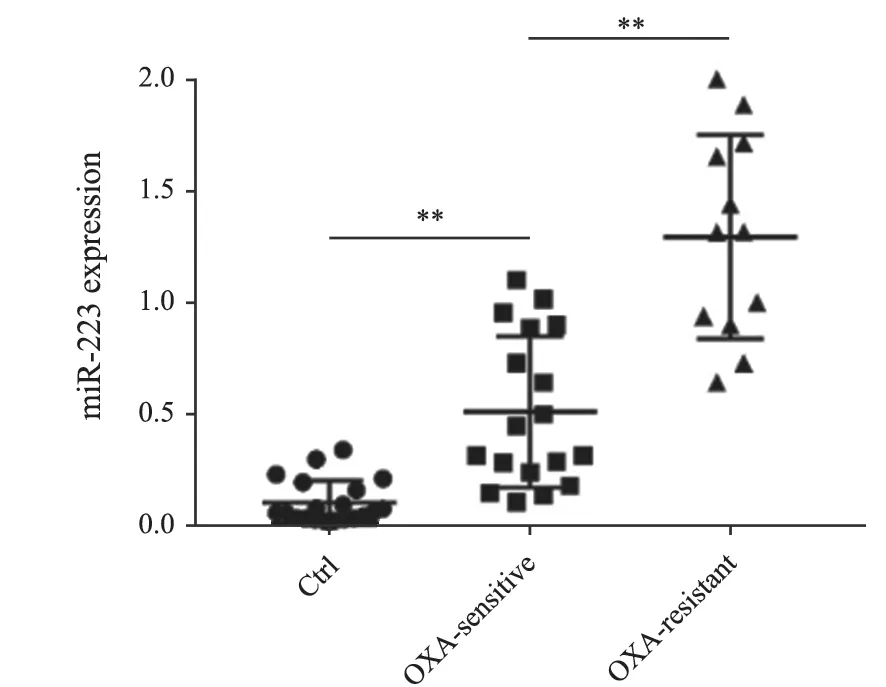
图4 血浆外泌体源miR-223在胃癌患者中的表达水平Fig.4 Expression levels of plasma exosomal miR-223 in different gastric cancer patients and paired healthy controls
3 讨论
随着肿瘤靶向治疗及免疫治疗时代的到来,针对免疫细胞的研究成为近年来的研究热点。作为肿瘤微环境中重要的免疫调节细胞之一,巨噬细胞的极化参与肿瘤进展,同时又受其调控。巨噬细胞通常可分为经典活化(M1)型巨噬细胞和选择性活化(M2)型巨噬细胞,二者可以相互转化[11]。一般来说,M1型TAM具有抗肿瘤作用,M2型TAM具有促肿瘤作用[12]。在包括胃癌在内的大多数实体肿瘤中,TAM主要以M2型为主,TAM的浸润数量、类型等与肿瘤的转移、侵袭、耐药等进程密切相关[13-14]。外泌体是细胞外囊泡的一种,可通过传递miRNA、脂质、蛋白等多种活性分子实现细胞间信息传递[15]。大量研究[16-18]表明,肿瘤微环境中包括TAM在内的基质细胞可通过外泌体的释放,影响肿瘤细胞的特性,促进肿瘤进展。miRNA作为外泌体的重要组成部分,受到外泌体脂质双分子层的包裹不易降解,从而更有利于miRNA的传递及进入目标细胞行使其调控功能[7,15]。
我们的前期研究[6,19]表明,M2型TAM在胃癌组织中大量浸润,其可通过外泌体的传递与胃癌细胞相互作用,从而促进胃癌细胞的侵袭、转移和耐药。本研究表明,体外诱导的M2型巨噬细胞与胃癌细胞SGC-7901共培养后,巨噬细胞可通过外泌体传递miR-223分子至胃癌细胞中,增强胃癌细胞的抗凋亡能力,促进其对化疗药物奥沙利铂的耐药。阻断巨噬细胞中miR-223分子表达后,巨噬细胞促进SGC-7901化疗耐药的作用明显减弱,表明miR-223可能是巨噬细胞通过外泌体促进胃癌细胞耐药的重要参与者。FBXW7被证实是miR-223的重要靶向分子标志物之一[9],其作为p53依赖性肿瘤抑制基因,主要通过泛素化降解途径对下游多个重要癌基因发挥调控作用[10]。有研究[20]表明,miR-223/FBXW7轴在肿瘤细胞对多种药物的耐药中发挥重要的调控作用,与本研究结果一致。初步机制探讨表明,巨噬细胞外泌体源miR-223进入胃癌细胞后,下调FBXW7的表达,解除其对下游基因MCL1的调控,从而增强胃癌细胞的抗凋亡能力,促进胃癌细胞对奥沙利铂的耐药,详细的作用机制有待进一步研究。
作为液体活检的重要研究对象,外泌体在肿瘤的早期诊断、疗效监测及预后评估中具有广泛的应用前景[21]。本研究通过对临床胃癌患者的血液标本进行检测,发现血浆外泌体源miR-223在胃癌患者尤其是奥沙利铂耐药患者中呈显著高表达,提示其有望成为临床胃癌患者疗效监测的有效分子标志物,但此部分研究患者数量较少,存在一定局限性,其临床应用价值有待于更大规模的队列研究予以验证。
综上所述,本研究证实,TAM外泌体源miR-223通过靶向FBXW7促进胃癌细胞对奥沙利铂的耐药,不仅丰富了我们对临床胃癌化疗耐药的认识,同时有望为今后围绕阻断TAM外泌体分泌的基础研究和临床靶向治疗提供新的线索。

