缺氧诱导食管鳞癌细胞中白细胞介素-7表达促进肿瘤进展
陈 杰,王 嫣,张维敏,赵 笛,张凌瑗,詹启敏
北京大学肿瘤医院暨北京市肿瘤防治研究所分子肿瘤学研究室,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
食管癌是常见的消化道肿瘤,中国是食管癌高发国家之一,世界上超过50%的食管癌发生在中国[1-3]。现阶段中国食管癌患者5年生存率为30.3%。食管癌有两种主要的病理学类型,分别为食管鳞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC)。在中国,食管癌的类型主要为ESCC,占95%以上。临床上治疗ESCC的一线化疗药物主要为顺铂,但是其效果不佳,极易出现耐药。此外,ESCC分子分型不明确,导致很多基于分子靶点开展的靶向治疗的效果仍存在争议。因此,阐明诱导ESCC进展的分子机制将为治疗ESCC提供有效的分子靶点。
缺氧是介导实体瘤进展的重要因素[4]。临床研究[5]显示,缺氧与肿瘤患者不良预后密切相关。在基础医学研究中,缺氧能够诱导肿瘤细胞代谢改变、上皮-间质转化(epithelial-mesenchymal transition,EMT)及肿瘤干细胞形成,使肿瘤细胞增殖、侵袭、转移能力增强,并产生放化疗抵抗[6-8]。研究[9]发现,缺氧能够诱导肿瘤细胞自分泌细胞因子,进而促进肿瘤进展。本研究将筛选缺氧诱导ESCC细胞中细胞因子表达谱,并重点研究白细胞介素(interleukin,IL)-7对缺氧情况下ESCC进展的影响。
1 材料和方法
1.1 试剂与耗材
IL-7中和抗体(货号:MAB207)及IL-7酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(货号:HS750)均购自美国R&D公司,细胞因子阵列蛋白芯片(货号:AAH-CYT-6)及蛋白激酶B(protein kinase B,AKT)定量ELISA活性检测试剂盒(货号:PELAKT-S473-T-1)购自美国RayBiotech公司,MTS检测试剂盒(货号:G3580)购自美国Progema公司,RPMI-1640培养基(货号:A1049101)及胎牛血清(货号:10099)均购自美国Gibco公司,transwell侵袭小室(货号:CLS3422)购自美国Corning公司。
1.2 细胞培养
人ESCC细胞系KYSE410和KYSE30均由恶性肿瘤发病机制及转化研究教育部重点实验室保存。细胞在含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基中培养。常氧培养条件为:37 ℃、CO2体积分数为5%。缺氧培养条件为:37 ℃、N2体积分数为94%、CO2体积分数为5%、O2体积分数为1%。
1.3 细胞因子阵列蛋白芯片检测细胞因子分泌
将KYSE410细胞分别置于常氧及缺氧条件下培养。24 h后,收集上清液,将1 mL细胞上清液与包被细胞因子抗体的蛋白芯片于4 ℃过夜温育。之后弃上清液,加入洗液清洗蛋白芯片后,加入辣根过氧化物酶标记链霉亲和素(horseradish peroxidase-streptavidin,HRP-SA)室温温育2 h后,洗去HRP-SA,加入显色液曝光显影。
1.4 MTS法检测细胞增殖能力
取对数生长期细胞,以每孔3 000个细胞的密度均匀接种于96孔板中,待细胞贴壁后,置于缺氧培养环境并加入磷酸盐缓冲液(phosphatebuffered saline,PBS)及IL-7中和抗体。48 h后,每孔加入10 μL MTS溶液。使用酶标仪测定490 nm波长处每孔的吸光度(D)值。实验重复5次取平均值。
1.5 侵袭迁移实验
将KYSE410及KYSE30在不含血清的RPMI-1640培养基中于常氧培养条件下培养。12 h后,收集细胞,以每孔10 000/200 μL的密度接种于覆盖(侵袭实验)或不覆盖基质胶(迁移实验)的transwell小室的上室,下室中加入1 mL含20%胎牛血清的RPMI-1640培养基,缺氧培养条件下培养24 h后取出小室,甲醇固定5 min,结晶紫染色30 min后,擦去上室内的细胞。显微镜下拍照并计数。实验重复5次取平均值。
1.6 ELISA法检测IL-7分泌及AKT活性
在检测IL-7分泌的过程中,将KYSE410及KYSE30细胞分别置于常氧及缺氧培养条件下。24 h后,收集上清液,将20 μL样本与80 μL样本稀释液混匀后,加入96孔板中,室温温育2 h后,洗掉样本。逐步加入一抗稀释液、洗脱、加入HRP-SA、洗脱、加入显色液、置于室温避光温育30 min后,加入终止液,混匀后酶标仪检测D值。实验重复3次取平均值。
在检测AKT活性的过程中,将KYSE410及KYSE30细胞分别置于常氧及缺氧培养条件下。24 h后,收集细胞,用裂解液裂解蛋白,将蛋白裂解液(约20 μg/孔)加入96孔板后,按照试剂盒使用说明检测肿瘤细胞AKT活性(磷酸化AKT Ser473的D值/总AKT的D值)。实验重复5次取平均值。
1.7 统计学处理
采用GraphPad Prism 7.0版统计软件进行数据分析。实验数据均以的形式表示。独立两组间比较使用非配对t检验。量效关系使用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 缺氧诱导ESCC细胞中细胞因子及趋化因子表达谱改变
缺氧微环境可以诱导肿瘤细胞中细胞因子分泌增强,但是缺氧对ESCC细胞中细胞因子表达的调控仍未可知。为明确缺氧调控ESCC细胞中哪些细胞因子,本研究采用细胞因子阵列蛋白芯片技术分析常氧状态下ESCC细胞系KYSE410与缺氧状态下KYSE410中的细胞因子表达谱,发现缺氧处理24 h后,KYSE410细胞分泌多种细胞因子,如IL-10、IL-1β、IL-4、IL-6、IL-7、单核细胞趋化蛋白2(monocyte chemoattractant protein 2,MCP2)、C-C趋化因子配体(C-C motif chemokine ligand,CCL)5、CCL17、CCL18及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等。这些细胞因子均与肿瘤进展关系密切,参与肿瘤细胞增殖、侵袭转移、血管新生及免疫细胞对肿瘤细胞的作用。其中,ESCC细胞在缺氧状态下IL-7的分泌增高最为明显(图1)。

图1 缺氧诱导KYSE410细胞中细胞因子表达谱改变Fig.1 Hypoxia induced the expression profile of cytokines and chemokines of KYSE410 cell
2.2 缺氧诱导ESCC细胞中IL-7分泌增强
进一步研究缺氧是否可以介导ESCC细胞中IL-7分泌增多,以常氧条件培养的KYSE410、KYSE30细胞系为常氧组,缺氧24 h培养的KYSE410、KYSE30细胞系为缺氧组,并通过ELISA法分析两个细胞系中IL-7的分泌情况。ELISA法实验结果显示,缺氧显著诱导ESCC细胞系中IL-7的分泌。对照组KYSE410细胞IL-7分泌量为(275.70±82.98)pg/mL,实验组KYSE410细胞IL-7分泌量为(2 451.00±87.90)pg/mL,差异有统计学意义(P<0.001);对照组KYSE30细胞IL-7分泌量为(325.80±85.46)pg/mL,实验组KYSE410细胞IL-7分泌量为(2 653.00±126.70)pg/mL,差异有统计学意义(P<0.001,图2)。
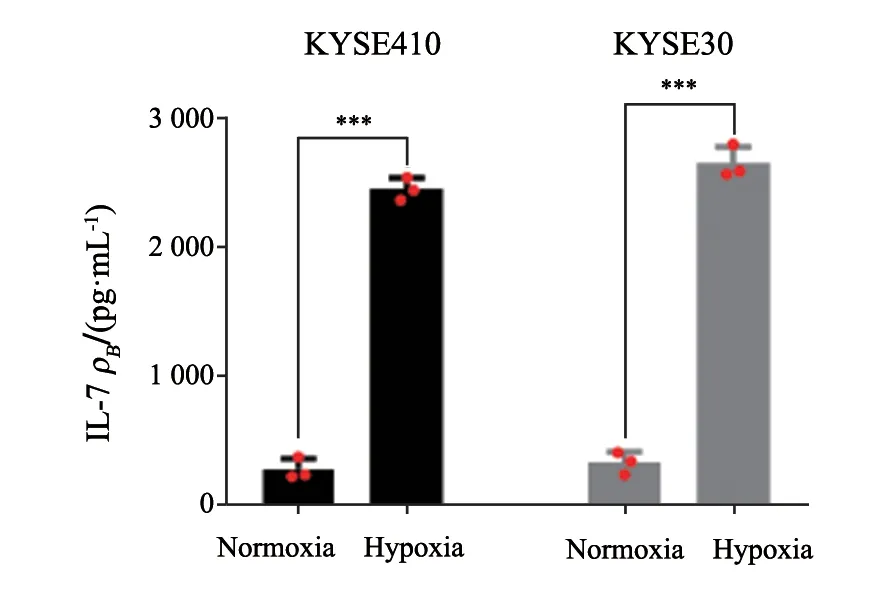
图2 缺氧诱导KYSE410及KYSE30细胞中IL-7分泌增强Fig.2 Hypoxia induced the IL-7 secretion from KYSE410 and KYSE30 cells
2.3 IL-7中和抗体抑制缺氧状态下ESCC细胞的增殖
在缺氧状态下(48 h),以PBS为对照,采用不同浓度的IL-7中和抗体(5、10 μg/mL)处理KYSE410及KYSE30细胞。MTS实验结果显示,IL-7中和抗体能够剂量依赖性地抑制ESCC细胞系增殖。对照组KYSE410细胞相对增殖率(与本组比较)为1.000±0.055,IL-7中和抗体(5 μg/mL)处理KYSE410细胞组相对增殖率(与对照组比较)为0.610±0.026,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE410细胞组相对增殖率(与对照组比较)为0.326±0.022,差异有统计学意义(P<0.001)。对照组KYSE30细胞相对增殖率(与本组比较)为1.000±0.036,IL-7中和抗体(5 μg/mL)处理KYSE30细胞组相对增殖率(与对照组比较)为0.673±0.019,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE30细胞组相对增殖率(与对照组比较)为0.359±0.017,差异有统计学意义(P<0.001,图3)。

图3 IL-7中和抗体抑制缺氧状态下KYSE410及KYSE30细胞的增殖Fig.3 IL-7 neutralizing antibody inhibited proliferation of KYSE410 and KYSE30 cells under hypoxia
2.4 IL-7中和抗体抑制缺氧状态下ESCC细胞的侵袭及迁移
Transwell实验结果显示,相比对照组,随着IL-7中和抗体(5、10 μg/mL)浓度的增高,缺氧状态下,ESCC细胞系KYSE410及KYSE30侵袭及迁移能力显著降低。侵袭实验结果显示,对照组KYSE410细胞相对侵袭率(与本组比较)为1.000±0.117,IL-7中和抗体(5 μg/mL)处理KYSE410细胞组相对侵袭率(与对照组比较)为0.388±0.070,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE410细胞组相对侵袭率(与对照组比较)为0.174±0.025,差异有统计学意义(P<0.001)。对照组KYSE30细胞相对侵袭率(与本组比较)为1.000±0.090,IL-7中和抗体(5 μg/mL)处理KYSE30细胞组相对侵袭率(与对照组比较)为0.433±0.040,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE30细胞组相对侵袭率(与对照组比较)为0.210±0.037,差异有统计学意义(P<0.001,图4A)。迁移实验结果显示,对照组KYSE410细胞相对迁移率(与本组比较)为1.000±0.162,IL-7中和抗体(5 μg/mL)处理KYSE410细胞组相对迁移率(与对照组比较)为0.450±0.080,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE410细胞组相对迁移率(与对照组比较)为0.163±0.028,差异有统计学意义(P<0.001)。对照组KYSE30细胞相对迁移率(与本组比较)为1.000±0.100,IL-7中和抗体(5 μg/mL)处理KYSE30细胞组相对迁移率(与对照组比较)为0.272±0.063,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE30细胞组相对迁移率(与对照组比较)为0.160±0.049,差异有统计学意义(P<0.001,图4B)。

图4 IL-7中和抗体抑制缺氧状态下KYSE410及KYSE30细胞的侵袭转移Fig.4 IL-7 antibody inhibited invasion or migration of KYSE410 and KYSE30 cells under hypoxia
2.5 IL-7中和抗体抑制缺氧状态下ESCC细胞中信号分子AKT的活性
本研究通过ELISA法分析缺氧对ESCC细胞系中AKT活性的影响,结果显示,缺氧24 h后,ESCC细胞系KYSE410及KYSE30中AKT Ser473活性显著上调(图5A)。对照组KYSE410细胞AKT活性为0.454±0.019,实验组KYSE410细胞AKT活性为0.744±0.047,差异有统计学意义(P<0.001),对照组KYSE30细胞AKT活性为0.462±0.037,实验组KYSE30细胞AKT活性为0.809±0.064,差异有统计学意义(P<0.001,图5A)。外加IL-7中和抗体能够有效地抑制KYSE410及KYSE30细胞中AKT Ser473的磷酸化激活(图5B)。对照组KYSE410细胞AKT活性为0.756±0.058,IL-7中和抗体(5 μg/mL)处理KYSE410细胞组AKT活性为0.441±0.038,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE410细胞组AKT活性为0.214±0.028,差异有统计学意义(P<0.001)。对照组KYSE30细胞AKT活性为0.815±0.082,IL-7中和抗体(5 μg/mL)处理KYSE30细胞组AKT活性为0.472±0.04,差异有统计学意义(P<0.001)。IL-7中和抗体(10 μg/mL)处理KYSE30细胞组AKT活性为0.234±0.029,差异有统计学意义(P<0.001,图5B)。
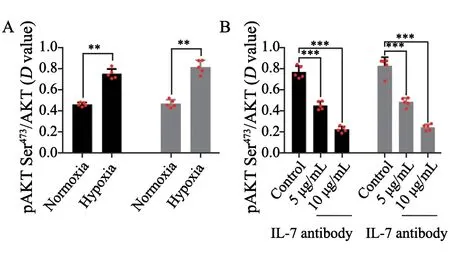
图5 IL-7中和抗体抑制缺氧状态下KYSE410及KYSE30细胞中AKT活性Fig.5 IL-7 antibody inhibited the AKT activity of KYSE410 and KYSE30 cells under hypoxia
A:Quantitative ELISA assay was used to evaluate theDvalue of pAKT Ser473/theDvalue of total AKT (AKT activity) in KYSE410 and KYSE30 cells under normoxic or hypoxic condition for 24 h.B:Quantitative ELISA assay was applied to examine the AKT activity in KYSE410 and KYSE30 cells treated with PBS (control solvent),or IL-7 antibody (5,10 μg/mL),under hypoxia for 24 h.**:P<0.001,compared with normoxia;***:P<0.001,compared with control group
3 讨论
本研究显示,缺氧可诱导ESCC细胞中多种细胞因子及趋化因子的自分泌表达,如TNF-α、IL-1β、IL-6、IL-7、IL-10、MCP2及CCL5等。其中,TNF-α、IL-1β及IL-10是慢性炎症与肿瘤关联的重要细胞因子,这些因子的多态性与肿瘤进展关系密切[10]。IL-6能够通过调控肿瘤细胞可塑性、介导化疗耐药,进而促进肿瘤进展。肿瘤微环境释放的CCL5,能够通过作用于肿瘤细胞中相应受体CCR5,介导肿瘤的多种恶性表型[11]。因此,细胞因子的活性增强是调控肿瘤进展的重要因素之一。
本研究重点阐明了IL-7作为缺氧诱导细胞因子,介导ESCC进展及相关分子机制。IL-7能够产生广泛免疫效应,在免疫细胞活化过程、产生免疫应答效应、调控自身免疫性疾病及抗纤维化中具有重要作用,是细胞因子研究领域的热点因子。在肿瘤学领域,IL-7与肿瘤关系复杂。其中,IL-7参与多种免疫细胞对肿瘤生长增殖的调控。在嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞免疫疗法中,CAR-T细胞中高表达的IL-7能够增加免疫细胞在局部实体瘤的浸润并增强CAR-T细胞的抗癌效应[12]。但是,IL-7的受体IL-7R是一个重要的癌基因,IL-7/IL-7R轴能够通过调控肿瘤细胞中细胞周期蛋白D1的表达,进而促进肿瘤细胞增殖并抵抗凋亡[13]。在细胞实验中,加入IL-7重组蛋白能够通过激活前列腺癌细胞中AKT/核因子κB(nuclear factor-κB,NF-κB)信号转导通路,进而增强基质金属蛋白酶(matrix metalloproteinase,MMP)-3及MMP-9分泌,促进前列腺癌细胞侵袭能力的增强[14]。本研究显示,缺氧ESCC细胞中自分泌产生的IL-7能够介导肿瘤细胞增殖、侵袭及转移,拮抗IL-7的功能显示,抑制缺氧状态下ESCC细胞的增殖、侵袭及转移,证实IL-7是介导肿瘤细胞在缺氧微环境中进展的重要细胞因子。
研究[15]显示,细胞因子介导肿瘤进展主要与激活肿瘤细胞中的信号通路有关。IL-6可以通过激活JAK家族激酶/信号转导与激活转录因子通路促进多种肿瘤进展,且此信号轴是肿瘤治疗中重要的靶点信号轴。多种细胞因子,如TNF-α、IL-1、IL-8、MIP2及CCL2等,均与肿瘤细胞中NF-κB信号通路的激活及多种恶性细胞表型的形成密切相关[16]。有研究[17-18]显示,IL-7能够通过激活信号通路促进肿瘤进展,如磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/AKT通路及JAK1/Stat5信号转导通路。AKT是介导ESCC进展最重要的信号分子,本研究结果显示,拮抗IL-7的功能能够显著抑制缺氧条件下ESCC细胞中AKT的活性,但IL-7能否也通过调控其他信号分子,进而诱导ESCC进展仍有待于进一步研究。
本研究通过蛋白芯片技术研究缺氧介导ESCC细胞中细胞因子的表达情况,并研究了IL-7对缺氧促进ESCC进展的影响及相关分子机制,为深入研究缺氧-细胞因子轴介导肿瘤进展提供了新思路。

