纵向分层应变评价乳腺癌新辅助化疗患者左心室收缩功能
谭雪莹,张 晶,任卫东,于佳慧
(中国医科大学附属盛京医院超声科,辽宁 沈阳 110004)
乳腺癌是女性最常见恶性肿瘤之一。以蒽环类(antharcycline, ANT)为基础的新辅助化疗(neoadjuvant chemotherapy, NACT)对综合治疗乳腺癌具有重要意义[1],但存在不良反应,以心脏毒性最严重,主要表现为心脏收缩功能不同程度减低,出现充血性心力衰竭甚至死亡,是乳腺癌患者除癌症复发外死亡的第二大危险因素[2]。临床常以心肌肌钙蛋白Ⅰ(cardiac troponin Ⅰ, cTnⅠ)、心电图(electrocardiograph, ECG)及超声心动图评价心脏功能,但不易检出早期亚临床心功能损伤[3]。二维斑点追踪成像(two-dimensional speckle tracking imaging, 2D-STI)纵向应变可敏感地定量评价心肌运动。本研究采用2D-STI技术定量分析乳腺癌患者接受NACT期间左心室心肌纵向分层应变,评价其左心室收缩功能变化。
1 资料与方法
1.1 研究对象 回顾性分析2019年1月—10月47例于中国医科大学附属盛京医院接受NACT的乳腺癌患者,均为女性,年龄32~64岁,平均(51.3±52.0)岁;平均收缩压(112.85±8.77)mmHg,舒张压(76.13±4.74)mmHg;心率(72.5±8.2)次/分;体质量指数(20.36±2.13)kg/m2,体表面积(1.63±0.88)m2;其中39例浸润性导管癌和8例浸润性小叶癌。纳入标准:①接受6个周期ANT药物治疗,间期为21天;②超声心动图图像符合2D-STI技术分层应变分析要求。排除标准:①同时接受放射治疗、内分泌治疗或靶向治疗;②存在心血管危险因素如高血压或糖尿病等;③罹患心脏病,如冠心病、心肌病、心律失常或心力衰竭等或应用心脏相关药物;④NACT前心肌酶谱明显异常。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Philips IE33超声诊断仪,S5-1相控阵探头,频率1.0~3.0 MHz,于NACT前(T0)、每次NACT后(T1~T6)进行检查。嘱患者左侧卧、平静呼吸,由2名具有5年以上工作经验的超声科医师测量室间隔舒张末期厚度(interventricular septum thickness at end-diastole, IVSD)、左心室后壁舒张末期厚度(left ventricular posterior wall depth at end-diastole, LVPWD)、左心室舒张末期内径(left ventricular end-diastolic dimension, LVEDD)及左心室收缩末期内径(left ventricular end-systolic dimension, LVESD);采用Simpson法于心尖两腔及四腔切面测量左心室射血分数(left ventricular ejection fraction, LVEF);以脉冲多普勒测量二尖瓣口舒张早期、晚期峰值流速(E、A峰),并计算E/A;于心尖四腔、三腔及两腔切面采集3个心动周期的动态图像,导入Qlab 13.0工作站,以aCMQ斑点追踪软件程序描画心内膜,软件自动追踪心肌,获得各切面左心室内膜下心肌、中层心肌及外膜下心肌的应变曲线及应变值,记录左心室整体纵向应变(left ventricular global longitudinal strain, LVGLS)、心内膜下心肌(global longitudinal strain in subendocardial myocardium, GLS-Endo)、中层心肌(global longitudinal strain in middle myocardium, GLS-Mid)及心外膜下心肌(global longitudinal strain in subepicardial myocardium, GLS-Epi)纵向应变。以上结果均测量3次,计算均值,并保存牛眼图。
1.3 相关指标 获取T0~T6各时间点cTnⅠ值及常规12导联ECG,并计算ECG异常率。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示计量资料,采用重复测量方差分析比较各时间点的相关参数;以百分率表示计数资料,采用χ2检验比较各时间点ECG异常率。P<0.05为差异有统计学意义。
2 结果
2.1 cTnⅠ与ECG T0~T6各时间点cTnⅠ差异均无统计学意义(P均>0.05)。期间ECG出现轻度异常,包括窦性心律不齐、室性期前收缩、房性期前收缩、窦性心动过速及T波改变,但各时间点间差异均无统计学意义(P均>0.05),见表1。
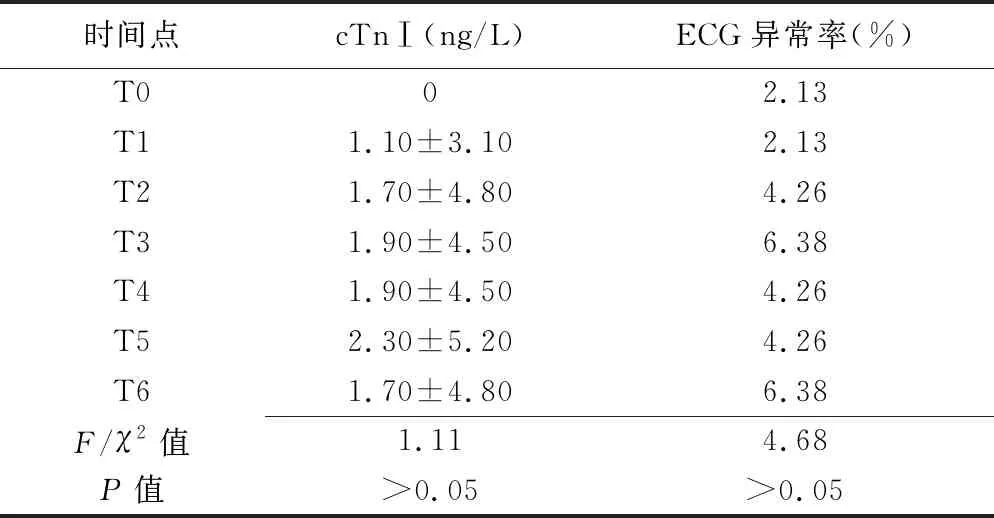
表1 乳腺癌患者NACT前后各时间点cTnⅠ与ECG比较(n=47)
2.2 超声心动图及频谱多普勒参数 T0~T6各时间点常规超声心动图参数IVSD、LVPWD、LVEDD、LVESD及各多普勒参数差异均无统计学意义(P均>0.05);T0~T3时间点间LVEF差异均无明显变化(P均>0.05),T4~T6均较前一时间点及T0明显降低(P均<0.05),见表2。
表2 乳腺癌患者NACT前后各时间点超声心动图及频谱多普勒参数(n=47,±s)
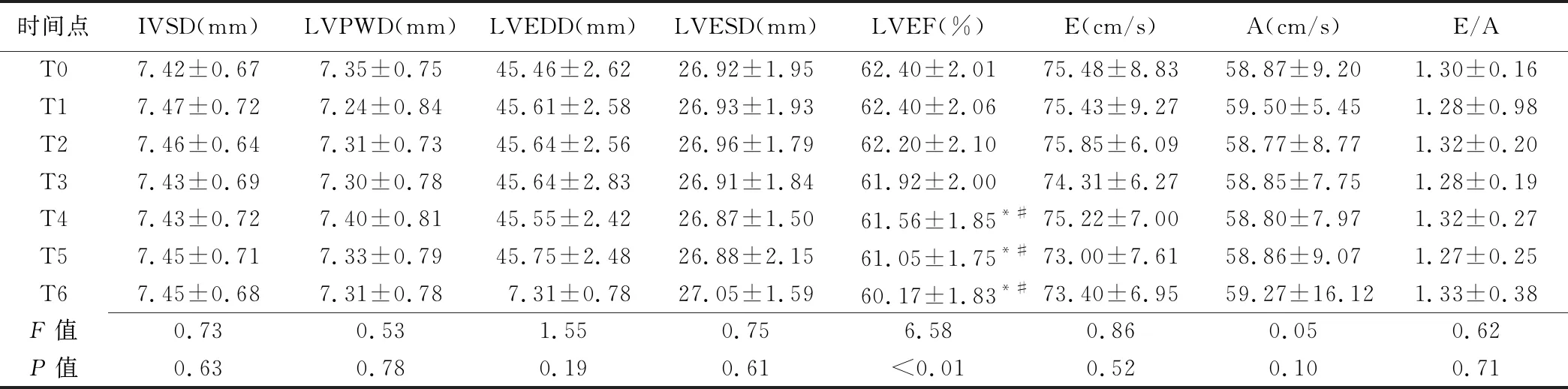
表2 乳腺癌患者NACT前后各时间点超声心动图及频谱多普勒参数(n=47,±s)
注:*:与前一时间点比较P<0.05;#:与T0比较P<0.05
时间点IVSD(mm)LVPWD(mm)LVEDD(mm)LVESD(mm)LVEF(%)E(cm/s)A(cm/s)E/AT07.42±0.677.35±0.7545.46±2.6226.92±1.9562.40±2.0175.48±8.8358.87±9.201.30±0.16T17.47±0.727.24±0.8445.61±2.5826.93±1.9362.40±2.0675.43±9.2759.50±5.451.28±0.98T27.46±0.647.31±0.7345.64±2.5626.96±1.7962.20±2.1075.85±6.0958.77±8.771.32±0.20T37.43±0.697.30±0.7845.64±2.8326.91±1.8461.92±2.0074.31±6.2758.85±7.751.28±0.19T47.43±0.727.40±0.8145.55±2.4226.87±1.5061.56±1.85*#75.22±7.0058.80±7.971.32±0.27T57.45±0.717.33±0.7945.75±2.4826.88±2.1561.05±1.75*#73.00±7.6158.86±9.071.27±0.25T67.45±0.687.31±0.787.31±0.7827.05±1.5960.17±1.83*#73.40±6.9559.27±16.121.33±0.38F值0.730.531.550.756.580.860.050.62P值0.630.780.190.61<0.010.520.100.71
2.3 2D-STI参数 T0时间点,整体心肌、内膜下、中层及外膜下应变曲线走行基本一致,峰值为负(图1)。T0~T6期间各参数呈下降趋势;与T0相比,LVGLS及GLS-Endo于T1开始降低(P均<0.05);GLS-Mid及GLS-Epi于T3开始降低(P均<0.05),见表3;以GLS-Endo下降最为明显(图2)。
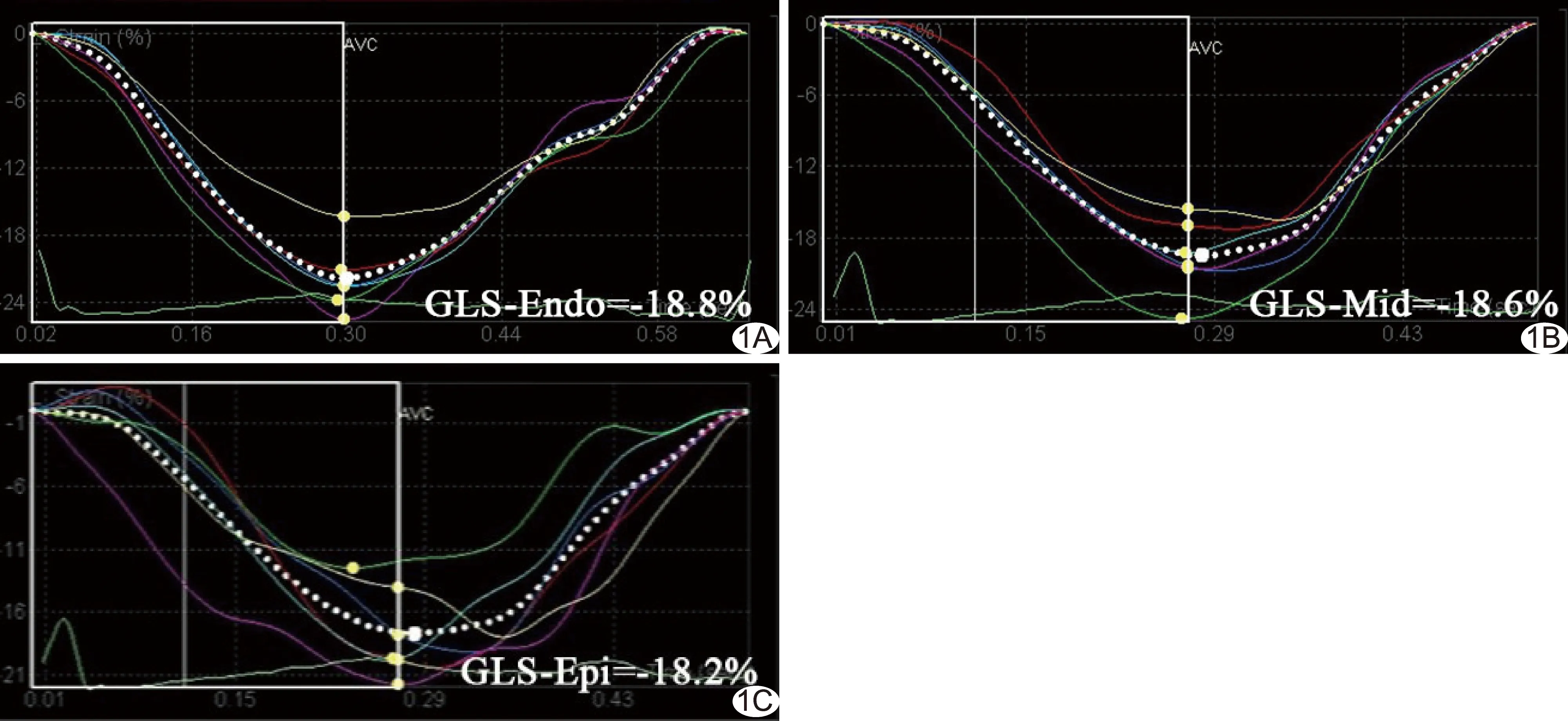
图1 患者女,48岁,乳腺癌,2D-STI显示NACT前心肌纵向应变曲线走行基本一致 A.心内膜下心肌; B.中层心肌; C.心外膜下心肌
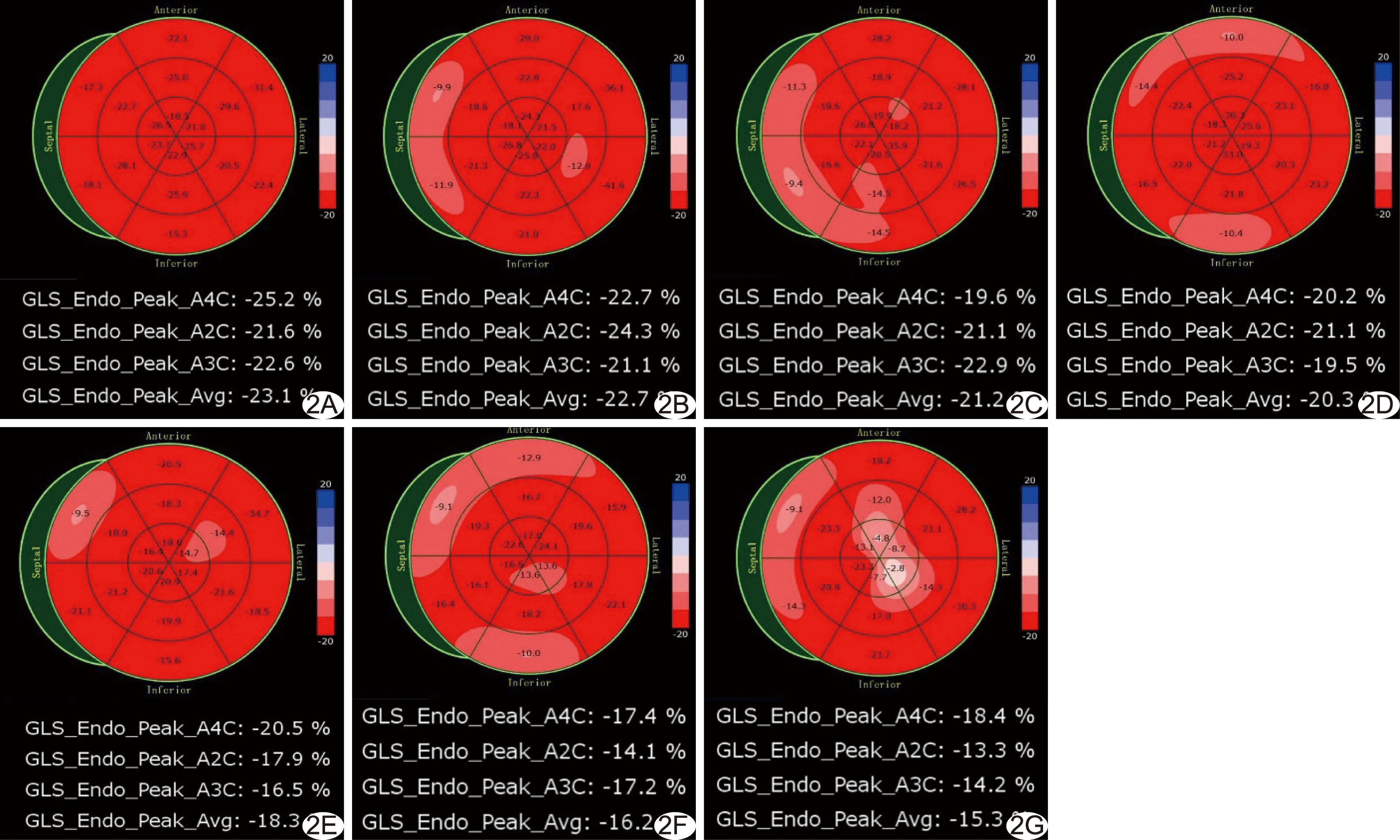
图2 患者女,52岁,乳腺癌,NACT前后T0~T6心内膜下心肌纵向应变牛眼图 A.T0; B.T1; C.T2; D.T3; E.T4; F.T5; G.T6 (GLS-Endo-Peak-A4C:心尖四腔切面纵向应变;GLS-Endo-Peak-A2C:心尖两腔切面纵向应变;GLS-Endo-Peak-A3C:心尖三腔切面纵向应变;GLS-Endo-Peak-Avg:心内膜下心肌纵向应变)
表3 乳腺癌患者NACT前后各时间点2D-STI参数(n=47,±s)

表3 乳腺癌患者NACT前后各时间点2D-STI参数(n=47,±s)
注:*:与前一时间点比较P<0.05;#:与T0比较P<0.05
时间点LVGLS(%)GLS-Endo(%)GLS-Mid(%)GLS-Epi(%)T021.92±1.4223.72±1.6221.68±1.5220.37±1.22T121.74±1.37*#23.29±1.66*#21.53±1.4620.41±1.32T221.05±1.38*#21.55±1.50*#21.28±1.9120.32±1.25T319.96±1.07*#21.04±1.58*#19.98±1.70*#18.87±0.93*#T419.30±1.21*#20.37±1.45*#19.61±1.64*#17.93±0.93*#T518.71±1.20*#19.71±1.59*#19.30±1.60*#17.11±1.05*#T618.14±1.25*#19.24±1.58*#18.86±1.76*#16.32±1.15*#F值3.8593.052.4510.56P值<0.01<0.010.04<0.01
3 讨论
心脏功能会影响实施麻醉和围手术期应激反应,故对计划进行手术的乳腺癌患者需评估其心脏功能[4],临床一般观察2~3个NACT周期。本研究于化疗前及每个化疗周期结束后的7个时间点,即T0~T6,对左心室收缩功能共进行7次评价,详细完整记录各参数的变化特点和趋势,旨在观察心脏功能早期改变。
ANT产生心脏毒性的机制较为复杂,可能因氧化应激导致心肌细胞损伤,也可通过拓扑异构酶激活细胞凋亡通路扰乱钙离子和铁离子稳态,调节某些特定的miRNA、细胞因子、炎症介质、激素受体等多种介质及多个信号通路,最终造成心肌损伤[5]。ANT所致心脏毒性具有剂量依赖性,累积剂量<500、500~600和>600 mg/m2患者发生充血性心力衰竭的风险分别为5%、18%和36%[6]。既往研究[7]认为累积剂量300~700 mg/m2时,心脏收缩功能大多无明显降低;但JURCUT等[8]发现即使ANT累积剂量<300 mg/m2,仍与发生心脏事件的危险比呈指数关系,甚至<200 mg/m2时心脏活检已可发现细胞层次改变。本研究中,随着累积剂量增加,应变绝对值不断减低,与JURCUT等[8]的结果相符合。
临床多通过cTnⅠ、ECG及超声心动图监测心脏功能。根据cTnⅠ变化诊断乳腺癌化疗药物心脏毒性的敏感度较高,但特异度较差,且在体内存在一定时限,可能出现假阴性;而ECG改变通常为非特异性和一过性的。常规超声心动图可评价无症状心脏收缩功能损伤,通常以LVEF<50%或较用药前下降10%判断产生心脏毒性[9],但受心脏负荷的影响,测量误差较大,仅能反映左心室整体收缩功能,且对早期收缩功能改变敏感性差。本研究发现LVEF于T4时间点开始出现明显变化,而其他常规参数在NACT期间均无明显变化,表明常规参数对评价左心室早期的收缩功能改变的敏感性较低。
左心室心肌包括心内膜下、心外膜下的纵行肌纤维(决定纵向运动)及中层的环形肌纤维(决定圆周及径向运动),纵向运动对于维持正常心功能具有绝对优势,故左心室整体纵向应变可用于评价心脏毒性事件[8-9]。本研究发现NACT期间纵向应变降低明显早于LVEF,提示其对于评价心脏早期收缩功能改变的敏感性优于常规超声指标。
本研究中,GLS-Endo于T1时间点开始降低,而GLS-Mid和GLS-Epi在T3开始降低,提示心内膜下心肌对药物损伤反应最为敏感,可能与心内膜下心肌纤维厚密、呈右手螺旋纵斜形走行有关,而中层心肌纤维呈横斜形走行,心外膜下心肌纤维走行虽与心内膜下相同,但较为菲薄;心内膜下心肌主要产生纵向应变,对左心室整体纵向应变的影响最大[10]。此外,ANT在全身循环中的半衰期为30~50 h[6],药物在心腔和冠状动脉系统内往复,经微循环毛细血管壁到达心肌细胞基质,再经被动扩散到心肌细胞,使胞内药物积累浓度达到胞外的10~500倍[11];心腔内的ANT也可通过心内膜-内膜下层对心内膜下心肌产生损伤[7];走行于心外膜的冠状动脉多粗大,而穿入心室壁到达心内膜下后则发出密集的微动脉和毛细血管网,使得心内膜下心肌微循环血管网最为丰富,ANT含量也更多[8]。
综上,2D-STI技术可较准确地发现心脏早期功能受损,以GLS-Endo最为敏感,可为评估接受NACT的乳腺癌患者左心室收缩功能提供重要信息。但本研究观察期短,未进行长期预后相关分析,有待进一步完善。

