基于类芬顿反应构建磁性纳米粒治疗卵巢癌:体外实验
周炜程,李 锐*,张 亮,黄 菊
(1.重庆医科大学附属第三医院超声科,重庆 401120;2.重庆医科大学附属第二医院超声科 超声分子影像重庆市重点实验室,重庆 400010)
近年来开发了多种特异性治疗肿瘤方式[1-2]。在低pH的肿瘤微环境中,类芬顿反应可通过金属离子与过氧化氢(hydrogen peroxide, H2O2)发生氧化反应,产生活性氧而诱导肿瘤细胞死亡[3-4],但肿瘤区域H2O2浓度过低可使类芬顿反应无法达到预期效果;葡萄糖氧化酶(glucose oxidase, GOx)可通过消耗被大量转运的葡萄糖产生H2O2而解决上述问题[5-6]。本研究以聚乳酸羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]包裹四氧化三铁(Fe3O4)和GOx,借助实体瘤的高通透性、滞留效应及外部磁场吸引,使其到达肿瘤区域并释放携带物,在消耗葡萄糖的同时诱导细胞死亡并增强光声信号,为实现诊疗一体化提供实验依据。
1 材料与方法
1.1 主要材料与仪器 PLGA(PLGA-COOH聚合比50∶50,济南岱罡生物科技有限公司),聚乙烯醇(polyvinyl alcohol, PVA, Sigma),异丙醇(iso-propyl alcohol, IPA, Sigma),油酸改性Fe3O4纳米粒(Ocean Nanotech),GOx(Sigma),考马斯亮蓝试剂盒(上海碧云天生物技术公司),细胞计数试剂盒(cell counting kit-8, CCK-8,Dojindo),二甲基亚砜(dimethyl sulfoxide, DMSO, Sigma),3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine, TMB, Sigma),2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorodi-hydrofluorescein diacetate, DCFH-DA, Sigma),人卵巢癌SKOV3细胞(中国科学院上海细胞生物学研究所)。
Sonics 630-0435声振仪,DF-101磁力搅拌器(上海增森仪器科技有限公司),Synergy H1多功能酶标仪,Nikon Ti2倒置荧光显微镜,Malvern Zetasizer Nano ZS90光粒径测量仪,Nikon A1+/A1R+共聚焦激光扫描显微镜(confocal laser scanning microscopy, CLSM),Hitachi S-3400N电子显微镜,Visual Sonics Vevo LAZR光声成像系统。
1.2 制备纳米粒 以双乳化法制备Fe3O4@PLGA-GOx纳米粒。称取50 mg PLGA,溶于3 ml二氯甲烷,充分溶解后加入100 μl Fe3O4溶液(17.61 mg/ml)及200 μl GOx溶液(50 mg/ml),以100 W功率超声混合3 min;加入4% PVA溶液8 ml,继续超声混合2.5 min;加入10 ml IPA溶液后,以磁力搅拌3 h;以双蒸水多次离心洗涤,得到磁性Fe3O4@PLGA-GOx纳米粒(Fe3O4@PLGA-GOx组),4℃保存。以相同方法制备空白纳米粒(PLGA组)、含Fe3O4纳米粒(Fe3O4@PLGA组)及含GOx纳米粒(PLGA-GOx组)。
1.3 基本特性 采用马尔文激光粒径仪检测磁性Fe3O4@PLGA-GOx纳米粒粒径及表面电位,光学显微镜、透射电镜、扫描电镜观察Fe3O4@PLGA-GOx纳米粒形态特征及其在水溶液中的分散情况;以振动样品磁强计测量Fe3O4@PLGA-GOx磁滞曲线。于Fe3O4@PLGA-GOx溶液旁置磁铁,判断纳米颗粒磁性。取提纯离心后的Fe3O4@PLGA-GOx纳米粒上清液,以电感耦合等离子体发射光谱法(inductively coupled plasma atomic emission spectrometry, ICP-AES)检测Fe3O4含量,考马斯亮蓝法检测GOx含量。计算Fe3O4、GOx的包封率及载药量:包封率(%)=(总药物含量-游离药物量)/总药物含量×100%;载药量(%)=(总药物含量-游离药物量)/纳米粒总投入量×100%。
1.4 体外稳定性实验 将Fe3O4@PLGA-GOx纳米粒分别置于磷酸缓冲盐溶液(phosphate buffer saline, PBS)、10%胎牛血清高糖培养基及模拟体液(simulate body fluid, SBF)中,于1、2、4、8、12、24及48 h后以马尔文激光粒径测量仪检测其平均粒径,绘制时间-平均粒径曲线。
1.5 纳米粒释药实验 将5 ml Fe3O4@PLGA-GOx纳米粒(10 mg/ml)置于截留分子量为200 kDa的透析袋中,以封口夹夹闭两端,完全浸没于含50 ml PBS的蓝口瓶中,采用恒温振荡器持续振荡(37℃,150 rpm),并分别于0.125、0.25、0.5、1、2、3、6、9、12、24、36及48 h后取出1 ml透析液,于-20℃储存,同时补充1 ml PBS;取样完成后,以考马斯亮蓝法、ICP-AES法检测GOx及Fe3O4含量,绘制时间-药物释放曲线。
1.6 监测联合催化活性 将4种纳米粒分别溶于DMSO稀释破乳,取25 μl混合液(0.2 mg/ml)分别加入孔板中,每孔加入25 μl TMB溶液(5 mg/ml)、100 μl醋酸缓冲液(pH 5.5)及50 μl葡萄糖溶液(10 mg/ml)。以酶标仪监测生成物640 nm处光密度(optical density, OD),间隔30 s,共监测15 min。
1.7 细胞摄取实验 体外培养人卵巢癌SKOV3细胞,取对数生长期细胞,以1×105个细胞/孔浓度接种于共聚焦皿中。分别于磁靶向和无磁靶向情况下将红色荧光探针(1,1’-Dioctadecyl-3,3,3’,3’-tetramethylindocarbocyanine perchlorate, DiI)标记的1 ml Fe3O4@PLGA-GOx纳米粒(1 mg/ml)与细胞孵育4 h,待细胞摄取后以PBS冲洗,以4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole, DAPI)染料将细胞核染色20 min,去除染色液后以CLSM观察。
1.8 检测体外活性氧 体外培养人卵巢癌SKOV3细胞,取对数生长期细胞,以1×105个细胞/孔浓度接种于6孔板中。将细胞分为4份,分别加入各组纳米粒溶液(0.2 mg/ml)1 ml,培养4 h后以PBS洗涤3次,加入DCFH-DA溶剂后孵育30 min,以荧光显微镜观察活性氧产生情况,以流式细胞术定量检测活性氧。
1.9 细胞毒性实验 将离心洗涤后的各组纳米粒以无血清培养基重悬,配成含20、40、60、80及100 μg/ml PLGA的纳米粒溶液,分别与人卵巢癌SKOV3细胞共同孵育4 h,每组设置5个不同浓度复孔,加入CCK-8溶液染色1 h,采用酶标仪监测450 nm处OD值,计算各浓度下细胞存活率:细胞存活率=[(As-Ab)/(Ac-Ab)]× 100%,As:实验孔的平均OD值(含细胞、培养基、CCK-8溶液和纳米粒溶液),Ac:对照孔的平均OD值(含细胞、培养基、CCK-8溶液,不含药物),Ab:空白孔的平均OD值(含培养基、CCK-8溶液,不含细胞、药物)。此外,单独计算磁靶向和无磁靶向时Fe3O4@PLGA-GOx组细胞生存率。
1.10 体外光声显像 称取适量琼脂,加入双蒸水加热并搅拌,待溶液内气泡消失后倒入200 μl枪头盒中固定,冷却后取出,得到带孔凝胶模型。将Fe3O4@PLGA-GOx配成不同浓度(1、2、3、4及5 mg/ml)溶液,加入不同凝胶孔中,以等量PLGA-GOx组溶液为对照,采用光声成像系统采集体外光声图,并对浓度-光声信号进行线性拟合。
1.11 统计学分析 采用SPSS 20.0统计分析软件。以±s表示计量资料,以单因素方差分析比较Fe3O4@PLGA-GOx纳米粒与PLGA-GOx纳米粒对细胞活性的影响差异;采用t检验评价外部磁场对Fe3O4@PLGA-GOx纳米粒所致细胞活性影响的差异。P<0.05为差异有统计学意义。
2 结果
2.1 基本特性 制备的Fe3O4@PLGA-GOx纳米粒外观呈均匀黄褐色乳液,分散性好;光镜及扫描电镜下见纳米粒大小均一,呈球形(图1A、1B),平均粒径为(290.81±108.52)nm,表面电位(-18.41±5.90)mV;透射电镜下见Fe3O4@PLGA-GOx纳米粒壳有显著突出的黑色铁颗粒,偶见较小纳米粒及游离铁颗粒(图1C)。上清液中Fe3O4的质量为0.139 mg,Fe3O4@PLGA-GOx上清液中GOx的质量为7.353 mg,Fe3O4包封率为(91.34±2.35)%,载药量为(2.81±1.20)%;GOx包封率为(26.53±6.72)%,载药量为(4.61±4.10)%。以振动样品磁强计分别测定室温下Fe3O4及Fe3O4@PLGA-GOx,将Fe3O4包埋于纳米颗粒中,导致其饱和磁化强度从37.33 emu/g降至21.40 emu/g,但磁性并未完全消除(图1D)。外部磁场作用下,Fe3O4@PLGA-GOx纳米粒沿磁场方向移动、聚集(图1E)。

图1 Fe3O4@PLGA-GOx纳米粒基本性质 A.光学显微镜下; B.扫描电镜下; C.透射电镜下; D.磁滞曲线; E.施加外磁场后的纳米粒溶液
2.2 稳定性实验 将Fe3O4@PLGA-GOx纳米粒置于PBS、10%胎牛血清高糖培养基溶液及SBF中48 h后,其粒径无明显变化(图2)。
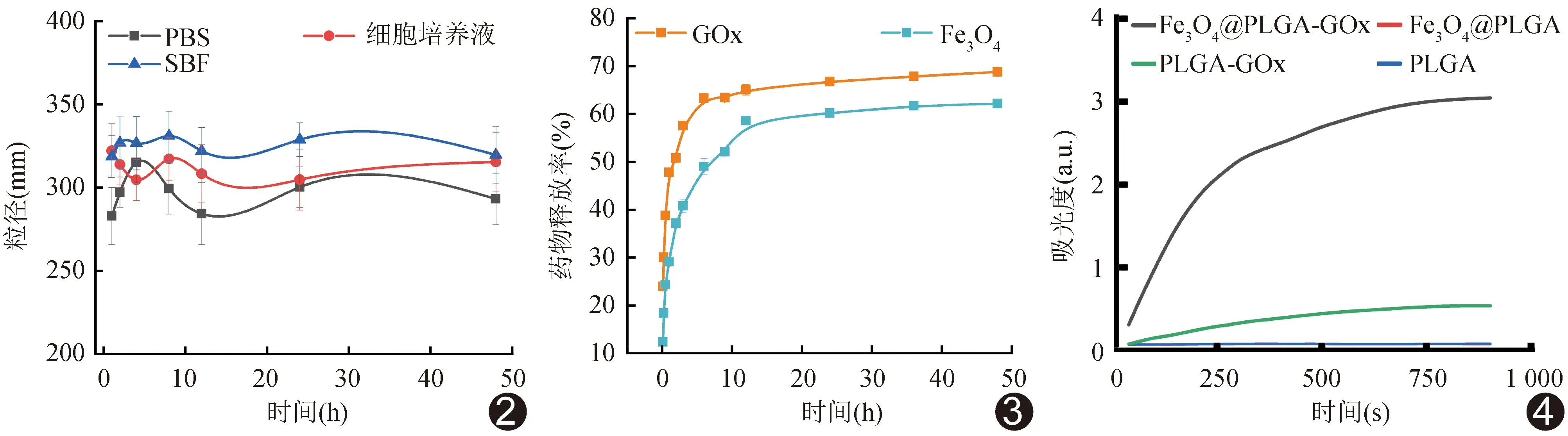
图2 Fe3O4@PLGA-GOx纳米粒体外稳定性曲线 图3 纳米粒体外释药曲线 图4 纳米粒联合催化活性 (PLGA与Fe3O4@PLGA曲线重合)
2.3 体外释药实验 Fe3O4@PLGA-GOx纳米粒中,GOx在0~6 h突释,6 h后释药速度降低,48 h后药物积累释放率68.81%;Fe3O4在0~9 h突释,12 h后释药速度降低,48 h后药物积累释放率62.12%(图3)。
2.4 监测联合催化活性 PLGA组与Fe3O4@PLGA组在640 nm处OD值曲线为2条重合且基本不变的直线,PLGA-GOx组轻度上升,而Fe3O4@PLGA-GOx组迅速上升,随时间推移而出现明显平台期(图4)。
2.5 细胞摄取实验 Fe3O4@PLGA-GOx纳米粒的磁性特性使其通过外磁场在肿瘤区域聚集。施加外磁场后,红色荧光在细胞核周围的聚集程度明显增强(图5)。
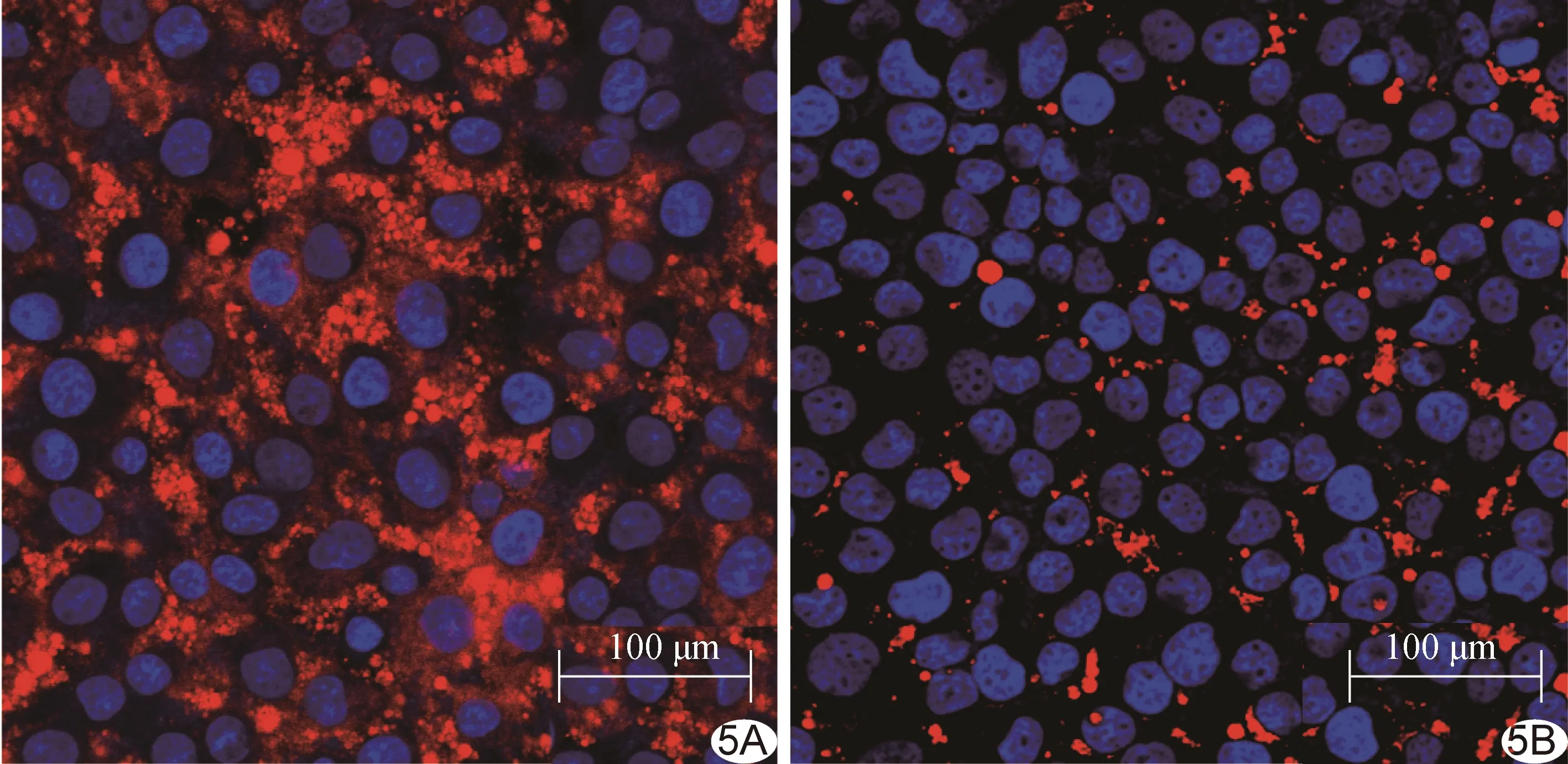
图5 细胞摄取实验 A.施加磁靶向; B.无磁靶向 (红色荧光为Fe3O4@PLGA-GOx纳米粒)
2.6 检测体外活性氧 荧光显微镜下,Fe3O4@PLGA-GOx组可见较强荧光,且形状大致与细胞相同;而PLGA-GOx组可见微弱荧光,Fe3O4@PLGA组与PLGA组则未见荧光反应(图6)。流式细胞技术定量分析结果显示,Fe3O4@PLGA-GOx组活性氧荧光强度83.66%,PLGA-GOx组为33.53%,Fe3O4@PLGA组为10.26%,PLGA组为6.63%。

图6 纳米粒体外活性氧检测图 荧光显微镜下各组纳米粒产生活性氧的明场成像及荧光成像
2.7 细胞毒性试验 相同药物质量浓度条件下,Fe3O4@PLGA-GOx组细胞生存率明显低于其余3组(P均<0.05),即其体外肿瘤细胞增殖抑制效率最高;随药物质量浓度增加,PLGA、Fe3O4@PLGA组细胞生存率差异均无统计学意义(P均>0.05),而Fe3O4@PLGA-GOx、PLGA-GOx组细胞生存率明显下降,提示药物质量浓度越大,对细胞增殖的抑制作用越强(P均<0.05),见表1。通过外部磁场吸引,Fe3O4@PLGA-GOx组细胞生存率明显下降(P均<0.05),见表2。
表1 各组不同浓度纳米粒与人卵巢癌细胞SKOV3共同孵育后的细胞生存率(n=5,±s,%)
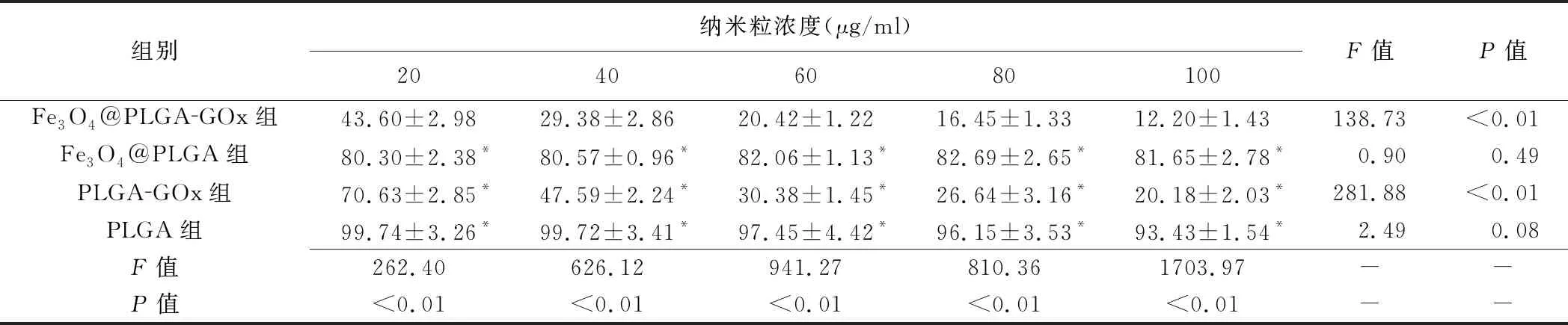
表1 各组不同浓度纳米粒与人卵巢癌细胞SKOV3共同孵育后的细胞生存率(n=5,±s,%)
注:*:与Fe3O4@PLGA-GOx组比较P<0.05
组别纳米粒浓度(μg/ml)20406080100F值P值Fe3O4@PLGA GOx组43.60±2.9829.38±2.8620.42±1.2216.45±1.3312.20±1.43138.73<0.01Fe3O4@PLGA组80.30±2.38*80.57±0.96*82.06±1.13*82.69±2.65*81.65±2.78*0.900.49PLGA GOx组70.63±2.85*47.59±2.24*30.38±1.45*26.64±3.16*20.18±2.03*281.88<0.01PLGA组99.74±3.26*99.72±3.41*97.45±4.42*96.15±3.53*93.43±1.54*2.490.08F值262.40626.12941.27810.361703.97--P值<0.01<0.01<0.01<0.01<0.01--
表2 磁靶向对不同浓度Fe3O4@PLGA-GOx细胞存活率的影响(n=5,±s,%)

表2 磁靶向对不同浓度Fe3O4@PLGA-GOx细胞存活率的影响(n=5,±s,%)
磁场纳米粒浓度(μg/ml)2040无磁靶向43.60±2.9829.38±2.86磁靶向29.47±5.0519.05±7.15t值4.822.69P值<0.01<0.05
2.8 体外光声显像 680~970 nm激光辐照下,Fe3O4颗粒及Fe3O4@PLGA-GOx纳米粒均表现出较强光声信号,并在700 nm处最高(图7A);持续以700 nm激光辐照纳米粒,随纳米粒浓度由1 mg/ml增至5 mg/ml,Fe3O4浓度(x)与光声信号值(y)呈线性关系:y=0.442 4x+0.008,R2=0.99(图7B)。PLGA-GOx纳米粒溶液光声信号较弱,且未见上述改变。

图7 Fe3O4@PLGA-GOx纳米粒光声显像图 A.纳米粒在680~950 nm激光范围内产生的光声信号; B.纳米粒产生的光声信号与Fe3O4浓度的关系图
3 讨论
多数肿瘤细胞新陈代谢远高于正常细胞,依赖于无氧呼吸产生能量的速度[7];广泛的无氧呼吸可降低生长环境的pH、过度活化葡萄糖转运蛋白[5-6]。基于此,针对GOx开发出多种治疗肿瘤方法,如饥饿疗法、缺氧激活疗法及氧化疗法等[8],但均会消耗正常组织的葡萄糖而损伤正常细胞。如何在降低GOx浓度的同时保证疗效成为难点。
短时间内羟基自由基、超氧阴离子或H2O2等活性氧大量聚集可致周围细胞损伤甚至凋亡[4]。低pH环境下,金属离子可与H2O2发生类芬顿反应,产生大量羟基自由基[9]。可通过提高肿瘤环境中的H2O2浓度,以类芬顿反应杀伤肿瘤细胞。
PLGA具备良好的生物安全性及携带能力[10-11],可安全地将GOx、Fe3O4递送至肿瘤区域。GOx可消耗肿瘤的过量葡萄糖,且其分解产物H2O2与Fe3O4发生类芬顿反应可增强针对肿瘤细胞的杀伤作用。此外,Fe3O4所具备的等离子体特性还可用于高分辨率、高敏感度光声成像[12],于治疗同时进行光声监控,实现诊疗一体化。
本研究成功制备了具有类芬顿反应性能的磁靶向纳米粒,电镜下见球形表面存在黑色颗粒,证实Fe3O4被成功包裹于纳米粒壳内;GOx被成功装载于磁性纳米粒中,外部磁场吸引下,该纳米粒可向磁场方向移动。体外试验结果显示,Fe3O4@PLGA-GOx纳米粒被人卵巢癌SKOV3细胞吞噬后,在细胞内产生大量活性氧,氧化-TMB在640 nm处具有较强吸光度。相对于GOx消耗葡萄糖、“饿死”肿瘤细胞的能力,基于类芬顿反应理论的联合催化反应能更有效地诱导肿瘤细胞凋亡,降低正常组织损伤;且低浓度下磁靶向可更好地聚集纳米粒,以杀伤肿瘤细胞。以光声信号最强的700 nm激光进行体外光声成像,纳米粒光声信号随浓度增加而增加,表明该纳米粒具备光声显影能力。
综上,本研究成功制备的磁性纳米粒Fe3O4@PLGA-GOx能显著增强体外光声成像效果,并可于肿瘤特殊微环境下联合催化,诱导肿瘤细胞凋亡。

