三维适形放疗联合化疗对中、晚期食管癌患者近期疗效、毒副反应及远期预后生存的影响
张 仑,蔡金凤,张 华
食管癌是发生在食管上皮组织的恶性肿瘤,在我国恶性肿瘤死亡中位居第四[1]。食管癌按照病理发展可分为早期食管癌、黏膜内癌、最早期浸润癌、黏膜下癌或早期浸润癌及中晚期食管癌。中晚期食管癌患者以进行性吞咽困难、持续性胸背疼痛、声音嘶哑、呛咳、消化道出血等为主要表征,严重者可出现恶病质,预后较差[2]。
目前中晚期食管癌的治疗以手术治疗、放疗联合化疗等综合治疗为主。三维适形放疗(three- dimensional conformal radiotherapy, 3DCRT)是一种体外远距离照射的治疗方式,该法可利用三维图像进行设野,进而解决常规放疗部分靶区遗漏的问题;并减少了周围正常组织及器官的照射,可提高局部控制率及长期生存率[3]。近年来同步化疗成了治疗中晚期食管癌的研究热点,本研究就3DCRT联合化疗对中、晚期食管癌近期疗效、毒副反应及远期预后生存的影响进行了分析,以期为临床治疗该病提供新思路。现报告如下。
1 资料与方法
1.1临床资料 回顾性分析2018年5月—2019年5月本院收治的79例中晚期食管癌患者的临床资料。①纳入标准:均有病理证实,且符合中晚期食管癌诊断标准[4];卡氏(KPS)评分≥70分,预期生存期在6个月以上者;临床资料及随访记录完整者。②排除标准:非原发性食管癌患者;合并严重心血管、血液系统或其他恶性肿瘤等影响生存时间的疾病;肝功能严重异常者;严重精神疾患或痴呆等无法完成所有治疗和随访者;有放化疗禁忌证。按照治疗方法不同分为同步放化疗组45例和放疗组34例。放疗组给予3DCRT治疗,同步放化疗组在放疗组基础上联合化疗。2组性别、年龄、发病部位及TNM分期等资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组中晚期食管癌患者一般资料比较
1.2方法
1.2.1放疗组给予3DCRT治疗:热塑体模及真空负压垫固定体位,标记体表,在患者平静呼吸情况下,连续CT扫描病灶上下各6 cm区域。将CT图像传输到3DCRT计划系统,勾画大体靶体积(GTV),包括原发灶及转移的区域淋巴结;临床靶体积(CTV),即GTV前后左右方向各外扩大0.5~0.8 cm,上下各向外扩大3.0 cm;计划靶体积(PTV)即在CTV基础上再均匀外放0.5~0.7 cm。同时勾画危及器官(OAR),包括脊髓、心脏及两侧肺。根据剂量体积直方图(DVH)及等剂量曲线图确定治疗计划。采用6M-X线治疗,两肺V20<28%,脊髓受量6周<45 Gy,心脏V40≤30%;常规分割每次1.8~2.0 Gy,1/d,每周5 d;放疗剂量为95% PTV 56~60 Gy。
1.2.2同步放化疗组在放疗组基础上联合化疗:放疗方案同放疗组,同时在放疗第1、8、15、22、29、36天给予PC化疗方案。紫杉醇注射液45~50 mg/m2加入5%葡萄糖注射液或0.9%氯化钠注射液500 ml,静脉滴注3 h;卡铂AUC 2加入 0.9%氯化钠注射液500 ml,静脉滴注。在紫杉醇使用前给予盐酸托烷司琼5 mg静脉滴注止吐,紫杉醇静脉滴注前0.5 h嘱患者口服法莫替丁片20 mg保护胃黏膜;地塞米松磷酸钠注射液5 mg静脉推注,异丙嗪注射液25 mg肌内注射,预防化疗药物过敏。
1.3观察指标
1.3.1近期疗效[5]:根据治疗前后食管X线钡餐片、胸部CT改变情况,评价近期疗效,可分为完全缓解、部分缓解、疾病稳定及疾病进展。总有效率=(完全缓解+部分缓解)例数/总例数×100%。
1.3.2生活质量和体力状况:采用《欧洲癌症研究与治疗组织生命质量核心量表第3版(EORTCQLQ-C30 V3.0)中文版》[6]及KPS评分[5]对治疗前后生活质量和体力状况进行评定,两者均以100分为满分,分数越高说明患者的生活质量及体力状况越佳。
1.3.3安全性:化疗毒副反应根据世界卫生组织制定的急性和亚急性毒副反应的表现及分度标准(0度、Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度)[7]进行评估,以百分率(%)的方式体现。
1.3.4远期预后:比较2组治疗1、2年后生存情况,生存时间从第1次放疗或化疗开始计算至末次随访(截至2020年5月31日)或死亡为止[8];并分析影响中晚期食管癌患者预后生存的危险因素。
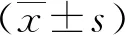
2 结果
2.1临床疗效比较 同步放化疗组临床总有效率高于放疗组,差异有统计学意义(P<0.05)。见表2。

表2 2组中晚期食管癌患者临床疗效比较[例(%)]
2.2生活质量和体力状况比较 2组治疗前生活质量和KPS评分比较差异无统计学意义(P>0.05)。与治疗前比较,2组治疗后生活质量和KPS评分增高,且同步放化疗组高于放疗组,差异有统计学意义(P<0.05,P<0.01)。见表3。
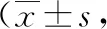
表3 2组中晚期食管癌患者治疗前后生活质量和KPS评分比较分)
2.3毒副反应比较 2组治疗期间均未发生Ⅳ度毒副反应,血小板下降及放射性肺炎发生率组间比较差异无统计学意义(P>0.05)。同步放化疗组白细胞减少、放射性食管炎Ⅱ度、Ⅲ度毒副反应发生率高于放疗组,差异有统计学意义(P<0.05)。见表4。

表4 2组中晚期食管癌患者毒副反应比较[例(%)]
2.4预后生存情况比较 同步放化疗组1、2、3年生存率显著高于放疗组,差异有统计学意义(P<0.01)。见表5。

表5 2组中晚期食管癌患者治疗后生存率比较[例(%)]
2.5影响中晚期食管癌患者预后生存的危险因素分析 年龄、肿瘤位置及放射剂量与食管癌预后生存无相关性(P>0.05),临床分期Ⅲ~Ⅳ期、同步化疗、有淋巴结转移、中高分化程度是影响中晚期食管癌预后生存的独立危险因素(P<0.05,P<0.01)。见表6。

表6 影响中晚期食管癌患者预后生存的单因素和多因素分析
3 讨论
中晚期食管癌即癌细胞已穿透食管黏膜下层,并浸润肌层或食管全层,甚至周围组织[9]。对于大多数中晚期食管癌患者而言,放化疗为其首选治疗手段;但单一治疗方式临床效果依然不理想,尤其是患者远期预后生存率较低。随着医疗技术的不断成熟,多种新型治疗手段得到了广泛应用[10]。
3DCRT主要是通过对PTV的适形度来增加照射剂量,减少正常组织照射体积和剂量,从而在不增加正常组织毒性的基础上提高肿瘤控制率的方式[11]。在食管癌的治疗中,3DCRT相较于常规放射的优势在于:①由于常规X线模拟定位的不准确性和周围重要组织如脊髓、肺的放射耐受性低等原因,常规放射难于提高靶区剂量,并且在常规放射治疗后,残存的肿瘤细胞会出现加速再增殖。而3DCRT技术在没有提高肺平均受量的情况下,提供了对食管肿瘤靶区潜在剂量扩增5~10 Gy的可能,因此可增加肿瘤局部控制率[12]。②3DCRT的剂量分布与肿瘤靶区形状一致,通过共面、非共面多野照射,使肿瘤靶区受到最大剂量的照射;而周围正常组织、器官少受或不受照射,这也为提高靶区剂量、减少正常组织受量提供了物理学基础[13]。Shimizuguchi等[14]研究结果也发现,照射野处方剂量为60 Gy时,常规放疗的GTV覆盖率及CTV远低于3DCRT,进而表明3DCRT技术能使肿瘤靶体积达到理想的剂量分布。
本研究结果显示,有淋巴结转移、肿瘤中高度分化程度为影响食管癌患者预后生存的独立危险因素。Song等[15]研究指出,放疗与化疗同步治疗在提高局部控制率的基础上,可减少肿瘤远处转移,从而达到提高食管癌疗效的目的。临床实践发现,单纯放疗对远处转移的食管癌治疗作用差,可能放疗只能产生局部治疗作用,由此便产生了放疗联合化疗治疗食管癌的策略[16]。本研究在3DCRT基础上采用由紫杉醇和卡铂组成的PC化疗方案进行治疗,结果显示同步放化疗组近期疗效较放疗组更为显著,不仅生活质量和体力状况得到改善,远期预后生存率也明显高于放疗组。有力佐证了3DCRT联合化疗治疗中晚期食管癌效果佳,可改善患者远期预后。分析其原因在于:紫杉醇对肿瘤细胞分裂的抑制作用,可通过与细胞小管结合,促进微管汇聚、稳定微管结构并阻碍其解散,使迅速分裂的细胞生长受到抑制而死亡[17-18]。同时卡铂为细胞周期非特异性药物,具有细胞毒性,能与DNA链交叉连接从而破坏DNA的功能、抑制癌细胞有丝分裂,进而破坏细胞结构[19-21]。卡铂为强蓄积性药物,临床使用过程中易产生多种毒副反应,本研究结果显示,虽然2组均未发生严重毒副反应,但同步放化疗组Ⅱ度、Ⅲ度毒副反应发生率高于放疗组,这也提示在临床应用3DCRT联合化疗治疗方案过程中要注意观察处理毒副反应。
综上所述,3DCRT联合化疗治疗中、晚期食管癌具有良好的近期疗效,毒副反应率相对较高,但可有效提高患者远期生存率,改善预后。

