乳腺叶状肿瘤的MRI表现及病理学分析
潘志远, 张春红, 姚晓军, 元敏
乳腺叶状肿瘤(breast phyllodes tumors,BPT)是临床上一种较少见的纤维上皮性肿瘤,主要由上皮和间质细胞组成,根据组织学特征可分为良性、交界性和恶性病变[1-2]。BPT好发于中老年女性,对放化疗不敏感,主要以手术切除为主,包括局部切除和根治性乳房切除术,交界性及恶性病变的BPT术后复发率高,易转移,因此提高BPT术前诊断率并选择合适的手术方式,对降低术后复发风险是十分重要的[3-4]。既往对乳腺病变组织穿刺进行病理学检查为术前诊断的金标准,但BPT具有明显的异质性,选取代表性组织困难,术前诊断良恶性病变的效率较低[5]。磁共振成像(magnetic resonance imaging,MRI)能够较为系统地观察乳腺的形态学及内部特征,可提示病理学特征变化,对手术方式的选择及降低复发率尤为重要[2]。本研究拟对BPT患者进行术前MRI检查分析,并探讨MRI表现与术后乳腺肿块病理学分级的相关性,为提高术前诊断率、选择最佳手术方式及精准判断预后提供一定的理论依据。
1 资料与方法
1.1 临床资料 回顾性分析2014年1月至2019年12月在深圳市龙华区中心医院、深圳市中医院乳腺外科收治的70例经术后病理学确诊为BPT患者的临床资料,其中良性38例,交界性19例,恶性病变13例,均为女性,年龄18~75岁,平均年龄(44.2±20.6)岁,均为单侧乳房病变,左乳25例,右乳45例,肿块最大直径为1.9~13.5 cm,病程为2 d~17年,可触及肿块质硬、边界清晰、表面光滑、活动度可、无压痛,有4例可触及腋下肿大淋巴结。
1.2 MRI影像学检查 采用Philips 3.0MRI设备进行多通道控阵线圈,患者平躺俯卧位,采用T1加权成像(T1 weighted imaging,T1WI)序列、T2加权成像(T2 weighted imaging,T2WI)序列、扩散加权成像(diffusion weighted imaging,DWI)序列进行扫描,层厚4.5 mm,层间距0.5 mm,矩阵 384×224,对双侧乳腺矢状面进行动态增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)分析,然后再采用三维的快速梯度回波序列扫描成像技术,参数:TR 5.1 ms,TE 2.5 ms,翻转角15°,矩阵256×328,FOV 260 mm×300 mm,层厚1.5 mm。注入对比剂前进行T1WI压脂图像作为蒙片,对比剂用钆喷酸葡胺(Gd-DTPA),剂量0.2 ml/kg,速率2 ml/s,注射完后连续进行7期时相扫描,对比剂用完后立即使用等量的生理盐水,单期扫描时间90 s,最后采用横轴位容积成像技术行延迟时相序列扫描。结合MRI横断位T1WI和T2WI图像,确定病灶的DWI图及ADC图位置。
1.3 图像处理及数据分析 采用核磁后处理图像工作站平台对乳腺MRI的影像学特征进行分析,根据美国放射学院(ACR)的乳腺影像报告和数据系统(BI-RADS),由两名具有经验的主治医师分析,包括MRI肿瘤病变的形态学上特征(形状、边界、大小)及影像学上特征[信号特征、强化方式、时间-信号强度曲线类型(time-signal intensity curve,TIC)]及表观弥散系数值(apparent diffusion coefficient,ADC),根据磁共振矩阵中每个元素值的大小与每个体素磁共振信号的强度的比值,所得的磁共振图像以灰度值显示出来,而不同灰度值大小代表信号强度的不同,信号特征分析包括T1WI和T2WI序列信号强度(高信号、等信号和低信号)及信号均匀性(均匀和不均匀)等特点。利用后处理器的功能软件绘制TIC曲线,根据KuhⅡ分型对TIC进行分型,Ⅰ型:病灶呈缓慢持续上升的信号(上升型);Ⅱ型:病灶呈早期上升迅速的信号,中后期维持稳定(平台型);Ⅲ型:早期病灶,见明显强化信号,中后期强度逐步降低(流出型)。采用整体容积法(半自动勾划整个肿块的容积)选取3个相同体积且强化明显的感兴趣区(region of interest,ROI)测量ADC值,取平均值。
1.4 病理学检查 病灶组织经4%甲醛溶液固定后包埋切片,脱蜡处理后行苏木精-伊红染色,在光学显微镜下对切片进行分析。依据核分裂象多少、细胞的形态、异质性及周围组织浸润、间质细胞增生情况等将BPT分为3型[6],良性病变:核分裂象≤4个、膨胀性边缘、无或轻度间质细胞异形增生;交界性病变:核分裂象5~9个、膨胀性或浸润性边缘、中度间质细胞异形增生;恶性病变:核分裂象≥10个、浸润性边缘、中至高度间质细胞异形增生。
1.5 统计学方法 采用SPSS21.0软件进行统计分析,病灶的MRI图像上形态学及影像学特征与不同级别的BPT组间的差异应用多组间χ2检验或非参数Kruskall-Wallis检验,P<0.05为差异具有统计学意义。
2 结果
2.1 BPT患者的MRI形态学特征 70例乳腺叶状肿瘤患者术前MRI检查,术后病理学检测发现BPT良性病变占54.3%(38/70),交界性病变占27.1%(19/70),恶性病变占18.6%(13/70),交界性和恶性病变核分裂多、呈膨胀性或浸润性生长、间质细胞异质性增生;病灶形态学上,多呈分叶状,其中良性病变占73.7%(28/38),交界性病变占52.6%(10/19),恶性病变占76.9%(10/13);病灶边界清晰上,良性病变占92.1%(35/38),交界性病变占89.5%(17/19),恶性病变占61.5%(8/13),各组间差异无统计学意义(P>0.05);良性病变、交界性病变及恶性病变的肿瘤大小分别为(4.42±2.36)cm、(6.24±2.76)cm、(9.61±3.75)cm,组间差异有统计学意义(P<0.05),见表1。
2.2 BPT患者的MRI影像学特征 病灶T1WI序列中,病变呈低或等信号,良性病变占比94.7%(36/38),交界性病变占比78.9%(15/19),恶性病变中占比23.1%(3/13),而TIWI序列高信号中,良性病变占比5.3%(2/38),交界性病变占比21.1%(4/19),恶性病变占比76.9%(10/13);脂肪抑制的T2WI序列不均匀信号中,良性病变占比31.6%(12/38),交界性病变占比52.6%(10/19),恶性病变占比84.6%(11/13);动态增强核磁序列不均匀强化灶中,良性病变占比31.6%(12/38),交界性病变占比52.6%(10/19),恶性病变占比92.3%(12/13);3组间的时间-强度的TIC曲线主要呈Ⅱ、Ⅲ型中,良性病变占比42.1%(16/38),交界性病变占比89.5%(17/19),恶性病变占比84.6%(11/13)。可见,在MRI图像的影像学特征上,良性病变的T1WI序列多呈低信号,T2WI多呈均匀高信号,动态增强核磁序列均匀强化,恶性病变T1WI序列多呈高信号,T2WI多呈不均匀高信号,动态增强核磁序列不均匀强化,3组间TIC曲线以Ⅱ、Ⅲ型为主,差异有统计学意义(P<0.05)。在MRI的DWI图像上,BPT多呈高信号,对患者进行ADC值计算,良性病变、交界性病变及恶性病变分别为(1.55±0.26)×10-3mm2/s、(1.41±0.24)×10-3mm2/s、(1.34±0.31)×10-3mm2/s,组间差异无统计学意义(P>0.05)。详见表1和图1~图3。
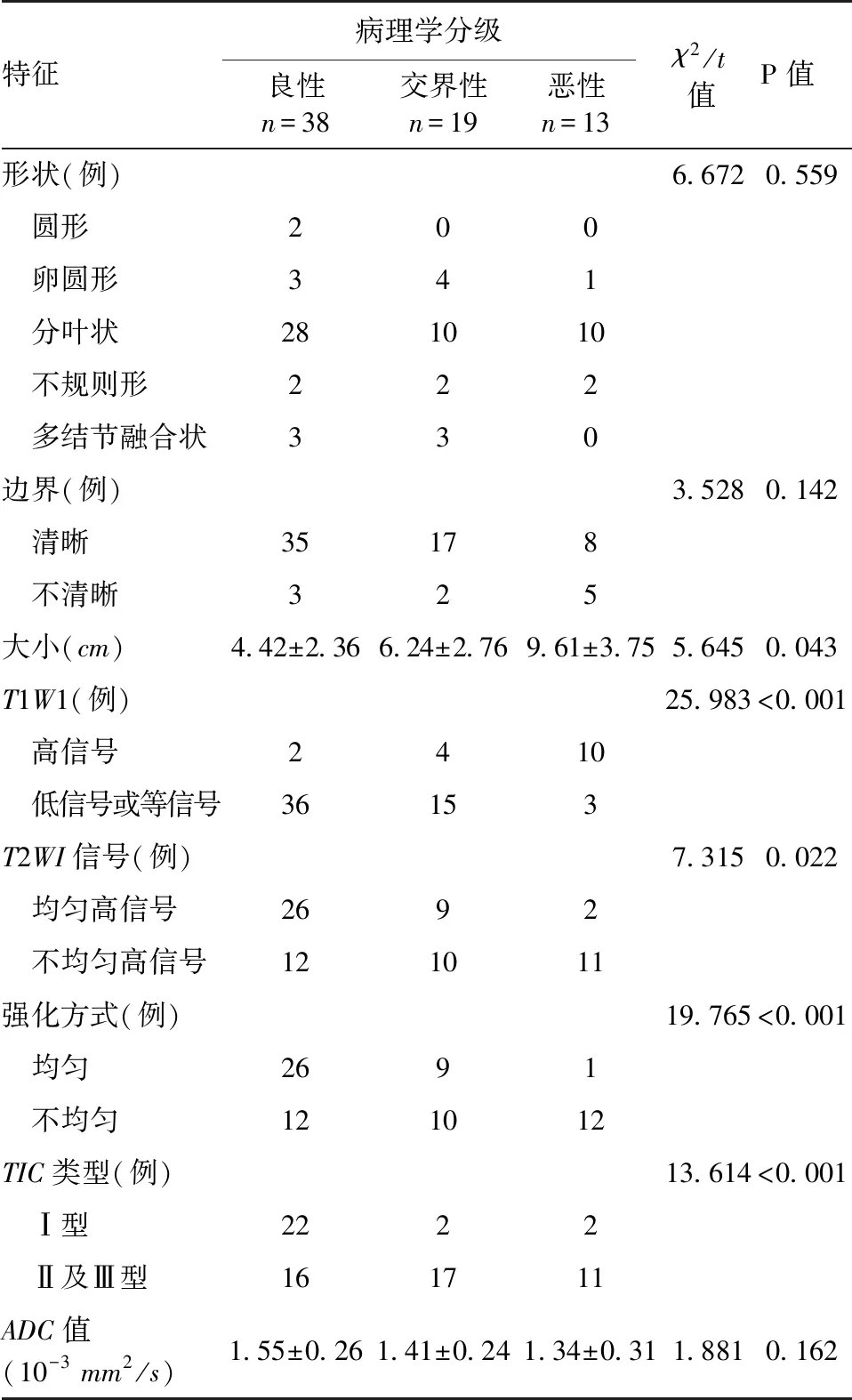
表1 BPT患者叶状肿瘤的MRI表现
3 讨论
BPT是由腺上皮和间叶组织组成的一种罕见的乳腺肿瘤,占乳腺肿瘤的0.3%~1.0%[7]。根据病灶异质性特征,可分为良性、交界性或恶性病变,其中良性病变复发率为5%~30%,交界性和恶性病变复发率高达30%~65%[2,8-10]。手术切除是BPT患者的主要治疗手段,但手术治疗方案选择仍具有争议性[2]。因此,准确的术前诊断对于合理的临床策略抉择是至关重要的,以避免因手术切除范围不充分或手术过度治疗引起的相关并发症。
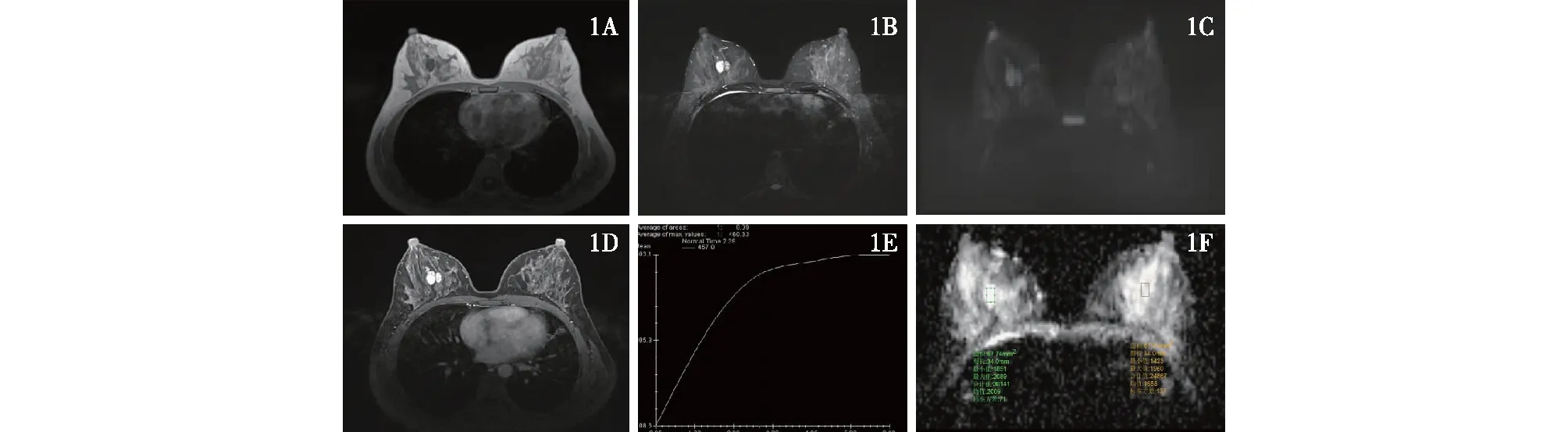
1A:右乳圆形肿块,大小22 mm×19 mm×18 mm,边界清晰,T1WI呈稍低信号;1B:T2WI呈高信号;1C:DWI呈均匀稍高信号;1D:增强图呈明显稍不均匀强化;1E:TIC曲线呈Ⅰ型(渐增型);1F:ADC值约2.0×10-3mm2/s,腋窝未见明显肿大淋巴结影图1 右乳良性叶状肿瘤的MRI表现
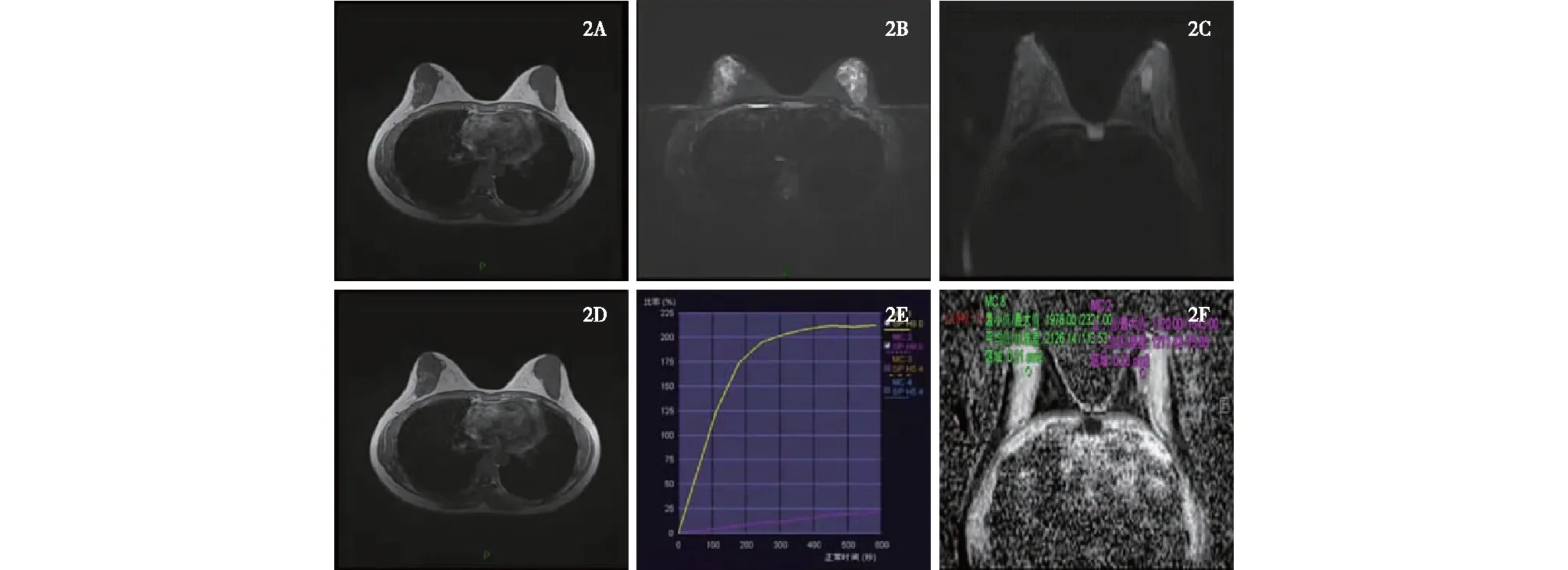
2A:T1WI图上呈高/稍高信号,肿瘤大小20 mm×12 mm×7 mm,边界欠清晰;2B: T2WI图上呈欠均匀稍高信号; 2C:DWI图上呈欠均匀稍高信号; 2D:增强图呈明显不均匀强化;2E:TIC曲线呈Ⅱ型(平台型);2F:ADC值1.3×10-3~1.5×10-3 mm2/s,腋窝未见明显肿大淋巴结影图2 左乳交界性叶状肿瘤的MRI表现
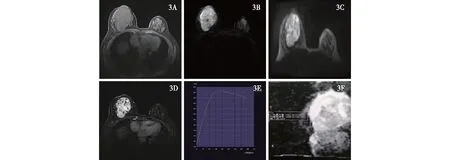
3A:T1WI图上呈稍高/高信号,大小58 mm×96 mm×81 mm,边界欠清晰,3B:T2WI呈不均匀高信号;3C:DWI呈不均匀高信号;3D:增强图呈明显不均匀强化;3E:TIC曲线呈Ⅲ型(流出型);3F:ADC值约1.4×10-3~1.5×10-3 mm2/s,腋窝可见肿大淋巴结影图3 右乳恶性叶状肿瘤的MRI表现
在乳腺X线、超声及MRI检查中,MRI可通过定量的可视化参数获得病灶的具体信息,对乳腺良恶性肿瘤的鉴别及预后预测具有重要意义[11]。既往研究表明,乳腺MRI是一种快速有效识别肿块纹理特征的定量成像技术,具有识别软组织病变率高、无辐射、多参数、多方位及多角度成像的优势,能够显示病灶的形态、大小、位置及与周围组织的关系,可客观反映肿瘤内部结构微血管灌注、血管生成及信号强度变化[6]。另外,MRI对侵袭性肿瘤的临床决策具有重要价值,可预测乳腺癌前哨淋巴结转移,有助于对肿瘤术前精准的分级、治疗效果进行早期评估及远期预后预测[7,12-13]。
本研究中,70例BPT患者,良性病变38例,交界性病变19例,恶性病变13例,交界性和恶性病变核分裂多、呈膨胀性或浸润性生长、间质细胞异质性增生;MRI形态学特征肿块多为分叶状,但组间并无明显差异;在肿块大小方面,交界性和恶性病变较良性病变肿块偏大,因此,肿块大小在一定程度上可作为判别良恶性BPT的依据。在MRI的影像学特征上,良性病变的T1WI序列多呈低信号,T2WI多呈均匀高信号,动态增强核磁序列均匀强化,恶性病变T1WI序列多呈高信号,T2WI多呈不均匀高信号,动态增强核磁序列不均匀强化,表明恶性病变的肿块病理学上异质性增加,周围组织浸润明显[4],而交界性或恶性BPT肿块T1WI序列为高信号、T2WI序列为不均匀高信号、动态增强后为不均匀强化灶,以上均提示肿瘤具有明显的异质性且容易发生出血、坏死囊变。另外,与恶性病变间质细胞异质性增高有关,内部结构复杂,更易导致异源性化生[6]。交界性和恶性病变BPT患者动态增强MRI的TIC曲线以Ⅱ、Ⅲ型为主,推测其原因为间质细胞丰富和血供丰富所致。ADC是描述水分子弥散运动的表观系数,能够判断水分子在组织内布朗运动情况,可反映肿瘤浸润情况[2,14-15]。因此,研究提示 MRI图像上ADC值的下降较多见于交界性和恶性BPT患者,考虑肿瘤间质细胞的过度增生,进一步促使水分子的弥散受限[4,14]。而在本研究中不同BPT患者相应的DWI图像上,多呈高信号,但组间ADC值差异无统计学意义,可能与样本量少尚未发现统计学意义有关,今后需扩大样本量进一步分析研究。
综上,在MRI图像上,BPT的病灶大小及T1WI、T2WI的信号特征、强化的均匀性、TIC曲线类型对于良恶性BPT患者具有诊断价值,即交界性及恶性病变的病灶偏大,异质性明显,周围组织浸润,T1WI低信号、T2WI呈不均匀高信号,增强核磁强化不均匀,以Ⅱ、Ⅲ型TIC曲线为主。因此,术前MRI有助于不同病理分级BPT的鉴别,对于临床手术方式选择具有重要的意义。

