陆地植物起源研究的新进展*
吴珍,程时锋
中国农业科学院农业基因组研究所,岭南现代农业科学与技术广东省实验室深圳分中心,农业农村部农业基因数据分析重点实验室,广东 深圳 518120
地球上有约5 0万种不同形态和功能的陆地植物。陆地植物一般特指有胚植物(embryophytes),包括苔藓植物(bryophytes)、蕨类植物(pteridophytes)、种子植物(spermatophytes)和被子植物(angiosperms)等[1],是支撑起陆地生态系统的关键部分。据目前已有的证据推测,如此多样化的陆地植物主要形成于一个被称为陆地化(terrestrialization)的重要进化事件[2-3],即陆地植物的藻类祖先从水生到陆生的逐步演化,最终在不同的陆地生境中生存繁殖并长期适应下来。植物祖先陆地化事件发生在5~6亿年前,是一个漫长而复杂的演化过程。在潮起潮落、沧海桑田的跌宕变迁中,一些地理生境出现周期性干涸现象,形成小水坑、河床、近海泥沼等,陆地植物的藻类祖先和它们的后代也逐渐具备了适应土壤干旱、强紫外线等恶劣环境的能力,最终形成我们今天看到的丰富多样的陆地植物群落[4]。植物祖先的陆地化事件改变了整个陆地生态系统,为包括人类在内的高等陆地生物的出现赋予了可能性,并提供氧气和食物等动物生存和发展所必需的基础[5-6]。
水生和陆生是两种截然不同的生态环境。从水生到陆生的转变,植物需要经历一系列剧烈的环境适应性挑战,如光吸收方式(包括承受更强的紫外线辐射)和CO2固定效率、更快速的温度变化以及土地基质(诸如pH值、盐度和营养成分)的变化。为了适应这些生物或非生物的挑战,陆地植物演化出各种胁迫响应机制,如对无处不在的分子(如活性氧(reactive oxygen))和一些植物激素(如脱落酸(abscisic acid))的信号转导,以及对植物细胞生理的适当调整[7]。
陆地植物的藻类祖先由水生向陆生的进化转变,包括其早期预适应及陆地化后的早期分化。研究这一漫长的进化历程,是植物进化生态生物学的重要内容[3]。如何利用现存的各类证据研究数亿年前的进化事件,是研究人员面临的一个巨大挑战。作为植物生命源代码的基因组蕴含着丰富的植物进化历史事件。随着测序技术的发展和测序成本的降低,从基因组方面研究植物的系统演化、关键节点进化事件和生物多样性发生的分子机制成为基因组学时代重要的方向之一。
1 陆地植物的近缘绿藻
确定陆地植物的藻类近亲是了解植物新性状起源和对复杂陆地环境适应的关键,而准确的系统发育进化树是比较基因组学的研究框架。包括中斑藻纲(Mesostigmatophyceae)、链丝藻纲(Klebsormidiophyceae)、双星藻纲(Zygnematophyceae)、鞘毛藻纲(Coleochaetophyceae)以及轮藻纲(Charophyceae)在内的轮藻门(Charophytes)和有胚植物同属链型植物(streptophytes),并具有紧密的进化关系[8]。但是,由于轮藻具有不同的形态(单细胞和多细胞)、不同的生殖类型(有性生殖、无性生殖和接合生殖)及多样的生境(水生、陆生)等特征,植物学家们对陆地植物藻类祖先的问题一直争论不休[9]。对于哪种绿藻才是陆地植物的近亲或姐妹群系存在三种不同的假设:轮藻纲、鞘毛藻纲和双星藻纲。
轮藻纲和鞘毛藻纲主要分布于海洋或淡水环境中,具有多细胞、分枝状的形态,类似陆地植物生长、繁殖和细胞分裂的特征,长期以来被认为是陆地植物祖先的姐妹系群[8]。2001年,Karol等[9]通过对40种不同轮藻及陆地植物的4种基因(叶绿体基因组的atpB和rbcL基因、线粒体基因组的nad5基因和核基因组的小核糖体基因)进行系统发育分析,认为轮藻纲是现存的与最早陆地植物亲缘关系最近的藻类,紧接着发现鞘毛藻纲也是陆地植物的近亲种类。2018年,Nishiyama等[10]对轮藻纲物种Chara braunii进行全基因组测序,发现C. braunii包含许多迄今为止仅属于陆地植物的进化方面的特征。例如,C. braunii拥有乙烯信号传导所需的所有基因,而乙烯可以促进陆地植物从种子萌发到果实成熟过程的信号传递。此外,C. braunii能够利用独特的木聚糖合酶进行细胞壁的生物合成,其转录调控功能也比其他藻类更为精细。C. braunii所具备的复杂形态特征可能是由某些扩张的基因家族导致的,特别是对活性氧的耐受性产生影响的基因、和LysM受体类似的激酶和转录因子(transcription factors)。对C. braunii生殖结构的转录组分析揭示了转录因子对生殖过程的复杂控制、活性氧基因网络的活性以及其合子具有植物类储存、应激保护蛋白。
然而,随着更多基因组和转录组数据的获取,更严密的系统发育分析显示,形态结构简单的双星藻纲更有可能是陆地植物最近缘的姐妹谱系(图1)[11-12]。2019年,Cheng等[4]首次对双星藻纲中两个单细胞淡水绿藻物种Spirogloea muscicola和Mesotaenium endlicherianum进行全基因组分析,发现与其他藻类相比,S. muscicola和M. endlicherianum具有更多与抗逆、抗干旱、抗强紫外线等相关的转录因子,以及更多陆地植物所特有的核心家族基因,例如与植物激素有关的基因、与细菌和真菌共生的基因等。S. muscicola是首次发现并命名的新物种,通过叶绿体核心保守基因、核基因组基因等不同数据矩阵,采用不同软件(如RAxML、FastTree和Phylobayes)、不同算法(Maximum likelihood和Bayesian inference)、不同的序列分子演化模型(FastTree: JTT+CAT、RAxML:GTR+CAT models、Phylobayes: LG, CAT+GTR和CAT+GTR+Dayhoff recoding)分析,均证明S.muscicola是双星藻纲最基部的一个单细胞绿藻物种,且是现存陆地植物共同祖先最近缘的姐妹群系。S. muscicola和M. endlicherianum基因组均只有约170 Mb(表1),通过深度比较进化基因组学和系统发育分子进化研究发现,这两个陆地植物共同祖先近缘物种从土壤细菌中通过水平基因转移(horizontal gene transfer)获得几类关键的基因,包括GRAS和PYR/PYL/RCAR(这两类基因被认为与许多重要的代谢途径有关)。GRAS和PYL在其他藻类中并未发现,之前认为只是陆地植物所特有,该研究将其起源追溯到陆地植物祖先的根。GRAS基因家族中的NSP1、NSP2、RAM1和其他亚家族是调节生理过程(如调控丛枝菌根、结瘤共生固氮)的重要转录因子;PYR/PYL/RCAR基因则是植物激素脱落酸遗传通路的重要受体,在植物抗旱中起关键作用。此外,Cheng等[4]还在S. muscicola中检测到一个近期全基因组三倍化事件(图1)。全基因组复制(whole genome duplication)是生命体从简单到复杂进化的重要驱动力之一,对植物在进化过程中适应剧烈的环境变化极为重要。但是,这种现象在藻类中极为罕见,仅在双星藻纲的部分物种中检测到较丰富的多倍化信号[12-14]。S. muscicola和M. endlicherianum在双星藻纲具有独特的遗传地位,被推测为可能是5.8亿年前将轮藻和陆地植物分化开来的重要物种[3-4,15]。因此,S. muscicola可能是目前所有陆地植物的共同祖先。
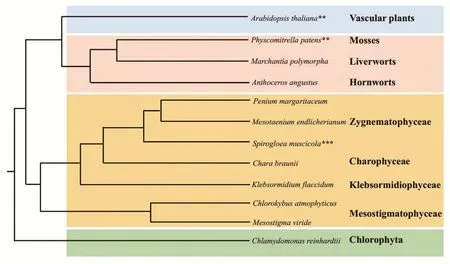
图1 绿藻(Chlamydomonas reinhardtii)、轮藻(Spirogloea muscicola, Mesotaenium endlicherianum, Penium margaritaceum,Klebsormidium flaccidum, Mesostigma viride, Chlorokybus atmophyticus, Chara braunii)、苔藓植物(Anthoceros angustus,Marchantia polymorpha, Physcomitrella patens)和维管植物(Arabidopsis thaliana)的进化简易示意图。**表示该物种经历全基因组复制;***表示该物种经历全基因组三倍复制
单细胞藻Penium margaritaceum、S.muscicola和M. endlicherianum同属双星藻纲,在一些实验室曾被当作研究植物细胞壁和激素等课题的模式物种。P. margaritaceum能够短暂地适应经常干燥的湿地,具有类似于陆地植物的复杂细胞壁,并且可以分泌多糖黏液[16]。虽然P. margaritaceum没有经历全基因组复制,但仍具有约4.7 Gb的基因组,且包含52 333个蛋白质编码基因(表1)。系统发育分析发现Penium是双星藻分支中的衍生种类,和位于基部的S. muscicola相距较远。P. margaritaceum基因组包含约80.6%的重复序列,特别是那些能使基因新功能化的长末端重复序列(long terminal repeats)、逆转座子(retrotransposons)和简单重复序列(simple repeats)[16]。基因组的比较分析表明,P. margaritaceum基因组中包含GRAS家族的大量基因,这与S. muscicola和M. endlicherianum类似[4]。藻类通常不具备真正的角质层,但是P.margaritaceum却具有角质层的生物合成、运输和组装的能力,因此能够阻止水分的流失[16]。此外,P. margaritaceum扩大了信号网络和适应性反应的相关基因,这些基因能够参与到广泛的生理过程当中。例如,4-香豆酸酯-CoA连接酶(4-coumarate: coenzyme A ligase)和查尔酮合酶(chalcone synthase)可以参与类黄酮( flavonoids)的生物合成途径中,而类黄酮可以保护植物免受紫外线辐射[25]。在P. margaritaceum基因组扩张的碳水化合物活性酶(carbohydrate-active enzymes)参与了细胞壁中黏多糖的产生,黏多糖充当了干旱的保护片,而干旱是陆地植物必须要应对的主要非生物因素胁迫之一,这可能与早期陆地生物能短暂地适应经常干燥的湿地有关[16]。这些特征也可以解释早期陆地植物是如何适应干旱和紫外线辐射的陆地环境的。
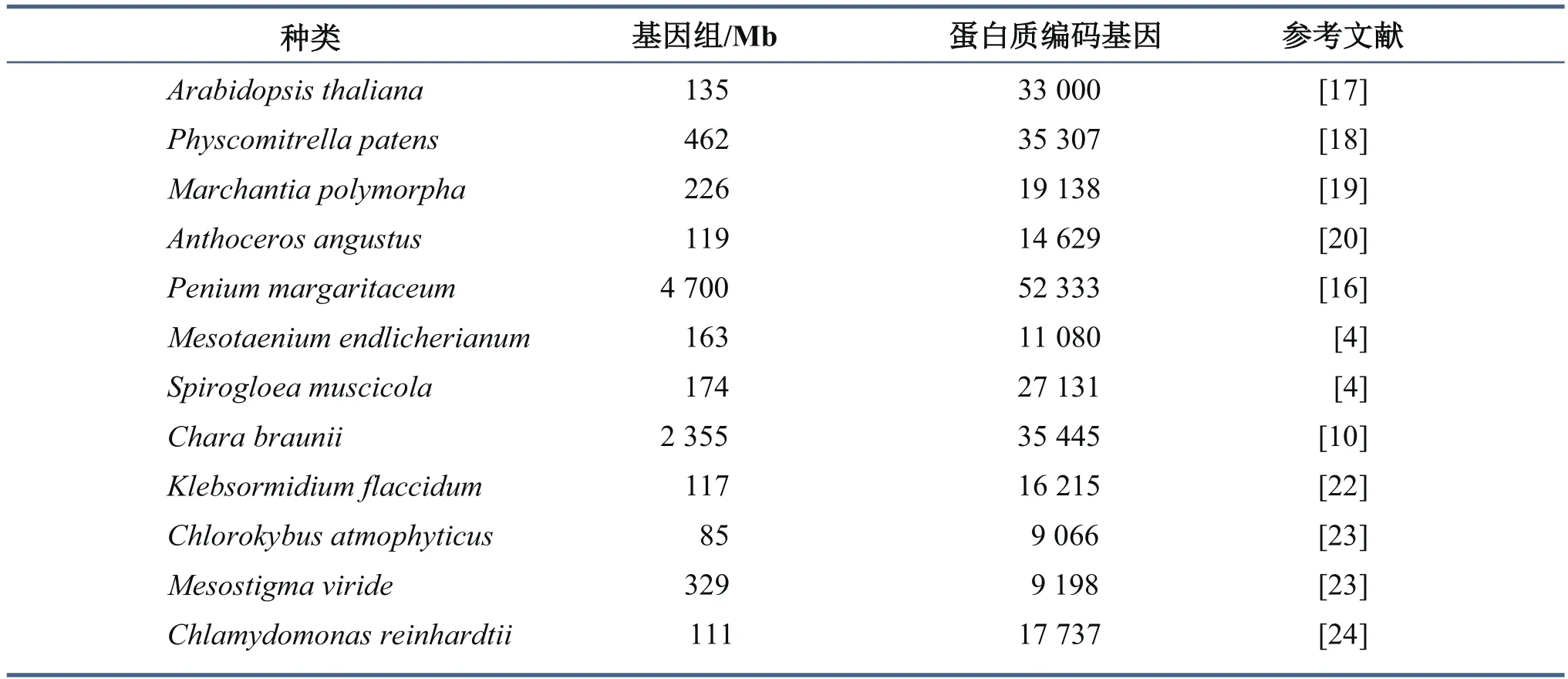
表1 绿藻(Chlamydomonas reinhardtii)、轮藻(Spirogloea muscicola, Mesotaenium endlicherianum, Penium margaritaceum,Klebsormidium flaccidum, Mesostigma viride, Chlorokybus atmophyticus, Chara braunii)、苔藓植物(Anthoceros angustus,Marchantia polymorpha, Physcomitrella patens)和维管植物(Arabidopsis thaliana)的基因组大小和蛋白质编码基因数量
2 陆地化是渐进性演化,经历了一系列预适应的过程
此前,科学界普遍认为从水生到陆生过渡的事件发生在陆地植物的共同祖先中,但是最近这个观点受到了挑战。对更多轮藻基因组和转录组数据的分析显示:陆地化是渐进性演化(gradual evolution or step-wise evolution),经历了很多预适应过程,即适应陆地生活的基因在陆地植物起源之前就已在轮藻中开始进化[26-27]。Klebsormidium属链丝藻纲(图1),是早期演化的多细胞轮藻,呈未分支的丝状。大多数适应陆地的物种也可以在淡水中生存,某些还能对包括干旱、冰冻等在内的典型陆地环境耐受[22,28-29]。Klebsormidium flaccidum的基因组中具有生长素(auxin)、脱落酸和茉莉酸(jasmonic acid)等植物激素合成所需要的大多数潜在基因[22]。利用质谱仪也同样能够在K.flaccidum中检测到包括生长素吲哚-3-乙酸(auxin indole-3-acetic acid)、脱落酸、细胞分裂素异戊烯腺嘌呤(cytokinin isopentenyladenine)、茉莉酸和水杨酸(salicylic acid)等在内的典型植物激素[22]。K.flaccidum质体基因组的一个显著的特征是其具有18个NADH氧化还原酶亚基构成的NADH脱氢酶样复合物,介导了光系统I中的循环电子流(cyclic electron flow)[30-31],包括高强度光照和干旱在内的多种压力都可以激活循环电子流。此外,K.flaccidum核基因组中具有7个编码NDH和PGR5的基因,而NDH和PGR5是陆地植物的两个循环电子流途径。因此,K. flaccidum可能具有循环电子流活性。植物激素相关基因和循环电子流活性对陆地化事件至关重要,K. flaccidum的这些特征表明其已具有适应陆地环境所必需的基本条件[22]。此外,Hori等[22]虽然没有在K. flaccidum基因组中发现多细胞生物所特有基因的数量有任何增加,却发现与多细胞化相关的基因(如WUSCHEL、AGAMOUS基因,它们类似于陆地植物中的MADS-box、GNOM和细胞壁相关基因)。这些结果表明,K. flaccidum的祖先虽仅具有简单的身体结构,却已开始组织复杂的多细胞系统。
2020年,Wang等[23]对两种不同的轮藻进行分析,其中Mesostigma viride为具有鞭毛的水生单细胞藻,Chlorokybus atmophyticus为滩涂生(subaerial/terrestrial)的多细胞藻,两者都是轮藻的早期演化成员(图1)。不同的生境及细胞形态使M. viride和C. atmophyticus成为研究陆地植物进化和多细胞化的理想模型。通过对两者基因组的分析,Wang等发现,虽然两者在基因组大小、结构及基因家族组成方面都存在显著差异(表1),但是M. viride和C. atmophyticus都已进化出转录因子和植物激素途径。这些转录因子包括与压力适应和生长有关的HD-Zip、GRF生长调控因子、LUG转录共阻遏物和SRS等。M. viride和C.atmophyticus还具备植物型细胞壁合成的相关基因。其中,C. atmophyticus具有编码植物型纤维素酶的基因,M. viride具有编码甘露聚糖酶、甘露糖苷酶和木糖苷酶的基因。不过,M. viride和C. atmophyticus都缺乏编码木葡聚糖、木聚糖降解酶和大多数果胶裂解酶的基因。除此之外,在M. viride和C. atmophyticus中鉴定出的典型陆地植物光敏色素基因(photoreceptor phytochrome),与植物生长和发育的调节密切相关[23]。
3 早期演化的陆地植物
苔藓植物,包括苔类植物(liverworts)、藓类植物(mosses)和角苔植物(hornworts),起源于5亿年前,是早期进化的陆地植物,属非维管植物,是研究陆地植物进化的主要类群之一[18]。苔藓植物的植株结构比较简单,单倍体的配子体占主导地位,孢子体依附在配子体上,无真正的根,也无木质化的维管组织,喜欢荫湿环境,被认为是植物由水生到陆生的过渡类型[21]。最近,Zhang等[20]首次完成对角苔植物Anthoceros angustus基因组的注释,通过分析发现,与苔类植物Marchantia polymorpha的基因组一样,A. angustus并未经历全基因组复制,而同属苔藓植物的藓类植物Physcomitrella patens却经历了至少一次全基因组复制(图1)。此外,A. angustus的基因组较小,仅有119 Mb和14 629个蛋白质编码基因(表1),低于上文提到的S. muscicola,有关发育的多数基因也仅具有单个拷贝且冗余度很低,这些特征可能是早期进化陆地植物的特征[20]。基因组的深度分析显示A. angustus的一些基因家族得到扩张,例如A. angustus具有大量用于植物细胞器RNA加工的五肽重复(pentatricopeptide repeat)基因,约占其蛋白质编码基因的7.90%[20]。此外,细胞色素P450(cytochrome P450)基因与bicupins基因也在其基因组中扩张[20]。其中,五肽重复蛋白可以充当修复因子,减轻因陆地环境中紫外线暴露量增加而引起的DNA损伤,而细胞色素P450基因和bicupins基因参与脱落酸代谢,并具有重要的干旱响应功能[19]。值得注意的是,A. angustus具有两个与气孔发育相关的基因,即SMF和ICE。气孔可以帮助陆地植物在干燥环境中生存并增强水分吸收和保持,因此被认为是植物祖先进行陆地化过程中的关键进化创新[3,12]。Zhang等[20]还在A. angustus基因组中鉴定出仅存在于绿藻中的3种无机碳转运蛋白(HLA3、LCI1和LCIA类似基因)。这表明该苔藓植物具有像绿藻一样的CO2浓缩机制(CO2-concentrating mechanism)[32],不过不同于C4植物和景天酸代谢植物中存在的CO2浓缩机制[33]。系统发育分析显示角苔植物位于苔藓植物分支的最基部(图1)。同其他苔藓植物一样,A. angustus具有来自细菌、真菌和放线菌的基因,例如编码乙二醛酶、NAD结合脱氢酶、葡糖醛酸水解酶和DNA甲基转移酶等的基因,这些基因与应激反应和代谢途径有关。因此,外来基因在角苔植物对环境的适应过程中可能起着至关重要的作用。
4 结语
轮藻门可能经历了4个重要的步骤才完成从水生到陆生、从单细胞到复杂多细胞系统的转变,经历了很多关键的突破和进化创新。研究轮藻及早期演化陆地植物的基因组不仅有助于了解植物的系统演化与生物多样性,对全面了解植物的生命奥秘也具有重要意义。本文介绍的一些轮藻及早期陆地植物的基因组特征,可以总结为以下几点:
(1)在登陆之前,双星藻纲的基因组和遗传代谢已经有了相当规模的基因组创新,同时经历了基因家族扩增并获得大量新基因,为适应陆生生活做好了遗传物质的准备,双星藻纲可能是现存陆地植物的共同祖先;
(2)深度比较基因组学和分子进化学研究发现,通过水平基因转移来自于土壤细菌和真菌的基因,对于驱动陆地植物祖先陆地化的进程以及早期陆地植物的适应性过程起着重要的作用;
(3)植物祖先陆地化是一个渐进性演化过程,可能经历了一系列基因上的预适应过程。很多长期被认为是陆地植物才有的基因家族,研究发现在更原始的绿藻中就已存在,例如与抗逆相关的转录因子或传统认为陆地植物才有的核心基因家族;
(4)基因组学是研究陆地化及可逆性过程(如一些水生被子植物)的重要手段,为耐旱、耐盐等分子机制的研究奠定了重要基础。
当然,目前仍有很多问题等待我们去解答。例如:除了土壤细菌和真菌,轮藻和早期陆地植物是否具有来自病毒的基因?水平基因转移这一自然转基因过程在双星藻纲适应陆地过程中起着什么样的作用?什么原因使得一些陆生轮藻又回到了水环境?导致轮藻发生多细胞化的关键机制是什么?回答这些问题还需要对链型植物进行大量比较基因组学和系统基因组学的研究。

