蓬子菜化学成分的分离与鉴定
孙志伟, 张文君
(哈尔滨商业大学 药学院,哈尔滨 150076)
蓬子菜(GaliumverunL.)为茜草科(Rubiaceae)拉拉藤属(Galium)药用植物,入药部位为其干燥全草,蓬子菜具有行血祛瘀、消肿通经、清热抗炎以及利湿止痒之功效[1-3].本课题组前期药效学实验表明体积分数60%乙醇(EtOH)洗脱部位为治疗周围血管病的有效部位[4-5],经紫外分光光度法测定,含总黄酮量可达58%.为进一步展开蓬子菜总黄酮活性的物质基础研究,本实验采用硅胶柱色谱、HPLC等现代分离技术与方法对该部位进行分离,并通过理化分析、1H-NMR、13C-NMR数据解析,鉴定了该10个化合物的化学结构,见图1.
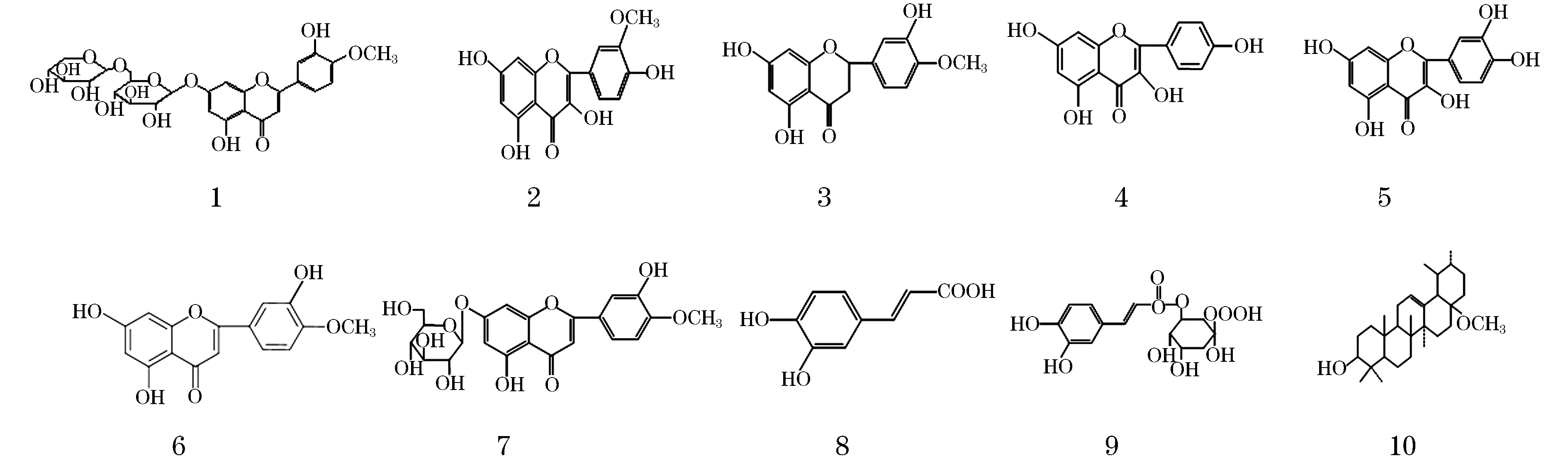
图1 蓬子菜的化合物结构
1 仪器与材料
超导核磁共振光谱用INOVA-500、INOVA-400和Bruker-400型超导核磁共振光谱仪(TMS为内标);制备HPLC采用Waters公司的Delta-600-2487型;分析型色谱柱,大连依利特公司Hypersil ODSⅡ(5μm 4.6×200 mm);制备型色谱柱,制备色谱柱为Zorbax-SB-C18(9.4 mm×250 mm);柱色谱硅胶,青岛海洋化工厂(140~200目,200~300目);薄层色谱硅胶板,德国Merck公司(Silica gel60F254);硅胶(青岛海洋化工厂,140~200,200~300目);柱色谱用反相ODS(ODS-AM)为YMC公司产品;色谱层析用化学试剂为分析纯(天津试剂一厂).
本实验所用蓬子菜采自安达市,由哈尔滨商业大学张德连副教授鉴定为茜草科拉拉藤属植物蓬子菜(GaliumverunL.).
2 提取分离
蓬子菜干燥全草10 kg粉碎后用体积分数70%EtOH回流提取2次,每次2 h,合并提取液,减压回收EtOH后,将其浓缩物以体积分数20%EtOH稀释,通过AB-8大孔树脂柱,依次用体积分数20%EtOH、60%EtOH、95%EtOH洗脱,洗脱液减压浓缩得到各有效部位.
体积分数60%EtOH有效部位干法上样,以二氯甲烷-甲醇为洗脱溶剂,二者比例依次为100∶1、100∶2、100∶5、100∶10、100∶20、100∶40、100∶100.每个梯度的洗脱液用薄层板检测,合并相似的洗脱液,共得到7个洗脱流份(Fr.1~Fr.7).流分Fr.4经Sephadex LH-20色谱柱,以二氯甲烷-甲醇(1∶1)洗脱得到流分Fr.4.2,再经中低压制备色谱柱MPLC,以甲醇-水(20%甲醇-100% 甲醇)梯度洗脱得Fr.4.2.1-Fr.4.2.4和化合物1和8;流分Fr.4.2.1经硅胶柱层析,二氯甲烷-甲醇(40∶1-10∶1)梯度洗脱得到化合物10、7和流分Fr.4.2.1.1.流分Fr.4.2.1.1经制备HPLC(15%甲醇/水,1.5 mL·min-1)得到化合物9和6;流分Fr.4.2.2经硅胶柱层析二氯甲烷-甲醇(50∶1-1∶1)梯度洗脱得到化合物3和流份Fr.4.2.2.1,Fr.4.2.2.1经制备HPLC(45%甲醇,1.5mL·min-1)得到化合物4;流分Fr.4.2.4经硅胶柱层析二氯甲烷-甲醇(100∶1-30∶1)梯度洗脱得到化合物5和2.
3 结构鉴定

化合物2:淡黄色粉末,mp 305~307 ℃,HCl-Mg粉反应呈阳性,Molish反应呈阴性,推测可能为黄酮.1H-NMR(DMSO-d6,400MHz)谱中,δ:12.48(1H,s,5-OH), 10.77(1H,brs,7-OH),9.75(1H,br s,4′-OH)和9.45(1H,br s,3-OH)处可观察到4个酚羟基质子信号;7.77(1H,d,J=2.0,H-2′),7.70(1H,d,J=8.5,2.0 Hz,H-6′)和6.95(1H,d,J=8.5Hz,H-5′)处可观察到黄酮B环ABX偶合的3个氢质子信号;6.49(1H,d,J=2.0,H-8)和6.21(1H,J=2.0,H-6)处为黄酮A环间位偶合的质子信号;3.87(3H,s,3′-OCH3)为甲氧基信号;13C-NMR(DMSO-d6,100 MHz)谱中,δ:175.83(C-4),147.31(C-2),135.78(C-3),归属为C环上3个碳信号;163.87(C-7),160.65(C-5),156.11(C-9),102.99(C-10),98.17(C-6)和93.55(C-8)为A环上的碳信号;148.76(C-4′),146.57(C-3′),121.68(C-1′),121.94(C-6′),111.67(C-5′),115.50(C-2′)为B环上的碳信号;55.71(3′-OCH3)为甲氧基碳信号.以上数据与文献[8]报道一致,故鉴定化合物为异鼠李素(isorhamnetin).
化合物3:无色针状结晶(MeOH),mp230~232 ℃,HCl-Mg粉反应呈阳性,四氢硼钠反应呈阳性,Molish反应呈阴性,推测为二氢黄酮类化合物.1H-NMR(DMSO-d6,400 MHz)谱中,δ:12.14(1H,s,5-OH),10.84(1H,s,7-OH)和9.12(1H,s,3′-OH)处可观察到酚羟基质子信号;6.92(1H,s,J=2.0Hz,H-2′),6.93(1H,d,J=8.3Hz,H-5′)和 6.87(1H,dd,J=2.0,8.3Hz,H-6′)为黄酮B环ABX偶合系统氢质子信号;5.90(1H,d,J=2.1Hz,H-6)和5.89(1H,d,J=2.1Hz,H-8)处为黄酮A环间位偶合质子信号;5.42(1H,dd,J=12.4,3.0Hz,H-2)为二氢黄酮2位氢质子信号,3.76(3H,s,4′-OCH3)为甲氧基质子信号,3.20(1H,dd,J=17.1,12.4Hz,H-3a)和2.69(1H,dd,J=17.1,3.2Hz,H-3b)处为二氢黄酮3位氢质子信号;13C-NMR(DMSO-d6,100 MHz)谱中,δ:196.15(C-4),78.18(C-2),42.00(C-3)和处可观察到二氢黄酮C环的3个碳信号;166.61(C-7),163.43(C-5),162.76(C-9),101.76(C-10),95.78(C-6)和94.96(C-8),为二氢黄酮A环碳信号;131.10(C-1′),114.01(C-2′),146.41(C-3′),147.85(C-4′),111.93(C-5′)和117.64(C-6′)为二氢黄酮B环的碳信号;55.62(-OCH3)处为甲氧基碳信号.综上数据与文献[9]相关数据一致,故鉴定化合物为橙皮素(hesperetin).
化合物4:淡黄色针晶(MeOH),mp 276~278 ℃,HCl-Mg粉反应呈阳性,Molish反应呈阴性,推测为黄酮类化合物.1H-NMR(DMSO-d6,400MHz)谱中,δ:12.50(1H,s,5-OH),10.78(1H,brs,7-OH), 10.13(1H,brs,4′-OH)和9.40(1H,brs,3-OH)为酚羟基质子信号;8.06(2H,d,J=8.8,2.0Hz,H-2′,6′)和6.89(2H,d,J=8.8,2.0Hz,H-3′,5′)处为黄酮B环AA′BB′偶合系统的质子信号;6.11(1H,d,J=2.0Hz,H-6)和6.43(1H,d,J=2.0 Hz,H-8)处为黄酮A环6,8位间位取代质子信号.13C-NMR(DMSO-d6,100 MHz)谱中,δ:175.86(C-4),146.76(C-2),135.63(C-3)归属为C环上3个碳信号;163.85(C-7),160.68(C-9),156.14(C-5),103.01(C-10),98.17(C-6),93.44(C-8)为A环上的碳信号;159.15(C-4′),129.47(C-2′,6′), 121.64(C-1′),115.40(C-3′,5′)为B环上的碳信号.与文献[10]相关数据进行比较,二者基本一致,鉴定该化合物为山奈酚(Kaempferol).
化合物5:黄色粉末,mp 314~317 ℃,HCl-Mg粉反应呈阳性,Molish反应呈阴性,推测可能为黄酮.1H-NMR(DMSO-d6,400 MHz)谱中,δ:12.51(1H,brs),10.78(1H,brs),9.58(1H,brs)和9.37(2H,brs)为5个酚羟基质子信号;δ:7.69(1H,d,J=2.2 Hz,H-2′),7.55(1H,d,J=8.0,2.2 Hz,H-6′)和6.89(1H,d,J=8.0 Hz,H-5′)为黄酮B环ABX偶合系统的氢质子信号;6.42(1H,d,J=2.2 Hz,H-8)和6.20(1H,d,J=2.2 Hz,H-6)处可观察到黄酮A环间位偶合的质子信号;13C-NMR(DMSO-d6,100 MHz)谱中,δ:175.80(C-4),146.74(C-2)和135.69(C-3)归属为C环上的碳信号;163.84(C-7),160.68(C-5),156.09(C-9),103.00(C-10),93.30(C-8),98.14(C-6)为A环上的碳信号;147.74(C-4′),145.01(C-3′),121.91(C-1′),119.93(C-6′),115.56(C-5′),115.02(C-2′)为B环上的碳信号.综合以上数据与文献[11]相关数据进行比较,二者基本一致,故确定化合物为槲皮素(quercetin).
化合物6:淡黄色粉末,mp 256~258 ℃,HCl-Mg粉反应呈阳性,Molish反应呈阴性,推测为黄酮类化合物.1H-NMR(DMSO-d6,400MHz)谱中,δ:12.95(1H,s,5-OH),10.81(1H,brs,7-OH)和9.53(1H,brs,3′-OH)为酚羟基质子信号;7.55(1H,d,J=8.5,2.3 Hz,H-6′),7.43(1H,d,J=2.3Hz,H-2′)和7.09(1H,d,J=8.5 Hz,H-5′)处可观察到黄酮B环上ABX偶合系统的质子信号;6.76(1H,s,H-3)为黄酮C环烯氢质子信号;6.46(1H, d,J=2.0Hz,H-8)和6.19(1H,J=2.0Hz,H-6)处可见黄酮A环6,8位间位取代质子信号;3.88(3H,s)为甲氧基质子信号.13C-NMR(DMSO-d6,400 MHz)谱中,δ:181.65(C-4),163.46(C-2)和103.70(C-3)归属为C环上的碳信号;164.20(C-7),161.43(C-9),157.27(C-5),103.47(C-10),98.84(C-6),93.86(C-8)为A换上的碳信号;151.07(C-4′),146.73(C-3′),122.96(C-6′),118.66(C-1′),112.89(C-2′),112.06(C-5′)为B环上的碳信号;55.70(4′-OCH3)为1个甲氧基碳信号.与文献[12]相关数据进行比较,二者基本一致,鉴定该化合物为香叶木素(Diosmetin).
化合物7:黄色无定形粉末,mp 252~254 ℃,HCl-Mg粉反应呈阳性,Molish反应呈阳性,推测可能为黄酮苷.1H-NMR(DMSO-d6,400 MHz)谱中,δ:12.95(1H,s,5-OH),9.47(1H,s,3'-OH)为两个酚羟基质子信号;7.46(1H,brs,Hz,H-2′),7.11(1H,d,J=8.5 Hz,H-5′)和7.58(1H,dd,J=8.5 Hz,H-6′)为黄酮B环上ABX偶合系统的氢质子信号;6.84(1H,s,H-3)处可见黄酮C环上3位烯质子信号;6.46(1H,d,J=2.0Hz,H-6)和6.82(1H,d,J=2.0Hz,H-8)处可观察到一组黄酮A环间位偶合的氢质子信号;5.10(1H,d,J=7.3 Hz,H-1′′)处为糖的端基氢质子信号,3.87(3H,s,4′-OCH3)处可观察到1个4′位的甲氧基质子信号;13C-NMR(DMSO-d6,100 MHz)谱中,δ:181.92(C-4), 162.98(C-2),105.36(C-3)为C环的3个碳信号;164.06(C-7),161.10(C-5),156.94(C-9),103.79(C-10),99.54(C-6)和 94.76(C-8)为A环碳信号;122.85(C-1′),113.09(C-2′),146.76(C-3′),151.27(C-4′),112.08(C-5′)和118.86(C-6′)为B环的碳信号;55.77(C-OCH3)处为甲氧基碳信号;对比化合物12发现,香叶木素母核的数据基本一致,区别主要在于糖的部分99.84(Glc-1),73.08(Glc-2),76.36(Glc-3),69.50(Glc-4),77.13(Glc-5)和60.57(Glc-6)共6个归属于葡糖糖的碳信号.与文献[13]中相关数据进行比较,二者基本一致,故鉴定该化合物为香叶木素-7-O-β-D-葡萄糖苷(Diosmetin-7-O-β-D-glucoside).
化合物8:白色针晶(MeOH),mp 211~213℃.1H-NMR(DMSO-d6,400MHz)谱中,δ:11.99(1H,s),9.37(1H,s)为苯环上3位和4位的羟基质子信号,7.41(1H,d,J=16.0 Hz,H-7),6.17(1H,d,J=16.0Hz,H-8)为一组烯氢质子信号;7.04(1H,d,J=2.0Hz,H-2),7.00(1H,dd,J=2.0,8.4 Hz,H-6),6.76(1H,d,J=8.4 Hz,H-5)为苯环上一组ABX偶合的质子信号;13C-NMR(DMSO-d6,400MHz)谱中,δ:167.89显示一个羰基碳信号;此外还含有一组不饱和碳信号148.08(C-7),144.55(C-3),145.50(C-4),125.65(C-1),115.07(C-5),121.14(C-8),115.70(C-2),114.56(C-6).以上数据与文献一致[14],故鉴定该化合物为咖啡酸(caffei acid).
化合物9:白色粉末,mp 204~206 ℃.1H-NMR(DMSO-d6,400MHz)谱中,δ:7.42(1H,d,J=16.0,H-7′)和6.14(1H,d,J=16.0,H-8′)处可观察到呈反式双键的烯氢质子信号;7.04(1H,d,J=2.0,H-2′),6.98(1H,dd,J=2.0,8.0,H-6′)和6.76(1H,d,J=8.0,H-5′)处可观察到苯环ABX偶合的3个氢质子信号;5.08(1H,q,J=6.8,H-3),3.93(1H,brs,H-5),3.57(1H,brs,H-4)和1.76-2.04(4H,m,H-2,6)处为奎宁酸质子信号;13C-NMR(DMSO-d6,100MHz)谱中,δ:165.69(C-9′),114.23(C-8′)和144.70(C-7′)处可观察到α,β不饱和酮的3个碳信号;148.29(C-4′),145.51(C-3′),125.54(C-1′),121.33(C-6′),115.69(C-5′)和114.70(C-2′)处为ABX取代的苯环碳信号;174.90(C-7),73.41(C-1),70.83(C-3),70.30(C-4),68.00(C-5),37.15(C-6)和36.16(C-2)处为苷化奎宁酸的碳信号.以上数据与文献[15]报道绿原酸的数据进行比较,二者基本一致,故鉴定该化合物为绿原酸(chlorogenic acid).
化合物10:无色针状结晶(氯仿),mp 287~288 ℃.1H-NMR(DMSO-d6,400MHz)谱中,δ:11.9(1H,s,28-OH)处可观察到28位羧基的羟基质子信号;5.12(1H,s,H-12)处为12位的烯质子信号;4.29(1H,d,J=5.1Hz,H-3)和2.11(1H,d,J=11.1 Hz,H-18)处分别是3和18位的氢质子信号;在1.04(3H,s),0.75(3H,s),0.87(3H,s),0.68(3H,s),1.23(3H,s)分别为23~27位的5个角甲基质子信号;0.91(3H,d,J=7.6Hz,29-CH3)和0.82(3H,d,J=6.0 Hz,30-CH3)处是29,30位的角甲基.13C-NMR(DMSO-d6,100 MHz)谱中,δ:178.23(C-28)为羧羰基碳信号;138.15(C-13)和124.54(C-12)处的一对烯碳信号;28.22(C-23),15.19(C-24),16.89(C-25),17.00(C-26),23.24(C-27),16.05(C-29),和21.04(C-30)的7个角甲基信号;76.79(C-3)为环上连氧碳信号;54.75(C-5),52.34(C-18),46.79(C-17),47.98(C-9),41.60(C-14),38.47(C-8),38.41(C-19),38.47(C-20),38.20(C-4),32.67(C-1),36.34(C-10),36.49(C-22),30.16(C-7),29.02(C-21),27.51(C-15),27.00(C-2),23.78(C-16),23.24(C-11),18.00(C-6)为一系列脂肪环上碳信号.综合以上数据与文献[16]报道熊果酸(ursolic acid)的数据一致.
4 结 语
本文对60%乙醇(EtOH)洗脱部位进行分离,通过使用不同色谱技术对其化学成分进行分离,根据理化性质及1H-NMR、13C-NMR等波谱学技术对所得化合物进行结构鉴定.经过硅胶层析得到7个流分,其中Fr.4流份的量最高(约占所有流份的2/3),通过HPLC检测发现60%乙醇(EtOH)洗脱部位主要成分也多集中在Fr.4流份中,为了提高分离效率,本实验针对Fr.4流份进行系统分离.通过第一遍硅胶柱层析的馏分虽然分离效果较好,但吸附较为严重,样品损失较多,接下来分别通过Sephadex LH-20 和MPLC进行分离,馏分损失较少,分离效果较为理想,最终分离得到10个化合物:diosmetin-7-O-β-D-xylopyranosyl-(1→6)-β-D-glucopyranoside(1)、isorhamnetin(2)、hesperetin(3)、Kaempferol(4)、quercetin(5)、Diosmetin(6)、Diosmetin-7-O-β-D-glucoside(7)、caffei acid(8)、chlorogenic acid(9)、ursolic acid(10),其中化合物1为首次从拉拉藤属植物中分离得到,丰富了蓬子菜化学结构信息,对阐明蓬子菜治疗周围血管病药效物质基础具有重要意义.

