激素信号转导代谢通路在板栗花粉直感效应中的分析*
王猛,朱秋蓉,李升星,石卓功
(1.西南林业大学 林学院,云南 昆明 650224;2.江西省林业科学院,国家林业局樟树工程技术研究中心,江西 南昌 330032)
板栗(CastaneamollissimaBL.)是壳斗科(Fagaceae)栗属(Castanea)植物,果实富含碳水化合物、多酚、维生素、铁、膳食纤维等。板栗从海拔50~2 800 m均有种植,在我国栽培面积很广,多数地区采用实生繁殖,也筛选出许多高产的新品种。板栗花期为5—6月,果熟期为9—10月。板栗的雌雄花比例失调,雄花数量远远大于雌花的数量,雄花序先于雌花形成。据研究在结果枝上平均1个雌花拥有4.27~8.62条雄花序,每1结果母枝仅有2.44朵雌花[1]。
很多果树存在直感现象,即杂交种子的胚乳在外在和内在性状上会表现出父本的遗传性状。直感现象对果实或者种子的外在品质,内在品质及其他性状均有影响。据研究,不同品种的果树在授粉后,花粉能直接影响其受精形成的种子或果实发生变异[2]。板栗存在直感现象,在接受不同品种的花粉进行授粉后,所形成的种子或者果实会发生变异。在花粉直感对果实外在品质影响的研究中,沙海峰等[3]在对京白梨(Pyrusussuriensis‘Jingbaili’)的研究发现花粉直感对果实重量有显著影响;李保国等[4]在富士苹果(Maluspumila)研究中得出花粉直感对果实着色会有影响。在对果实内在品质的研究中,陈庆红等[5]在金魁猕猴桃(Actinidiachinensisvar.deliciosa‘Jinkui’)果实品质受到花粉直感现象影响中发现,不同猕猴桃品种授粉后果实中可溶性固形物、VC含量均出现明显的差异;邱燕萍等[6]发现不同授粉品种的桂味荔枝(Litchichinensis‘Guiwei’)在总糖、总酸、叶绿素等含量表现出明显差异。在其他性状方面,有研究表明花粉直感效应对樱桃(Cerasuspseudocerasus)、火龙果(Hylocereusundatus)、蓝莓(Sementrigonellae)、扁桃(Amygdaluscommunis)等植物果实的成熟期具有明显的影响[7-12]。
目前关于花粉直感机理的研究主要有两个假设,第一个假设认为内源激素合成与花粉直感现象关系密切,种子产生的激素(主要是植物生长素)将负责果实的生长,种子的数量(可能是其质量)与果实大小成正相关[13];第二个假设主要指出触发直感效应的信号可能是mRNA[14]。而且,植物内源激素在植物的生长发育中起到重要的作用,在果实性状中,可以使细胞分裂和增大,在果实中出现明显果实直感,如成熟度、果实的大小和质量等[15-16]。
板栗的直感现象也非常明显,实生后代变异类型较多,性状遗传有严重的分离现象,在一定程度上影响了子代板栗坚果的品质。因此,本研究通过转录组测序后,对数据分析,研究植物激素信号代谢在板栗花粉直感中的作用,为将来通过人工栽培技术,有目的的改善果实品质提供理论依据。
1 材料与方法
样品采集地位于云南省楚雄州永仁县,嫁接繁殖的9 a生左右的板栗树品种为永丰1号、永仁早和易门1号。供试材料为板栗不同成熟阶段种仁,在成熟前约20 d,每隔11 d采样一次,采样的3个时间为:2018/07/26(70 DAP)、2018/08/07(82 DAP)及2018/08/19(94 DAP),最后1次采样为球苞开裂的成熟果,共3个时期。
所采板栗种仁当即处理后用液氮速冻后干冰保存送样进行转录组测序,转录组测序委托北京诺禾致源科技股份有限公司基于Illumina测序平台,利用双末端测序(Paired-End)的方法进行测序,测3个授粉组合同一时期的3组样品,每个样品3个生物学重复,共9组转录组数据。
1.1 基因差异表达分析
因转录与翻译表达具有时间和空间特异性,在不同组织或生长发育条件下表达水平存在显著差异的基因,定义为差异表达基因(differential expression gene,DEGs)。使用DESeq2软件对3个时期不同授粉组合种仁进行分析,筛选阈值为padj<0.05且|log2FoldChange|>1,划分上调DEG和下调DEG[17]。通过R语言和Origin 8.5绘图。
1.2 差异基因GO富集分析
GO功能显著性富集分析给出与基因组背景相比,在差异表达基因中显著富集的GO功能条目,从而给出差异表达基因与哪些生物学功能显著相关。该分析首先把所有差异表达基因向Gene Ontology数据库(http://www.geneontology.org/)的各个term映射,计算每个term的基因数目,然后找出与整个基因组背景相比,在差异表达基因中显著富集。GO富集分析方法为GOseq[17],此方法基于Wallenius non-central hyper-geometric distribution。相对于普通的Hyper-geometric distribution,此分布的特点是从某个类别中抽取个体的概率与从某个类别之外抽取一个个体的概率是不同的,这种概率的不同是通过对基因长度的偏好性进行估计得到的,从而能更为准确地计算出GOterm被差异基因富集的概率。
1.3 差异基因KEGG pathway通路分析
在生物体内,不同基因相互协调行使其生物学功能,通过Pathway显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径。KEGG(Kyoto Encyclopedia of Genes and Genomes)是有关Pathway的主要公共数据库[19]。Pathway显著性富集分析以KEGG pathway为单位,应用超几何检验,找出差异基因相对于所有有注释的基因显著富集的pathway。
1.4 qPCR验证
采用qPCR技术研究板栗种子发育过程中SSS和SS的8个unigenes的表达规律。采用高通量建库后剩余的RNA样本,采用天根反转录试剂盒合成cDNA第一条链。以18sRNA为内参基因,采用EvaGreen染料对筛选出14个淀粉和蔗糖代谢通路中的DEGs进行qPCR验证分析,qPCR引物采用Primer Premier 5进行设计(表1),于成都丹凤科技有限公司进行合成。qPCR条件采用2步法进行:95 °C 酶激活3 min;95 °C变性10 s,58 °C退火和延伸30 s,共40个循环,每次延伸后收集荧光信号;反应结束后于60 °C 逐渐上升至 95 °C的条件下进行溶解曲线分析。试验设3次重复,荧光定量Ct值于EXCEL 2010中进行整理,样品的均一化表达量为2-△Ct(样品△Ct=样品Ct值-内参Ct值),以第I时期自交授粉组合的平均表达量为对照,其表达量定义为1个单位,计算不同授粉组合相对表达量ratio,其计算公式为2-△△Ct(△△Ct = 处理组△Ct - 对照组△Ct)[20]。采用SPSS 21对每个对比组合进行单因素方差分析并标出显著性,使用Origin 8.5软件绘制基因表达模式的柱状示意图。8个unigenes的名称和引物序列如表1所示。

表1 用于qPCR分析的14对unigenes引物Tab.1 Unigenes and sequence of 14 primer pairs for qPCR analysis
2 结果与分析
2.1 测序数据
转录组测序每个样品至少产生41 212 858 b raw reads,经过测序质量控制,每个样品至少得到40 019 732 b Clean reads,总共9个测序样品。各样品Reads与参考序列比对率最低为59.55%,各样品Q30碱基百分比均不小于91.1%,每个样品的GC含量都在44.18%以上(表2)。原始数据已上传至NCBI数据库,SRA登入号为:PRJNA540079。
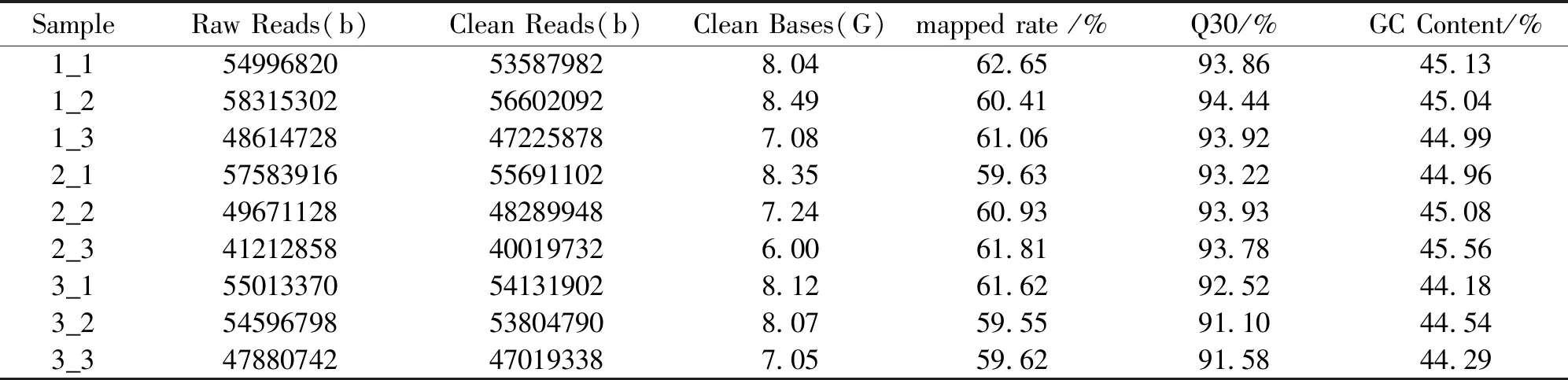
表2 测序数据及组装结果统计Tab.2 Transcriptome sequencing and assembly results
2.2 差异表达分析
对板栗种仁成熟时各授粉组合对比差异基因进行统计发现,同处于种仁成熟第3时期的授粉组合2和授粉组合1之间差异基因数量最少,差异基因总数为2 192个,其中上调差异基因数为1 125个,下调差异基因数位1 067个;而分别与授粉组合3对比时差异基因数量较多,其中授粉组合3与授粉组合2的差异基因量最多为7 251个,上调差异基因数位3 732个,下调差异基因数位3 519个;授粉组合3与授粉组合1的差异基因数量为6 497个,上调差异基因数位3 438个,下调差异基因数位3 059个(图1)。综合得知,在同一时期各授粉组合间差异基因数量差异明显。
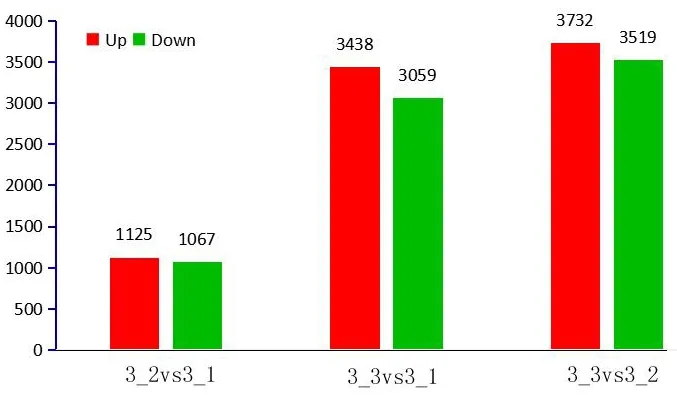
图1 同一时期各组合对比差异基因Fig.1 Comparison of different genes among different combinations in the same period
2.3 板栗种仁同一成熟期不同组合间差异表达基因的GO注释
对比组合的GO-term,见图2,在板栗种仁成熟的第3个时期,分子功能(Molecular_function)中的GO-term条目较多,生物进程(Biological process)中的 GO-term条目较少。而且从图中可以看出生物进程中主要富集的GO条目为protein phosphorylation(蛋白质磷酸化),oxidation-reduction process(氧化还原过程)、plant-type cell wall organization(植物型细胞壁组织)、plant-type cell wall organization or biogenesis(植物型细胞壁组织或生物发生)、single-organism metabolic process(单生物代谢过程)、cell recognition(细胞识别)、pollination(授粉)、pollen-pistil interaction(花粉雌蕊相互作用)、recognition of pollen(花粉识别)、response to auxin(生长素的响应);在分子功能(Molecular_function)中主要富集条目是tetrapyrrole binding(四吡咯结合)、structural constituent of cell wall(细胞壁的结构成分)、kinase activity(激酶活性)、phosphotransferase activity(磷酸转移酶活性)、protein kinase activity(蛋白激酶活性)、oxidoreductase activity(氧化还原酶活性)、ADP binding(腺苷磷酸结合)、nutrient reservoir activity(养分库活动)、heme binding(血红素结合)、phosphorylase activity(磷酸化酶活性)、glycogen phosphorylase activity(糖原磷酸化酶活性)、iron ion binding(铁离子结合)。
此外,由图2可知,在板栗成熟的第3个时期,组合2vs组合1和组合3vs组合2,共有的通路为:plant-type cell wall organization(植物型细胞壁组织)、plant-type cell wall organization or biogenesis(植物型细胞壁组织或生物发生)、tetrapyrrole binding(四吡咯结合)、structural constituent of cell wall(细胞壁的结构成分)。组合3vs组合1和组合3vs组合2,共有的通路为nutrient reservoir activity(养分库活动)、heme binding(血红素结合)。
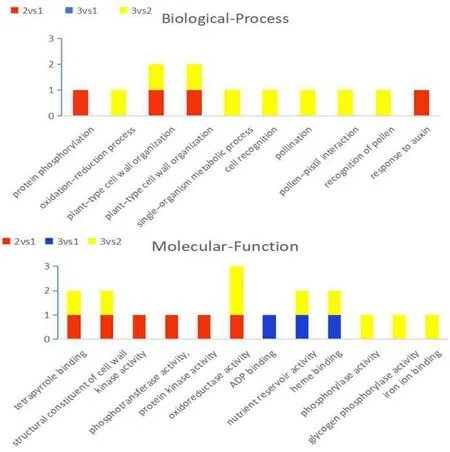
图2 第3时期各授粉组合的GO富集条目Fig.2 Go enriched items of different pollination combinations in the third period
2.4 板栗种仁同一成熟期不同授粉组合间差异基因KEGG pathway通路富集分析
对授粉组合1、授粉组合2和授粉组合3在3个时期的富集在前15的KEGG通路(图3)进行对比,3个组合共同富集的通路有Protein processing in endoplasmic reticulum(内质网中的蛋白质加工)、Plant-pathogen interaction(植物病原体相互作用)、Starch and sucrose metabolism(淀粉和蔗糖代谢)、Phenylpropanoid biosynthesis(苯丙烷生物合成)、Cysteine and methionine metabolism(半胱氨酸和蛋氨酸的代谢)、Glycolysis / Gluconeogenesis(糖酵解/糖异生)、Plant hormone signal transduction(植物激素信号转导)、Ribosome(核糖体)、Photosynthesis(光合作用)。
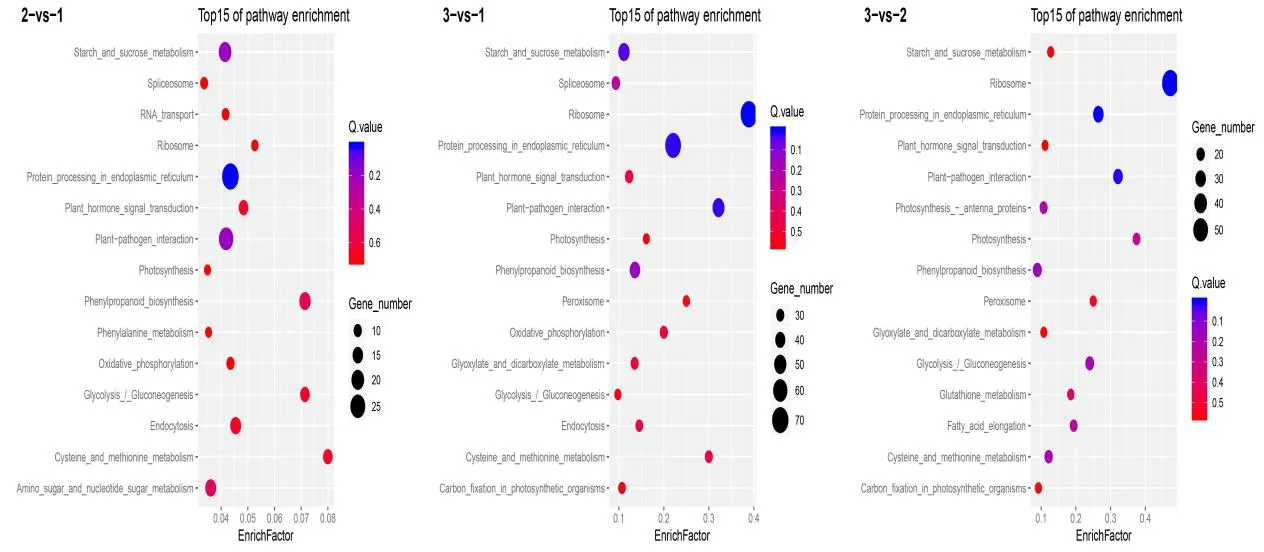
图3 各授粉组合的KEGG富集通路Fig.3 KEGG enrichment pathway in different pollination combinations
由此可知,不同授粉组合的在同一阶段,种仁代谢通路有差异,其中共同富集的通路有内质网中的蛋白质加工、淀粉和蔗糖代谢、植物激素信号转导等,这表明这些代谢在板栗种仁发育成熟过程中起着非常关键的作用。
2.5 花粉直感植物激素代谢通路分析
植物激素信号转导代谢通路中(图4),于同一时期中的各处理组合中皆有差异基因,表明各授粉组合在植物激素信号转导中存在明显的花粉直感效应。
图4 植物激素信号传导(map 04075)Fig.4 Plant hormones signal transduction(map 04075)
在板栗种仁成熟时期,从板栗种仁转录组中鉴定出49个植物激素信号转导unigenes,编码22个蛋白家族(表3)。
编码基因家族中生长素反应蛋白、生长素反应因子、发病相关蛋白1、蛋白磷酸酶2C、生长素反应性GH3基因家族、两组分响应调节器ARR-A系列 、丝氨酸/苏氨酸蛋白激酶、F-box蛋白GID2、生长素流入载体(AUX1 LAX系列)、调节蛋白NPR1的unigenes最多,分别从转录组中鉴定出8个、6个、5个、5个、3个、2个、2个、2个、2个、2个。在2vs1对比组合中,生长素反应性GH3基因家族DEGs呈上调趋势;在3vs1对比组合中,生长素反应蛋白IAA DEGs均为下调;而在3vs1对比组合与3vs2对比组合中均呈下调表达;在3vs1对比组合和3vs2对比组合中,发病相关蛋白1DEGs均下调;在3vs1对比组合和3vs2对比组合中,两组分响应调节器ARR-A系列DEGs均呈上调趋势;在3vs1对比组合和3vs2对比组合中,生长素反应因子DEGs均下调;在2vs1对比组合和3vs1对比组合中,蛋白磷酸酶2CDEGs 均上调表达;在3vs1对比组合和3v21对比组合中,生长素流入载体(AUX1 LAX系列)DEGs均呈下调趋势;在3vs1对比组合和3v21对比组合中,F-box蛋白GID2DEGs均呈下调表达;此外,丝氨酸/苏氨酸蛋白激酶DEGs在这2个对比组合中呈上调趋势,调节蛋白NPR1DEGs均为下调表达。
综合得出,在板栗种仁花粉直感发育过程中,影响植物激素代谢的关键酶存在于以下蛋白家族中:生长素反应蛋白、生长素反应性GH3基因家族、发病相关蛋白1、两组分响应调节器ARR-A系列 、生长素反应因子、蛋白磷酸酶2C、、生长素流入载体(AUX1 LAX系列)、F-box蛋白GID2、丝氨酸/苏氨酸蛋白激酶[EC:2.7.11.1]、调节蛋白NPR1。

表3 在成熟时期参与了植物激素的代谢途径所有对比组合的DEGsTab.3 The DEGs of all comparative combinations involved in the metabolic pathways of plant hormones in mature stage
2.6 荧光定量PCR鉴定
为了验证转录组数据的可靠性,根据unigenes序列设计引物,利用qPCR对淀粉和蔗糖代谢通路中5个上调基因和3个下调基因的表达谱进行了评价。这8个DEGs的表达模式与转录组数据一致,表明转录组分析具有较高的重复性和可靠性(图5)。
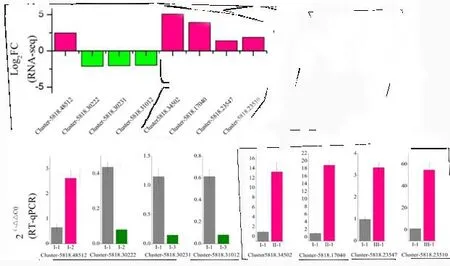
图5 不同授粉组合淀粉和蔗糖合成酶基因相对表达量Fig.5 Relative expression levels of starch and sucrose genes in different pollination combinations
3 讨论与结论
板栗种仁在成熟期第3阶段的授粉组合,差异基因表达数量差异显著。在对差异表达基因的GO分析中,分子功能(Molecular_function)中的GO-term条目较多,生物进程(Biological process)中的 GO-term条目较少。在授粉组合中,组合2 vs组合1和组合3 vs组合2,共有的通路为:plant-type cell wall organization(植物型细胞壁组织)、plant-type cell wall organization or biogenesis(植物型细胞壁组织或生物发生)、tetrapyrrole binding(四吡咯结合)、structural constituent of cell wall(细胞壁的结构成分)。组合3vs组合1和组合3vs组合2,共有的通路为nutrient reservoir activity(养分库活动)、heme binding(血红素结合)。
在各授粉组合中,共同富集的代谢通路有内质网中的蛋白质加工、淀粉和蔗糖代谢、植物激素信号转导等,表明这些代谢在板栗种仁发育成熟过程中起着非常关键的作用。
板栗种仁转录组中鉴定出49个植物激素信号转导unigenes,在板栗种仁花粉直感发育过程中,影响植物激素代谢的关键酶存在于以下蛋白家族中:生长素反应蛋白、生长素反应性GH3基因家族、发病相关蛋白1、两组分响应调节器ARR-A系列 、生长素反应因子、蛋白磷酸酶2C、、生长素流入载体(AUX1 LAX系列)、F-box蛋白GID2、丝氨酸/苏氨酸蛋白激酶[EC:2.7.11.1]、调节蛋白NPR1。
板栗的花粉直感效应对糖和淀粉具有重要影响[21]。本研究以含糖量高的品种作为授粉树,所授粉后的果实中的糖含量也相对较高,以早熟品种授粉结出的果实也早实。表明不同品种的板栗受到不同的花粉直感效应的影响。板栗坚果在发育过程中表现出明显的花粉直感效应。本次研究的KEGG pathway发现参与蔗糖和淀粉代谢的酶主要有关键酶:UDP-葡萄糖-1-磷酸酯尿甙基转移酶、α-1,4-葡聚糖分支酶、淀粉合成酶、蔗糖合成酶和ADP-葡萄糖焦磷酸化酶,这些酶基因对板栗种仁的淀粉合成代谢起调控作用。这与前人研究关于板栗、玉米(Zeamays)、土豆(Solanumtuberosum)、水稻(Oryzasativa)中淀粉合成相关酶报道相一致[22-25]。
在板栗种仁成熟的3个阶段,在I-VS-II时期,DEGs主要集中在细胞壁相关的注释上;I-VS-III时期,DEGs主要集中在各种离子运输上;II-VS-III时期只有注释plant-type cell wall与其他时期对比不同,可以推测在淀粉积累时期,这部分基因可能起主导作用。GO注释和KEGG途径分析表明,栗子仁成熟期间存在各种代谢关系。在板栗种仁中有差异的主要代谢通路从真核生物的核糖体生物发生和RNA聚合酶逐渐转变为内吞作用和剪接体这2条代谢通路。除淀粉和蔗糖代谢外,研究中所有比较结果均显著丰富了RNA转运、RNA降解、嘧啶代谢、嘌呤代谢、植物激素信号转导、植物病原体相互作用和甘油磷脂代谢等生物学功能。
综合得出,不同授粉组合在不同发育时期种仁中淀粉和糖含量在淀粉和蔗糖合成酶、淀粉和蔗糖合成酶基因调控下存在明显的花粉直感效应。在生产上配置好授粉树,对栗树早期高产、提高栗树品质具有指导意义。

