冷藏期间鲜食核桃霉菌总数变化及主要种类鉴定*
李勇鹏,潘莉,宁德鲁,耿树香,张艳丽
(云南省林业和草原科学院,云南 昆明 650201)
核桃是重要的干果和木本油料树种,我国的主要栽培种有普通核桃(Juglansregia)和深纹核桃(J.sigillata)2个种[1],其中深纹核桃主要分布在云南、贵州、四川西部和西藏雅鲁藏布江中下游地区[2],是西南地区的核桃主要栽培种。随着核桃栽培面积和产量的不断提升,核桃产品呈现多样化的发展趋势。核桃鲜果由于具有独特的风味和口感,且营养价值优于核桃干果,越来越受到消费者的喜爱,有很好的市场前景[3]。然而核桃鲜果由于水分含量较高,极易发生霉变而失去商品价值[4]。关于引起核桃霉变的病原菌及其抑制措施已有一些研究,但研究材料主要为普通核桃[5-7],关于深纹核桃霉变的研究尚未见报道。云南省核桃种植面积已超286.67×104hm2,其种植面积和产量均居全国第一,主栽品种漾濞泡核桃为深纹核桃[1]。本文以新鲜的漾濞泡核桃为研究对象,研究了在冷藏(2±1 )℃条件下核桃鲜果霉菌数量的变化及主要的霉菌种类,以期为云南鲜食核桃的贮藏提供理论依据和技术指导。
1 材料与方法
1.1 材料
供试材料 漾濞泡核桃,2019年9月11日采自云南省大理州漾濞县马厂核桃林场,脱去青皮后用清水漂洗,晾干果壳表面的水分。
孟加拉红培养基 蛋白胨5 g,葡萄糖10 g,磷酸二氢钾1 g,硫酸镁0.5 g,琼脂15 g,孟加拉红0.033 g,氯霉素0.1 g,加入水至1 000 mL,121 ℃灭菌20 min。
马铃薯葡萄糖琼脂培养基(PDA) 马铃薯200 g,葡萄糖20 g,琼脂15 g,加水至1 000 mL,121 ℃灭菌20 min。
1.2 材料处理
本实验在云南省林业和草原科学院木本油料工程中心实验室进行,对核桃壳果采用两种试剂进行处理:处理P试剂为ClO2,配制成浓度为80 mg/L的水溶液;处理Q试剂为核桃青皮提取物,青皮提取物的制备方法参考王小双等[8]的方法,配制成浓度为10 g/L的水溶液。将核桃样品分别浸泡于两种溶液中10 s,取出后晾干表面水分。设对照组(CK),不用试剂处理。每个处理100个核桃壳果,重复3次,处理好的新鲜核桃装筐后套上硅窗保鲜袋放入冷库保存。实验至新鲜核桃果壳表面发生明显霉变时终止。
1.3 霉菌总数的测定方法
参照GB 4789.15—2016 《食品安全国家标准食品微生物学检验霉菌和酵母计数》[9]的方法进行,采用平板菌落计数法。样品在冷库保存20 d后,每隔10 d取一次样。称取25 g样品,加入无菌水制成1︰10的样品溶液。(1)核桃壳果样品:将壳果与无菌水充分振摇,制成菌悬液;(2)核桃仁样品:核桃仁加入无菌水后用果蔬搅拌机打成匀浆。
取1 mL的1︰10样品溶液加入装有9 mL无菌水的试管中,充分混匀得到1︰100倍的样品溶液。根据样品的污染程度,制作10倍梯度稀释样品溶液,选择3个稀释度的样品溶液,分别吸取1 mL样品匀液放入2个无菌平皿内,及时将20~25 mL冷却至约46 ℃的孟加拉红琼脂倾注平皿,充分混匀,置水平台面待培养基完全凝固。同时分别取1 mL无菌水注入于2个无菌平皿,倾注培养基作空白对照。琼脂凝固后,置于28 ℃的培养箱中培养,观察并记录培养至第5 d的结果。结果以菌落形成单位(colony-forming units,CFU)表示,用肉眼观察记录菌落数。
1.4 霉菌分离与种类鉴定
1.4.1 核桃壳果主要霉菌的分离、纯化及保存
霉菌的分离采用梯度平板稀释法,结合霉菌计数实验开展,观察孟加拉红培养基长出的各菌落的形态、颜色及菌丝形状,挑取数量和频率都较高的菌落边缘菌丝,转接于PDA培养基上。观察菌落在PDA培养基上正反面的形态,对不纯的菌落转接纯化。纯化后的菌种接种于PDA试管斜面保存。
1.4.2 菌株的形态学特征鉴定
从纯化培养的菌落上挑取少许菌丝制片,在光学显微镜下观察真菌特征。主要包括菌丝颜色、有无隔膜,孢子形态、大小及着生状态等,根据《真菌鉴定手册》[10]等资料鉴定霉菌的种类。
1.4.3 菌株的分子生物学鉴定
将纯化后的菌株在PDA培养基上培养一段时间后,刮取约0.1 g菌丝体,置于2.0 mL的灭菌离心管中,采用(Biospin Fungus Genomic DNA Extraction Kit)方法提取菌株的DNA。用真菌通用引物ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)、ITS1-F(5′-CTT GGT CAT TTA GAG GAA GTA A -3′)对菌株的DNA进行PCR扩增,扩增片段包括ITS1-5、8S-ITS2片段。PCR扩增体系为:25 μL的2×TSINGKE Master Mix,浓度为10 μM的引物ITS4和ITS1-F各1 μL,模板DNA 2 μL,加dd H2O至总体积为50 μL。扩增条件为94 ℃预变性4 min,94 ℃变性30 s,53 ℃退火40 s,72 ℃延伸1 min,30次循环,最后72 ℃延伸7 min。PCR产物经1%的琼脂糖凝胶电脉检测,将亮度清晰且条带范围在500~1 600 bp的PCR产物送上海生工(生物工程技术服务有限公司)测序。测序结果首先运用DNASTAR软件中SeqMan程序对测序结果的胶图进行校正,去掉两端信号不好的部分,保存校正后序列。重新使用SeqMan程序,将所有校正后序列导入软件,进行相似度比对。将所有序列按97%的相似度进行聚类,保存聚类结果。选取每个聚类组的代表序列进行在线NCBI 的Blast检索系统进行同源性比对,选取相似度高的参考序列。将聚类组的代表序列和参考序列导入MEGA 7软件,构建系统进化发育树。
1.4.4 致病性测定
为验证分离的真菌是否会引起核桃霉变,将菌丝接种于消毒好的核桃仁表面。将核桃破壳取仁,将核桃仁放在75%的酒精中消毒5 min,再用无菌水冲洗4次,随后置于灭菌的平板中。挑取少许菌丝置于核桃仁的表面接种,以不接菌的核桃仁为对照。将平板贴好封口膜,置于28 ℃的培养箱中培养,观察霉变情况。
2 结果与分析
2.1 不同处理对核桃壳果霉菌生长的影响
核桃果在贮藏初期的霉菌数量较低,随着贮藏时间的增加而增长。核桃壳表面的霉菌数量初期较低,在40 d后开始快速增长(图1)。后期的霉菌数量为CK>ClO2处理组(处理P)>核桃青皮提取液处理组(处理Q),表明用ClO2和核桃青皮提取物处理核桃壳果,都对核桃壳果表面的霉菌生长有一定的抑制作用,而且核桃青皮提取物对霉菌的抑制效果更好。
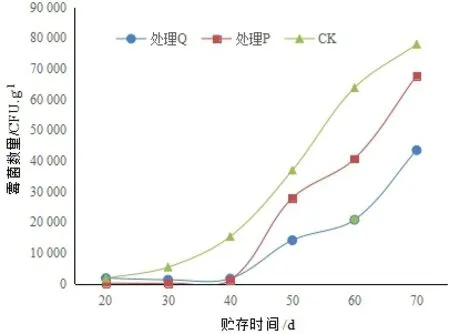
图1 核桃壳果表面不同时间下的霉菌数量注:处理P试剂为ClO2,处理Q试剂为 核桃青皮提取物,CK为对照组,图2同。Fig.1 Number of mould on the surface of walnut husk during storage
核桃仁的霉菌数量在贮藏的前50 d保持在较低的水平,之后开始快速增长,2个处理组与对照组的霉菌数量相差不大(图2)。与果壳表面的霉菌数量相比,核桃仁的霉菌数量较少。用青皮提取物(处理Q)和ClO2(处理P)处理壳果的表面,对壳果表面的霉菌数量有抑制作用,而对核桃仁的霉菌数量无明显的抑制作用,可能是由于果壳的保护作用,壳表面的霉菌和仁的霉菌没有紧密的关联。

图2 核桃仁的霉菌总数Fig.2 Number of mould in the walnut kernel during storage
2.2 主要霉菌种类分离鉴定及致病性验证
2.2.1 形态鉴定
从核桃壳果和核桃仁分离的真菌种类较多,出现频率最多的有2种菌,标记为HTM1-1和HTM1-2。HTM1-1在PDA培养基上生长较快,菌落边缘为白色绒毛状,中间为灰绿色粉粒状霉层,表面干燥。分生孢子梗无色,帚状分枝,孢子灰绿色,卵圆形串生(图3)。根据其形态特征,初步将HTM1-1鉴定为扩展青霉(Penicilliumexpansum)。HTM1-2在PDA培养基上生长很快,菌丝致密,气生菌丝较长,菌丝初期白色,后菌落中间呈现粉色或黄褐色,菌落表面呈现环纹。HTM1-2的新生菌丝无色,成熟菌丝黄褐色,菌丝有明显的隔膜,成熟菌丝的分隔膨大呈连续的节状。在PDA培养基上HTM1-2未观察到大型分生孢子,而在核桃仁培养的菌丝具有典型的镰刀菌属(Fusarium)的大型分生孢子、小型分生孢子和厚垣孢子(图4)。根据其形态特征,将HTM1-2鉴定为木贼镰刀菌(Fusariumequiseti)。
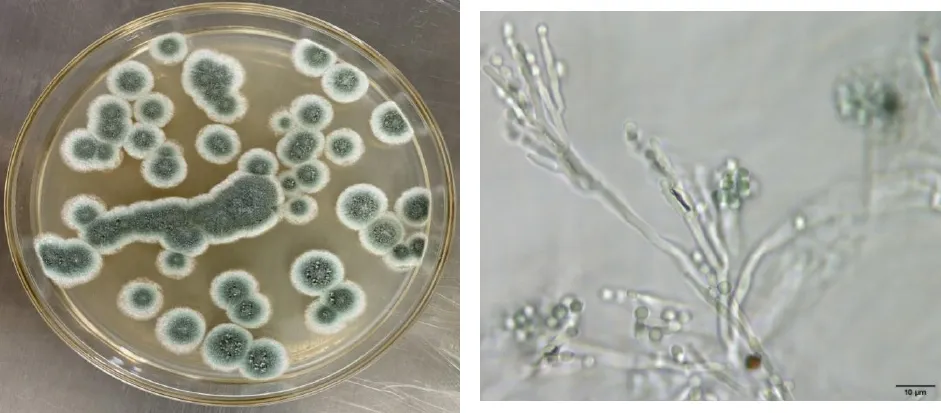
图3 扩展青霉在PDA培养基生长形态及其显微形态(×100)

图4 木贼镰刀菌在PDA培养基的形态及其显微形态(×100)
参照管斌等[11]等的方法,将2种霉菌分别接种于消毒后的核桃仁,对其致病性进行验证。经过一段时间的培养,接种了霉菌的核桃仁出现了和鲜果贮藏后期相同的霉变,未接种的核桃仁没有发生霉变(图5)。接种了扩展青霉的核桃仁表面长出了灰绿色的霉层,接种了木贼镰刀菌的核桃仁长出了白色长丝状菌丝。将霉变核桃仁上的霉菌分离并在PDA培养基上培养,得到了与接种菌株形态特征相同的菌株,证实了扩展青霉和木贼镰刀菌是引起核桃鲜果长出青黑色霉点和白色霉点的致病菌。
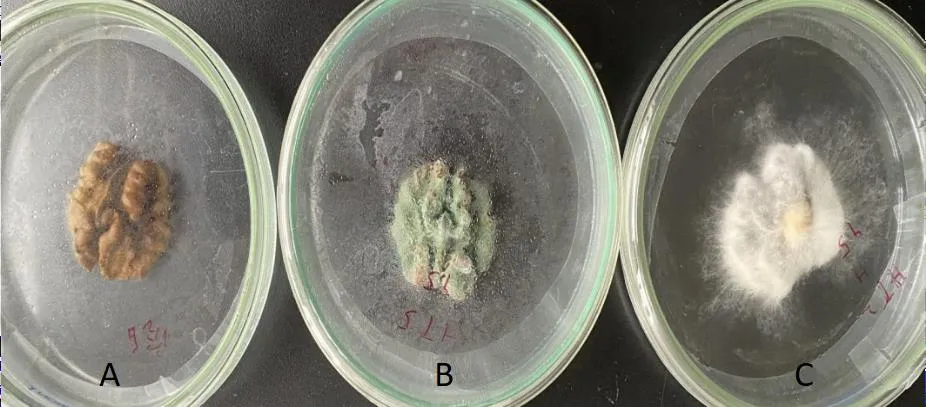
图5 核桃仁接种霉菌后的霉变情况注:A为CK,B为扩展青霉,C为木贼镰刀菌Fig.5 The pathogenecity of isolated fungi
2.2.2 霉菌rDNA-ITS序列分析及鉴定
将HTM1-1和HTM1-2进行分子生物学鉴定,测序得其ITS序列。测序结果在NCBI进行比对,发现它们分别与扩展青霉(Penicilliumexpansum)和木贼镰刀菌(Fusariumequiseti)的相似性达到99.83%和100.00%。将分离菌株的序列和参考序列用Mega 7.0软件构建NJ系统发育树(图6),这2种分离菌株的序列分别与对应的参考序列聚为一枝。综合分子比对结果和形态特征鉴定,将这2种霉菌鉴定为扩展青霉和木贼镰刀菌。

图6 分离菌株基于ITS序列构建的NJ系统发育树Fig.6 Phylogenetic tree based on ITS sequences of isolated fungi
3 结论与讨论
本研究结果表明,在低温贮藏条件下新鲜核桃壳果表面的霉菌数量在40 d后开始快速增加,核桃仁的霉菌数量50 d后开始快速增加。用核桃青皮提取物和ClO2溶液处理核桃壳果,对核桃仁霉菌生长的影响不明显,但对壳果表面的霉菌生长都有明显的抑制作用,其中核桃青皮提取物的抑菌效果优于ClO2。已有研究表明,核桃青皮提取物有较好的抑菌活性[12-13],而且具有一定的药用保健价值[8]。云南核桃的壳果表面纹路较深,果壳凹陷处易发生霉变影响商品的品质。核桃青皮提取物能较好的抑制壳果表面霉菌的生长,而且材料易得,价格低廉,具有良好的开发应用前景。
核桃鲜果由于水分含量高,在冷藏过程中极易发生霉变,防止霉变是核桃鲜果贮藏中需要特别重视的问题。本研究对低温贮藏条件下引起深纹核桃鲜果霉变的主要霉菌种类进行了分离、纯化、形态学和分子生物学鉴定,并对分离的霉菌开展了致病性测定,结果表明引起核桃霉变的主要种类为扩展青霉和木贼镰刀菌。扩展青霉会在核桃种壳和内种皮上形成灰绿色的霉点和霉层,木贼镰刀菌引起白毛状霉变。扩展青霉可导致多种水果腐败变质,引发苹果(Malussieversii)、樱桃(Cerasuspseudocerasus)、油桃(Prunuspersicavar.nectarina)、水蜜桃(Prunuspersica)等水果的青霉病,造成生产和采后损失[14]。扩展青霉会分泌展青霉素,展青霉素可引起细胞氧化损伤,甚至诱发癌症,若残留在食品中,会对食用者健康造成极大危害[15]。镰刀菌是一类重要的植物病原菌,可引起植物的根茎叶果实腐烂,造成严重的经济损失[16]。引起鲜食核桃霉变真菌的主要种类已有相关报道,耿阳阳等[7]从贵州省贮藏期霉烂的鲜核桃上分离的霉菌有毛霉属(Mucor)、镰孢菌属(Fusarium)、曲霉属(Aspergillus),黄凯等[17]分离鉴定了陕西省鲜食核桃贮藏过程的霉菌,得出主要的致病菌为扩展青霉。由于生长环境和品种的不同,引起鲜食核桃发生霉变的霉菌类型会有所不同。云南核桃栽培历史悠久,品种繁多,各栽培区气候条件差异较大。本文以云南核桃主栽品种为研究对象,研究了云南核桃鲜果主产区的果实在贮藏期间的霉变情况和霉菌种类,其他品种和栽培区的霉菌种类和霉变情况有待进一步的研究。本研究通过分离鉴定,发现云南核桃主栽品种漾濞泡核桃在贮藏期间引起霉变的主要真菌为扩展青霉和木贼镰刀菌。由于这2种真菌都是产毒素真菌,在将来的鲜食核桃贮藏研究中,需针对这2种霉菌的生长繁殖特性进一步开发抑制果实霉变的方法。

