β-谷甾醇通过P I3K/A KT通路影响颗粒细胞增殖及凋亡
赵 帅,陈冬梅,2,虎 娜,杨张杰,王宇欣,马会明
(1.宁夏医科大学生育力保持教育部重点实验室,银川 750004;2.宁夏医科大学总医院干细胞研究所,银川 750004)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性最为常见的内分泌紊乱和代谢异常性疾病之一,育龄妇女发病率6%~21%,是女性不孕的主要原因之一[1]。PCOS中颗粒细胞增殖和凋亡异常以及颗粒细胞与卵母细胞间的缝隙连接或旁分泌通讯功能受限,都会导致PCOS卵泡发育障碍,并影响排卵和黄体生成。有文献报道[2],卵巢颗粒细胞增殖和凋亡在促进卵泡发育功能、卵母细胞的成熟以及合成和分泌卵泡抑制素(follicle stimulating hormone,FSH)、雌激素和黄体生成素(luteinizing hormone,LH)等方面均具有重要作用。因此,增强卵巢颗粒细胞的增殖能力、降低凋亡率的作用可改善卵母细胞生长和成熟的微环境,同时也为卵母细胞的生长、发育、募集以及排卵过程提供营养物质,进而改善PCOS的卵巢功能。
β-谷甾醇(β-sitosterol)是一种天然多酚羟酸类化合物,属于甾醇类成分中的主要成分之一,β-谷甾醇通过多靶点、多途径发挥抗氧化、抗炎、抗凋亡和神经保护等生物学活性[3]。β-谷甾醇可通过增加癌细胞凋亡来抑制肝癌、肺癌、胃癌、乳腺癌,在人白血病细胞中表现出显著的抗诱导凋亡活性的作用[4-7]。β-谷甾醇可下调ERK1/2和上调Bcl-2/Bax抑制心肌细胞凋亡[8]。有研究发现[9],PI3K/AKT/GSK3通路在PCOS发病机制中发挥重要作用。IGF1R/PI3K信号通路主要在卵巢颗粒细胞中发挥作用[10]。目前,有关PCOS排卵障碍中卵泡发育延迟和排除受阻的发病机制与颗粒细胞增殖、凋亡和分泌密切相关。因此,需要通过解决颗粒细胞增殖缓慢和凋亡增加的问题,以改善PCOS卵巢排卵障碍的状态。然而,β-谷甾醇抗凋亡、促增殖的特点是否对颗粒细胞具有具体作用也尚未有文献报道。本研究拟通过检测β-谷甾醇对卵巢颗粒细胞的增殖与凋亡及其对PI3K/AKT信号通路相关表达的影响,为PCOS卵泡发育障碍的机制研究提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 主要细胞株 人卵巢颗粒细胞系(KGN)由宁夏医科大学生育力保持教育部重点实验室保存。
1.1.2 主要药物和试剂 β-谷甾醇(MCE公司),P-PI3KCA抗体(Affinity公司),PI3K(Abcam公司),AKT、P-AKT抗体、Caspase-3、GAPDH抗体(博奥森公司),Annexin V-FITC碘化丙啶(PI)双染细胞凋亡检测试剂盒(BD)公司,DAPI染色液、免疫荧光抗兔CY3和FITC二抗(Thermo Fisher公司)、HRP标记二抗(博奥森公司)、CCK-8细胞增殖、细胞周期检测试剂盒、PI染色液、全蛋白提取试剂盒、BCA蛋白含量检测试剂盒、ECL发光液(凯基生物公司)。
1.2 实验方法
1.2.1 细胞培养 用含10%胎牛血清+1%青链霉素的DMEM培养液于37℃、5%CO2的恒温细胞培养箱中培养KGN。
1.2.2 实验分组及试剂配制 分为对照组和β-谷甾醇处理组;β-谷甾醇处理组:10、20、40和80μmol·L-1的β-谷甾醇处理KGN细胞。对照组:无药物处理的细胞,DMEM培养液中培养。1 g的β-谷甾醇粉末溶解于0.5 mL DMSO+29.64 mL DMEM培养液中配制成80 mmol·L-1母液,使用时参照说明书稀释成80μmol·L-1工作浓度。
1.2.3 CCK-8检测不同浓度β-谷甾醇对KGN细胞增殖的影响 收集对数生长期KGN细胞,每孔1×104个细胞,均匀接种于96孔培养板内,37℃培养箱培养24 h,β-谷甾醇处理组分别设置10、20、40和80μmol·L-1浓度梯度,对照组为0μmol·L-1,每个浓度设置6个复孔,培养24 h后,然后每孔分别加入10μL CCK-8溶液,培养箱再培养4 h后,用酶标仪在450 nm波长处检测其光密度(OD)值,确定细胞增殖情况。
1.2.4 CCK-8检测β-谷甾醇作用不同时间对KGN细胞增殖的影响 收集对数生长期KGN细胞,均匀接种于96孔板,添加20μmol·L-1的β-谷甾醇处理细胞,分别培养0、12、24、36和48 h,每个时间点6个复孔,在不同的时间点加10μL CCK-8,培养4 h检测OD值,确定细胞增殖情况。
1.2.5 流式细胞术检测β-谷甾醇对KGN细胞凋亡的影响 20μmol·L-1的β-谷甾醇处理24 h后,用不含EDTA胰酶消化对照组和β-谷甾醇处理组,收集5×105个细胞。PBS洗涤2次,每管加入500μL 1×Binding Buffer 500μL重悬细胞,每管加入5μL Annexin V-FITC混匀后,室温避光孵育15 min,再向每管加入5μL Propidium Iodide(PI)混匀,室温避光孵育5 min,用流式细胞仪上机。实验重复4次取均值计算细胞凋亡率。凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.2.6 流式细胞术测定β-谷甾醇对KGN细胞周期的影响 对数生长期1×104个/mL KGN细胞接种于6孔板中,培养24 h后加入20μmol·L-1的β-谷甾醇处理24 h,同时设对照组,消化离心收集细胞,用预冷的PBS洗涤细胞2次,细胞悬液低速涡旋振荡同时加入70%乙醇后,4℃固定细胞过夜。次日离心沉淀细胞,预冷PBS清洗离心,重悬细胞,每个样品加入400μL PI染色液,37℃避光孵育30 min,用流式细胞仪检测,再用Modifit软件分析颗粒细胞在不同周期中的比例。
1.2.7 细胞免疫荧光法检测KGN细胞内PPI3KCA、P-AKT和Caspase-3蛋白定位和分布 将KGN细胞固定、漂洗、TritonX-100透化、封闭,滴加P-PI3KCA(1∶100)、P-AKT(1∶200)和Caspase-3抗体(1∶100)一抗,湿盒4℃孵育过夜,阴性对照用PBS代替一抗。PBS洗3次,每次5 min;加CY3和FITC标记的羊抗兔IgG(1∶200)荧光二抗25℃避光孵育1 h。PBS洗5次,每次5 min,DAPI染核,PBS洗涤,抗荧光淬灭剂封固,荧光显微镜下观察细胞内P-PI3KCA、P-AKT和Caspase-3蛋白的定位和分布,并避光拍照。
1.2.8 Western blot技术检测KGN细胞PPI3KCA、P-AKT、Caspase-3蛋白的表达 对照组和β-谷甾醇组KGN细胞加入预冷的裂解液,于冰浴中反复用1 mL移液器吹打裂解。BCA测定蛋白浓度,将蛋白调整至统一浓度后,加入5×上样缓冲液,沸水浴10 min蛋白变性后电泳,将蛋白转移至PVDF膜上,5%BSA封闭2 h,TBST洗膜后加入GAPDH抗体(1∶1000稀释)、AKT(1∶300)、PI3K(1∶400)、P-PI3KCA抗体(1∶300稀释)、PAKT抗体(1∶500稀释)和Caspase-3抗体(1∶400稀释),4℃过夜。次日,TBST洗膜,加入HRP山羊抗兔IgG(1∶20000稀释),室温孵育2 h,TBST洗膜,加入ECL发光液曝光并拍照。运用Image Lab图像分析软件测定条带灰度值,并计算PPI3KCA/PI3K、P-AKT/AKT和Caspase-3蛋白相对表达量。
1.3 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 不同浓度β-谷甾醇对KGN细胞增殖的影响
结果显示,与对照组(0μmol·L-1)比较,添加20μmol·L-1β-谷甾醇促进KGN细胞增殖的作用最强(P<0.01),当β-谷甾醇浓度增至40、80μmol·L-1时,β-谷甾醇处理组细胞增殖能力与对照组间相比差异均无统计学意义(P均>0.05),因此,根据药理学Fisher原则中最低有效浓度与最低中毒浓度的原则,选择20μmol·L-1β-谷甾醇培养KGN细胞进行后续实验,见图1。

图1 CCK-8法检测不同浓度β-谷甾醇对KGN细胞增殖的影响
2.2 β-谷甾醇作用不同时间对KGN细胞增殖的影响
CCK-8检测结果显示,添加20μmol·L-1β-谷甾醇的KGN细胞培养不同时间,培养0、12、36、48与24 h相比KGN细胞分裂增殖降低(P<0.01),故选择添加20μmol·L-1β-谷甾醇培养KGN细胞24 h,进行后续实验,见图2。
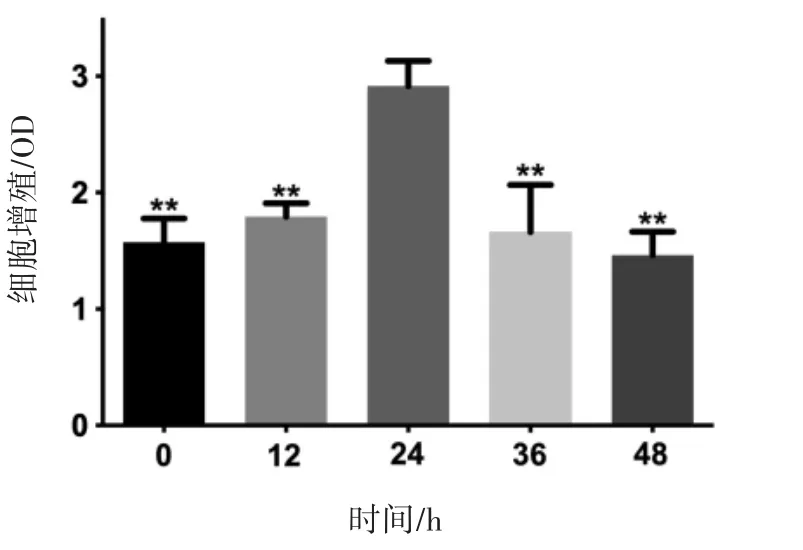
图2 β-谷甾醇作用不同时间对KGN细胞增殖的影响
2.3 β-谷甾醇对颗粒细胞凋亡的影响
流式细胞检测结果显示,20μmol·L-1β-谷甾醇处理组培养24 h,KGN细胞总凋亡率降低(P<0.05),见图3。
2.4 β-谷甾醇对KGN细胞周期的影响
细胞周期实验结果显示:与对照组相比,20μmol·L-1β-谷甾醇作用24 h能增加S+G2/M期细胞所占比例,减少G0/G1期细胞所占比例(P均<0.05),见表1。
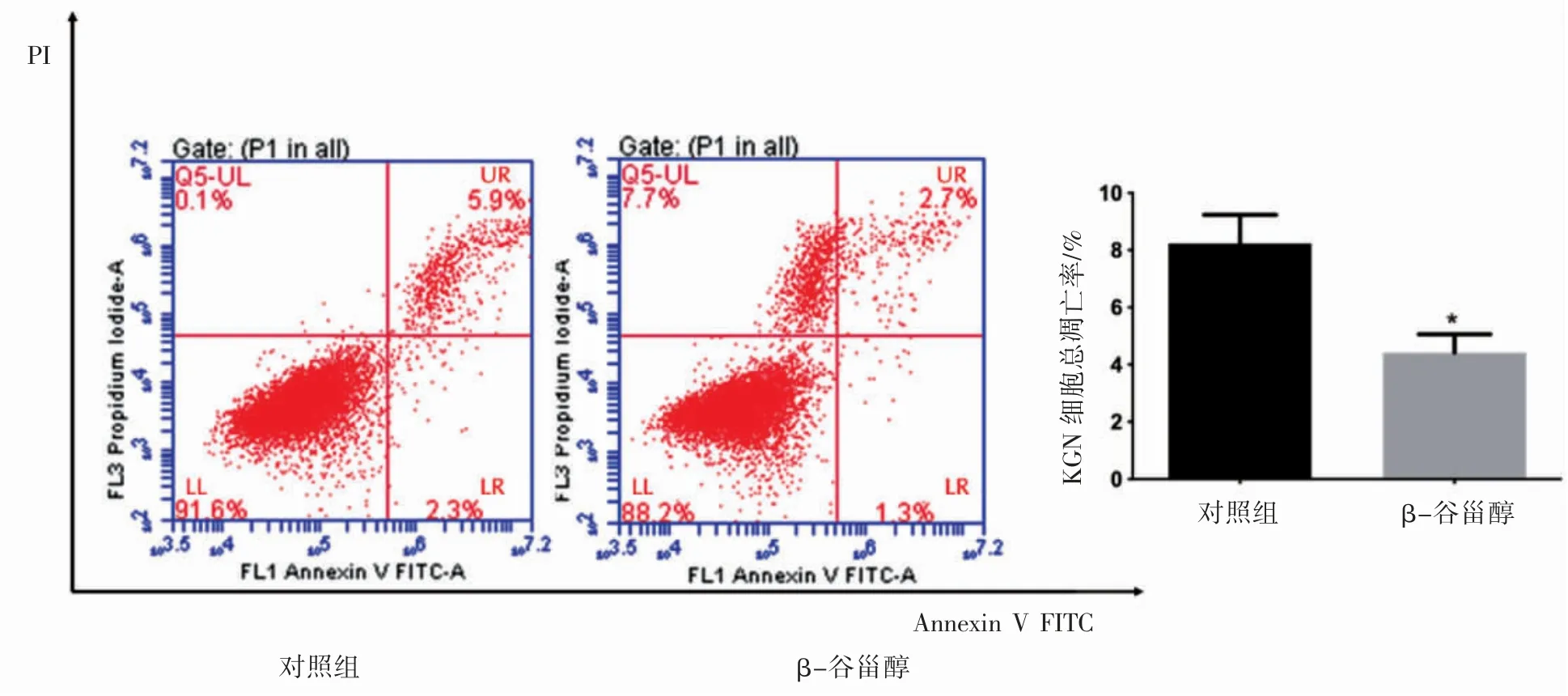
图3 流式细胞仪检测β-谷甾醇对KGN细胞凋亡的影响
表1 β-谷甾醇对KGN细胞周期分布的影响(±s,%)

表1 β-谷甾醇对KGN细胞周期分布的影响(±s,%)
?
2.5 细胞免疫荧光检测KGN细胞内P-PI3KCA、P-AKT、Caspase-3蛋白表达定位
荧光显微镜下观察显示,绿色荧光定位于胞核和胞质,即P-PI3KCA、P-AKT、Caspase-3在颗粒细胞胞核和胞质表达,见图4。
2.6 Western blot检测β-谷甾醇对KGN细胞增殖和凋亡相关蛋白表达的影响
Western blot检测KGN细胞内P-PI3KCA、P-AKT和凋亡家族中Caspase-3蛋白表达,结果显示,与对照组比较,β-谷甾醇处理组P-PI3KCA蛋白和P-AKT蛋白表达上调,Caspase-3蛋白表达下调(P均<0.05),见图5。
3 讨论

图4 细胞免疫荧光检测P-PI3KCA、P-AKT和Caspase-3在KGN细胞中的表达定位(×200)
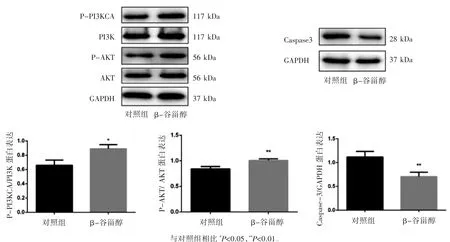
图5 Western blot检测β-谷甾醇对KGN细胞Caspase-3、P-PI3KCA/PI3K、P-AKT/AKT蛋白表达的影响
PCOS的高发病率严重影响女性生活质量,其临床表型多为雄激素过多、排卵障碍和卵巢多囊腔样改变,PCOS颗粒细胞数量的减少以及颗粒细胞增殖受抑制会直接影响PCOS女性排卵,导致不孕。因此,颗粒细胞作为PCOS卵巢卵泡发育的重要功能细胞,其增殖和凋亡会影响雌孕激素的产生,同时也会影响卵母细胞的发育、成熟以及微环境的稳态[11]。本研究中CCK-8结果显示,20μmol·L-1的β-谷甾醇促进颗粒细胞的增殖,在培养24 h时颗粒细胞的增殖能力更加明显。流式细胞结果显示,细胞增殖加快,细胞新陈代谢增加,死亡细胞数相对较多。细胞增殖的促进或抑制是通过调节细胞周期各阶段的DNA含量来实现的,本实验中流式细胞仪测定颗粒细胞DNA含量的结果表明,与对照组相比,β-谷甾醇处理组颗粒细胞的G0/G1期细胞所占比例减少,S+G2/M期细胞所占比例增加,证实β-谷甾醇发挥促颗粒细胞增殖作用。
PI3K/AKT信号通路是调控细胞增殖、凋亡及细胞周期的重要信号通路[12],通过激活PI3K/AKT信号通路能上调细胞增殖能力,抑制细胞凋亡。PI3K(Phosphatidylinositol 3-kinase)作为PI3K/AKT/mTOR信号通路的直接上游关键分子,其亚基PIK3CA导致p110α酶活性的激活,从而刺激了不依赖生长因子的细胞生长[12]。AKT是PI3K的关键下游效应分子,P-AKT作为AKT的活化形式,能磷酸化许多与细胞凋亡密切相关的组件实现细胞存活[13]。而且PI3K激活能有效上调AKT的磷酸化水平,从而激活mTOR调控细胞生物过程,实现细胞存活,在颗粒细胞的增殖、卵泡的发育、闭锁和黄体过程中也扮演着重要的角色[14]。本文采用β-谷甾醇处理颗粒细胞,结果提示,与对照组相比较,β-谷甾醇干预颗粒细胞后P-AKT和P-PI3KCA表达上调,β-谷甾醇组促进颗粒细胞增殖。细胞凋亡的凋亡启动阶段,细胞会存在膜受体途径、细胞色素C释放和Caspases激活等途径[15]。Caspase-3是位于哺乳动物细胞凋亡通路下游关键的死亡蛋白酶,最重要的凋亡蛋白酶,其表达量直接反映细胞凋亡程度[16]。结果显示,与对照组相比较,β-谷甾醇处理颗粒细胞后Caspase-3表达下调,提示β-谷甾醇抑制颗粒细胞凋亡。Annexin V FITC/PI检测结果显示,与对照组相比,在加入β-谷甾醇处理颗粒细胞24后(即细胞培养48 h时),β-谷甾醇可降低颗粒细胞凋亡率,该结果与已有的报道[17-18]结论一致。
综上所述,20μmol·L-1的β-谷甾醇可通过增加P-AKT和P-PIK3CA蛋白表达水平促进颗粒细胞增殖,且降低Caspase-3蛋白表达水平,从而抑制颗粒细胞凋亡。这为PCOS在PI3K/AKT/mTOR的信号通路及作用效果的研究提供了一定的依据。

