康复新液联合泮托拉唑治疗消化性溃疡的安全性分析
李芹芹
乳山市中医院脾胃病科,山东威海 264500
消化性溃疡作为消化道慢性病变的一种表现形式,临床具有较高的发病率,认为患者的发病因素与酸性胃液分泌过量有关,导致其侵蚀患者的胃黏膜,最终引发消化性溃疡[1];此外,幽门螺杆菌、病毒或是长期酗酒等也会增加患者罹患该疾病的风险。对患者进行检查可以发现病灶常见于酸性胃液接触部位,即胃部、十二指肠[2];患者的症状表现多集中于上腹部疼痛以及反复出现泛酸、恶心、呕吐等。积极探讨有效的治疗方案是确保患者拥有正常生活质量的前提,也是患者生命健康的有效保障[3]。基于此,该次方便选择该院于2018年1月—2019年1月收治的88例消化性溃疡患者作为其研究的对象,通过对比两种药物疗法展开讨论分析,现报道如下。
1 资料与方法
1.1 一般资料
方便选择该院收治的88例消化性溃疡患者作为研究对象,纳入标准:①患者有反复泛酸、胀气以及周期性上腹痛症状,经胃镜确诊为消化性溃疡;②溃疡直径5~20 mm;③尿素酶快速试验为阳性结果;④患者本人(或家属)对该研究知情且授权。排除标准:①脏器功能障碍者;②肝胆手术史者;③消化道手术史者;④妊娠期、哺乳期女性;⑤沟通障碍、精神疾病者等。
研究通过医学伦理委员会审核;结合患者入院就诊日期的奇偶性以及44例单组区间条件将患者划分为对照组、研究组。对照组男29例,女15例;平均年龄(54.52±22.58)岁,平均病程(13.61±12.03)个月。研究组男31例,女13例;平均年龄(54.49±23.51)岁,平均病程(12.65±11.54)个月。比较分析两组患者基线资料相应数据,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组的治疗方案为泮托拉唑:取40 mg泮托拉唑钠肠溶片(国药准字H20067169)给予患者口服,1次/d,持续治疗28 d。
研究组的治疗方案为泮托拉唑联合康复新液:泮托拉唑治疗方案与对照组相同,取10 mL康复新液(国药准字Z51021834)口服,3次/d,持续治疗28 d。
1.3 观察指标
①分别于治疗前后取患者晨起空腹状态下的静脉血3 mL行酶联免疫法检测,以3 000 r/min速率离心处理,持续20 min,检查胃动素(MTL)、胃泌素(GAS)以及缩胆囊素(CCK)水平[4]。②分别于治疗前后以荧光异硫氰酸荧光素对患者的CD3+、CD4+水平进行测定,以藻红蛋白对CD8+水平进行测定[5]。③记录并对比两组患者的溃疡愈合时间、住院时间。④记录并对比两组患者的不良反应发生率,包括头晕呕吐、便秘腹泻等,以及1年内复发率。
1.4 统计方法
采用SPSS 21.0统计学软件进行数据分析,计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以频数和百分比(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后MTL、GAS、CCK水平对比
治疗前两组的MTL、GAS、CCK水平趋同,差异无统计学意义(P>0.05),治疗后研究组的MTL水平高于对照组,GAS、CCK水平低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 治疗前后T淋巴细胞亚群水平对比
治疗前两组的T淋巴细胞亚群水平趋同,差异无统计学意义(P>0.05),治疗后研究组的CD8+低于对照组,CD3+、CD4+高于对照组,差异有统计学意义(P<0.05)。见表2。
表1 两组患者治疗前后MTL、GAS、CCK水平对比(±s)
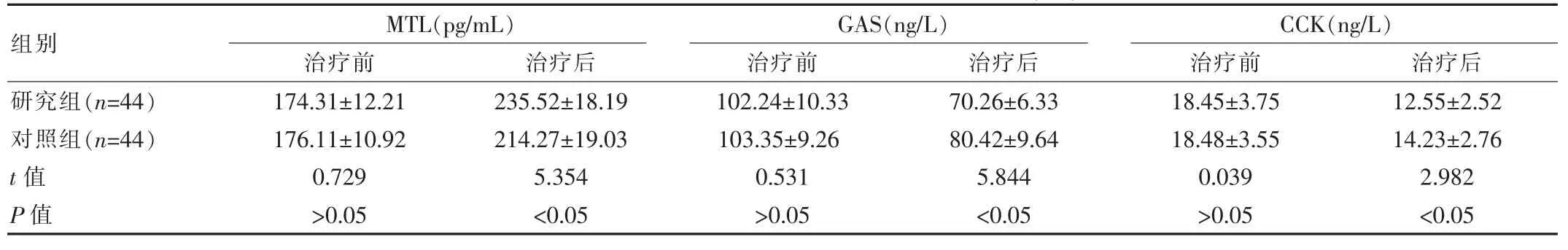
表1 两组患者治疗前后MTL、GAS、CCK水平对比(±s)
?
表2 两组患者治疗前后T淋巴细胞亚群水平对比[(±s),%]
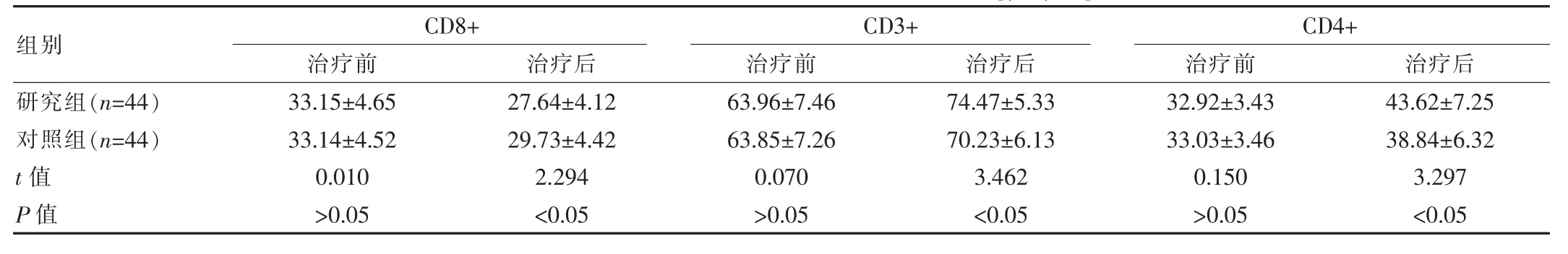
表2 两组患者治疗前后T淋巴细胞亚群水平对比[(±s),%]
?
2.3 临床指标对比
研究组的溃疡愈合时间(15.41±1.31)d以及住院时间(20.40±2.50)d均优于对照组的(20.49±2.87)d、(24.55±3.65)d,差异有统计学意义(t=10.681、6.222,P<0.05)。
2.4 不良反应发生率与复发率对比
研究组头晕呕吐1例,便秘腹泻1例,不良反应发生率2例(4.55%),1年内复发率1例(2.27%);对照组头晕呕吐6例,便秘腹泻4例,不良反应发生率10例(22.73%),1年内复发率8例(18.18%),两组对比差异有统计学意义(χ2=6.175、4.456,P<0.05)。
3 讨论
消化性溃疡为临床发生率较高的消化道疾病,因其有较长的慢性潜伏期,会对患者的生命健康、生活质量造成较大危害[6]。目前临床难以通过有效方案促使患者痊愈,病情反复发作的可能性较大,认为与患者致病原因、治疗方案的匹配性较差有关。患者致病原因包含多个方面,例如胃酸分泌过量、胃黏膜受损、Hp感染、酒精、饮食不节等,临床治疗期间需要结合患者的发病原因拟定对症疗法,以此提高治疗方案的针对性与有效性。
该研究中分别对患者行泮托拉唑治疗、泮托拉唑联合康复新液治疗,结果显示:治疗后研究组的MTL水平(235.52±18.19)pg/mL、CD3+(74.47±5.33)%、CD4+(43.62±7.25)%高 于 对 照 组 (214.27±19.03)pg/mL、(70.23±6.13)%、(38.84±6.32)%,GAS、CCK水平(70.26±6.33)ng/L、(12.55±2.52)ng/L、CD8+(27.64±4.12)%低于对照组的(80.42±9.64)ng/L、(14.23±2.76)ng/L、(29.73±4.42)%,研究组的溃疡愈合时间及住院时间(15.41±1.31)d、(20.40±2.50)d均优于对照组 (20.49±2.87)d、(24.55±3.65)d(P<0.05);研 究 组 不 良 反 应 发 生 率(4.55%)与1年内复发率(2.27%)均低于对照组22.73%、18.18%(P<0.05)。这与王荣模[7]的研究结果:实验组不良反应发生率(3.85%)低于参照组17.31%(P<0.05),基本一致。分析原因,泮托拉唑可抑制胃酸,调控壁细胞活性酶,避免酸性物质运转至细胞外,最终降低患者的胃酸含量[8-9];而康复新液也具有抑制胃酸的作用,同时还能发挥利血生肌的作用,通过促进胶原纤维与粘连蛋白的合成,缩短坏死组织细胞的脱落周期以及新生肉芽组织的生长周期,以促使患者溃疡面在短时间内愈合[10];不仅如此,康复新液还可以作用于人体的免疫系统,促进免疫细胞增生,改善患者血清溶菌酶、增值酶等活性,最终改善患者的组织免疫功能,加快溃疡面愈合[11]。因此二者联合使用可为患者的溃疡营造一个缺酸环境,缩短其愈合周期。除此之外,由于康复新液联合泮托拉唑,受到康复新液免疫作用以及促进细胞增生作用、泮托拉唑抑制胃酸分泌作用的协同影响,可在短时间纠正患者病灶环境,对溃疡面进行有效控制,最终为患者的临床治疗安全性提供较好的保障,同时减少患者病情复发的风险性,为其预后发展奠定较好的基础条件[12]。
综上所述,康复新液联合泮托拉唑治疗消化性溃疡可有效纠正患者病情,减少其复发风险的同时,还能为患者提供较好的安全保障,具有推广应用的价值。

