不同pH值下蒙脱土对雌激素的吸附特征
陆大培
(宇寰环保科技(上海)有限公司,上海 201100)
1 背景
纳米颗粒物是至少一维尺度在1~100 nm之间的颗粒[1]。在天然环境中,纳米颗粒物广泛存在,人类肉眼难以识别,且由于其比表面积大,对污染物吸附性能强。因此,它很可能会成为污染物在水环境中的传输工具或者会对污染物的迁移及其生物有效性等产生重要影响[2~5]。 蒙脱土是一种常见的由自然界产生的纳米颗粒物(NPs)[6]。 蒙脱土是由两层硅氧四面体和一层铝氧八面体组成的层状硅酸盐晶体,具有良好的膨胀性、阳离子交换性,水介质中的分散性、胶质价、粘性等。研究表明,钱塘江下游冲积物、长江中下游各种沉积物以及海河下游冲积物均含有大量的蒙脱类矿物[7]。
环境内分泌干扰物 (EDCs) 是通过介入生物体的荷尔蒙合成、分泌、体内输送、结合、反应或分解而影响生物体正常性的维持,影响生殖、发育或行动的外来物质(美国环境保护署EPA定义)[8],主要以城市工业污水、市政污水、垃圾填埋场或污泥的浸出液、农业中的再生水等方式进入环境[9,10]。Martinovic等[11]研究表明,当人体长期接触含雌激素的水环境后,即使其质量浓度很低,也将造成生育能力的降低。2012年,聂明华等[11,12]在黄浦江上游水源地检出了雌激素,引起了广泛的关注。因此,研究水环境中雌激素的吸附/解吸行为对控制该类有机污染物在环境中的生态效应具有一定的意义。
作为一种天然水环境中常见的纳米级矿物,蒙脱石对EDCs的吸附还有待深入研究,尤其是水环境中影响因子较多。pH值作为水环境中重要因子之一,本文以蒙脱土为研究对象,探究了pH值对蒙脱土的尺寸和Zeta电位的影响及pH的调节时间对蒙脱土和雌二醇(E2)、炔雌醇(EE2)之间吸附/解吸行为的影响,为了进一步探究蒙脱石对EDCs的吸附/解吸机理,还考虑了调节pH值和吸附的顺序对吸附/解吸的影响,即先调节pH值后吸附EDCs和先吸附EDCs后调节pH值的解吸特征进而探讨了其对EDCs的吸附性能和机理。
2 材料与方法
2.1 仪器与试剂
仪器:英国Malvern公司Zetasizer系列Nano-ZS90型Zeta电位-粒度分析仪,上海智城分析仪器制造有限公司ZHWY-304多功能脱色摇床,长沙湘仪离心机仪器有限公司TD5A-WS台式低速离心机,昆山市超声仪器有限公司KQ5200E型超声波清洗器。
试剂:雌二醇E2、炔雌醇EE2标准物质购买自德国Dr.Ehrenstorfer公司,纯度分别为98.5%、99.0%,分子式分别为C18H24O2、C20H24O2。炔雌醇与雌二醇分子结构相似(图1),两者的性质见表1。实验所用标准物质储备液为1 g/L,为标准物质溶解于HPLC级甲醇中制得。本研究所用的所有实验用水均为超纯水,HPLC级甲醇和乙腈均为分析纯。
图1 E2、EE2结构

表1 E2、EE2的性质
2.2 蒙脱土
蒙脱土是由两层Si-O四面体和一层Al-O八面体组成的层状硅酸盐晶体,层内含有阳离子主要是Na+、Mg2+和Ca2+等,表面通常带负电。研究所用的蒙脱土购买自美国普渡大学粘土矿物协会粘土来源库,采自怀俄明州克鲁克郡,为钠基蒙脱土。
2.3 粒度和Zeta电位分析
室温下,分别以1 mol/L的HCl溶液及1 mol/L的NaOH溶液配制pH值为3.0~11.0的水溶液。将0.1 g蒙脱土分散于已配制好的18 mL不同pH值的水溶液中,取稳定溶液,使用英国Malvern公司Zetasizer系列Nano-ZS90型Zeta电位-粒度分析仪测定水溶液中蒙脱土颗粒的表面电位及团聚体尺寸,样品连续测3次,取均值。
2.4 吸附及解吸实验
2.4.1 吸附等温线
运用批处理实验方法进行吸附行为研究。以甲醇为溶剂将E2、EE2标准物质的储备液稀释到0.01~1.00 mg/L。所有批处理实验均使用带有Teflon垫片的20 mL玻璃顶空瓶,每组均设3个平行。实验过程中,每个小瓶内均加入0.1000 g蒙脱土和18 mL超纯水,然后根据实验设计加入所需量的标准物质。
所有实验组均在室温(25 ℃)下振荡3 d,蒙脱土对E2、EE2的吸附,3天时间已足够达到吸附平衡[13,14]。振荡后的样品于4000 r/min高速离心机中离心20 min,取上清液测定。运用美国Agilent公司Agilent 1200型液相色谱仪测定水中E2、EE2的浓度,仪器条件为:流动相为乙腈/超纯水(体积比为6∶4),反向柱(OSD,5μm,2.1×150 mm)、荧光检测器(FLD;激发波长280 nm,发射波长312 nm),流速1 mL/min,检测限为1 μg/L。
实验过程中,甲醇浓度控制在<0.5%,以保证其对吸附实验没有明显的影响[15]。系统损失来源于瓶壁和瓶盖上的吸附以及挥发进入空气中的部分,因此通过对照实验修正,系统损失小于10%。
2.4.2 pH值对吸附行为的影响
探究了先调节pH值后吸附(pH-Sorption)和先吸附后调节pH值(Sorption-pH)对蒙脱土吸附E2、EE2的吸附特征。室温下,分别以1 mol/L的HCl溶液及1 mol/L的NaOH溶液配制pH值为3.0~11.0的水溶液。先调节pH值后吸附(pH-Sorption):将0.1 g蒙脱土分散于已配制好的18 mL不同pH值的水溶液中,在室温下振荡12 h之后,注入8 μL标准物质储备液,继续振荡3 d,达到吸附平衡。先吸附后调节pH值(Sorption-pH):将0.1 g蒙脱土分散于18 mL水中,注入8 μL标准物质储备液,在室温下振荡3 d之后,分别以0.0001~0.1 mol/L的HCl溶液及0.0001~0.1 mol/L的NaOH溶液pH值到3.0~11.0,继续振荡1d。振荡后的样品于4000 r/min高速离心机中离心20 min,取上清液测定。
2.4.3 动态解吸实验
室温下,使吸附分别在pH值为3.0和11.0条件下达到平衡后,4000 r/min下离心20 min,移除上清液,再分别加入18 mL pH为3.0和11.0的水溶液,重新振荡,分别振荡0 min、10 min、20 min、30 min、1 h、5 h、24 h、48 h和96 h后,取上清液测定。
2.4.4 pH值对解吸行为的影响
运用批处理实验探究了先调节pH值后吸附(pH-Sorption)和先吸附后调节pH(Sorption-pH)的解吸特征。先调节pH值后吸附 (pH-Sorption):将0.1 g蒙脱土分散于已配制好的18 mL不同pH的水溶液中,在室温下振荡12 h之后,注入8 μL标准物质储备液,继续振荡3 d,达到吸附平衡后离心,取上清液检测。移除上清液,再分别加入18 mL不同pH值的水,重新振荡几秒后,取上清液检测。先吸附后调节pH值(Sorption-pH):将0.1 g蒙脱土分散于18 mL水中,注入8 μL标准物质储备液,在室温下振荡3 d之后,分别以0.0001~0.1 mol/L的HCl溶液及0.0001~0.1 mol/L的NaOH溶液pH值到3.0~11.0,继续振荡1 d后离心,取上清液检测,移除上清液,再分别加入18 mL不同pH值的水,重新振荡几秒,取上清液检测。
3 结果与讨论
3.1 pH值对蒙脱土的尺寸和Zeta电位的影响
由表2可见,蒙脱土胶体分散系表面带负电。在pH值3.0~11.0范围内,蒙脱土胶体分散系的Zeta电位和粒径变化范围较大,分别为-20.80~-31.60 mV和1030~1947 nm,且在酸性环境中(pH 3.0)的Zeta电位远低于碱性环境中(pH 11.0)的,而酸性环境中(pH 3.0)蒙脱土胶体分散系的颗粒粒径远大于碱性(pH 11.0)的。
Zeta电位(Zeta potential)是表征胶体分散系稳定性的重要指标,是对颗粒之间相互排斥或吸引强度的度量。Zeta电位(正或负)越高,分子或分散粒子越小,体系越稳定,即分散可以抵抗聚集。反之,则分散被破坏而发生凝结或凝聚。蒙脱土胶体表面带负电,在酸性环境中,分散体系中含有大量的带正电荷的H+,大量的H+降低了该分散体系的Zeta电位,颗粒间相互吸引力大于斥力,易于团聚,从而相对应的颗粒粒径较大,且颗粒聚集速度较快(对比表2中酸性和碱性环境中单次测得的胶体粒径的增长速度可知),体系不稳定。相反,在碱性环境中,分散系的Zeta电位较高,体系相对稳定,相对应的颗粒粒径较小。
3.2 吸附实验
3.2.1 吸附等温线
用Freundlich方程对吸附等温线数据进行拟合:
Cs=KFrCwn
(1)
式(1)中,Cs和Cw分别表示E2、EE2在蒙脱土上的含量(mg/kg)和水相中的浓度(mg/L),KFr为Freundlich吸附系数,n值则表现其吸附线性特征.吸附等温线如图3所示,Freundlich模型拟合结果均较好,R2>0.983,且均方差较小(表3) 。通过logKFr和n可见,对两者的吸附均表现出显著的非线性特征(n>1.6),蒙脱土对E2、EE2均有较好的吸附性,且蒙脱土对E2具有更强的吸附能力。

表2 不同pH下蒙脱土的尺寸和Zeta电位
Emmerik等[14]研究发现蒙脱土对E2的吸附过程是一个由扩散作用控制的过程,且在吸附过程中,除了表面吸附,E2分子还进入了蒙脱土的内层结构中,这种吸附方式较表面吸附更为牢固。EE2与E2分子结构非常相似,可以推断两者的吸附原理应该也十分相似。由表1可以看出,E2在水中的溶解度大于EE2,EE2比E2多含有一个乙炔基,分子相对E2较大,较E2更难进入蒙脱土的内层结构。因此,蒙脱土吸附E2的能力更强.Shareef等发现蒙脱土对E1的吸附能力较EE2更强,而与EE2(Kow=4.15)相比,E1(Kow=3.43)水溶解性更强,这也与本研究结果相符[15]。
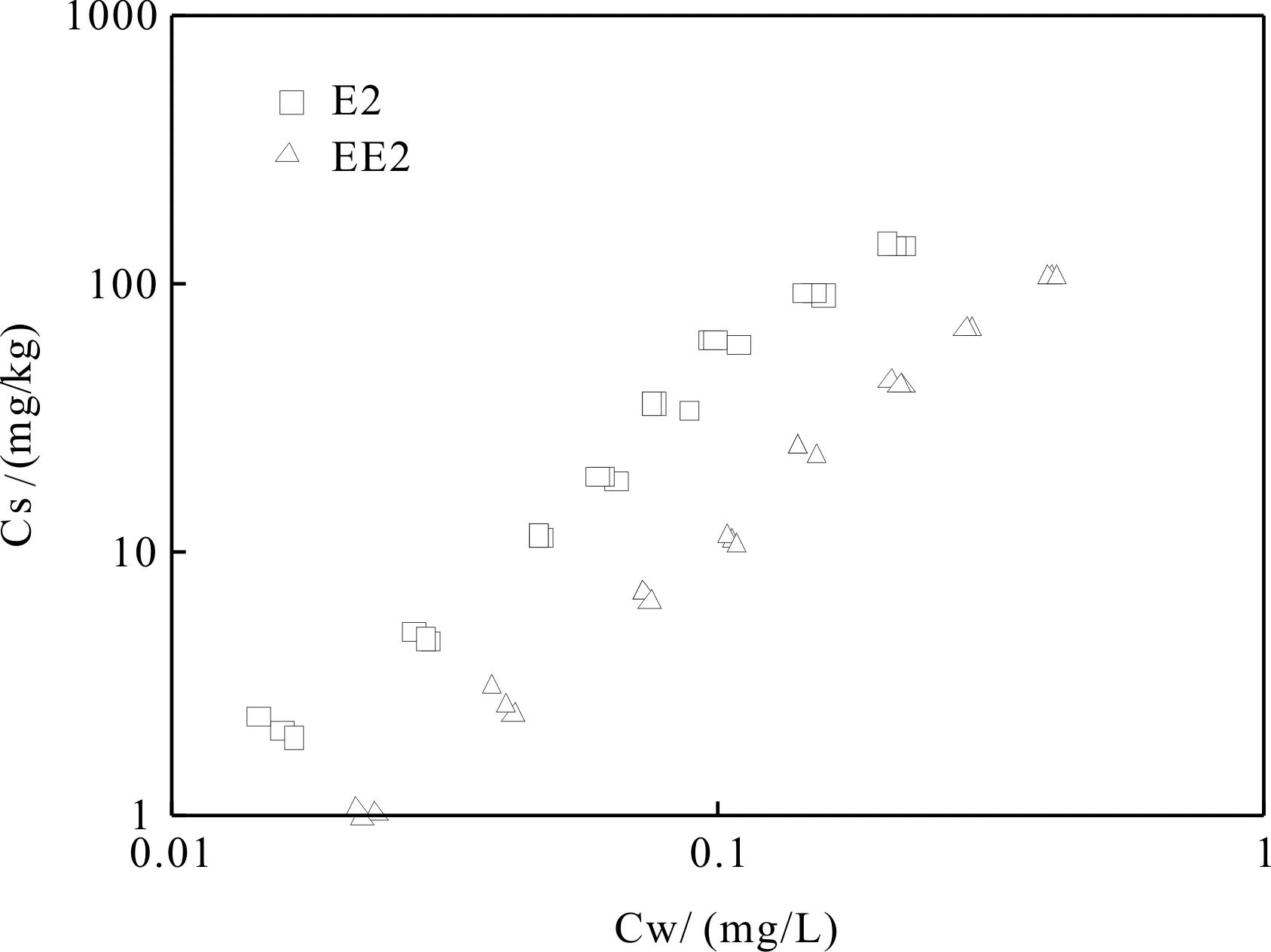
图3 E2、EE2在蒙脱土上的吸附等温线

表3 Frenundich模型拟合参数
3.2.2 pH值对吸附行为的影响
为了揭示蒙脱石对EDCs的吸附/解吸机理,分别探究了先调节pH值后吸附(pH-Sorption)和先吸附后调节pH(Sorption-pH)对蒙脱土吸附E2、EE2的影响。由图4可以看出,pH-Sorption实验组中蒙脱土对E2、EE2的吸附明显受到pH值的影响,且两者的吸附率随pH值的变化趋势一致。pH=3.0时,蒙脱土对E2、EE2的吸附率分别为62%和39%,pH=11.0时,吸附率分别上升至97%和81%,且蒙脱土对E2、EE2的吸附率总体上随pH值的升高而增大。而Sorption-pH实验组中pH值对蒙脱土吸附E2、EE2的影响不明显,吸附率随pH值在一定范围内波动,分别维持在70%和60%左右。
Shareef和Nagasaki等分别研究了EE2和壬基酚在蒙脱土上的吸附,也得出了相似的结论[15,17]。由pH值对蒙脱土的尺寸和Zeta电位的影响可以看出,蒙脱土颗粒在酸性环境中更容易聚集,形成较大的胶团,比表面积较碱性环境中更小,因此表面吸附产生的吸附量也更小。另外,Shareef等[15]认为,pH值改变了蒙脱土的聚集形态,在酸性环境中,蒙脱土颗粒间以一种边对面的形式聚合在一起,而在碱性环境中则以一种面对面的形式聚集。在面对面的聚集方式中,E2、EE2等吸附质更易进入蒙脱土的层间结构,增大了吸附量,而且吸附质进入层间结构后更难被解吸出来,这也解释了E2、EE2在碱性环境中更不易被解吸的原因。
Emmerik等[14]认为蒙脱土对E2的吸附不受pH值的影响。他的研究是以pH10.0为起点,以一个pH值单位为梯度,逐渐降低pH值至3.0,而本研究中Sorption-pH实验组的吸附率变化不明显,可能是因为蒙脱土的初次吸附达到平衡之后再改变吸附环境(pH),吸附平衡点很难再次改变。而Emmerik等的实验是一个阶梯式的过程[14],吸附在最初pH10.0达到平衡后,再改变pH值,此时平衡点已不再改变,因此得出了蒙脱土对E2的吸附不受pH值的影响的结论。Shareef等[15]也曾在pH10.0的状态下达到吸附平衡后,再在pH7.0和4.0的状态下解吸,没有得到解吸量。
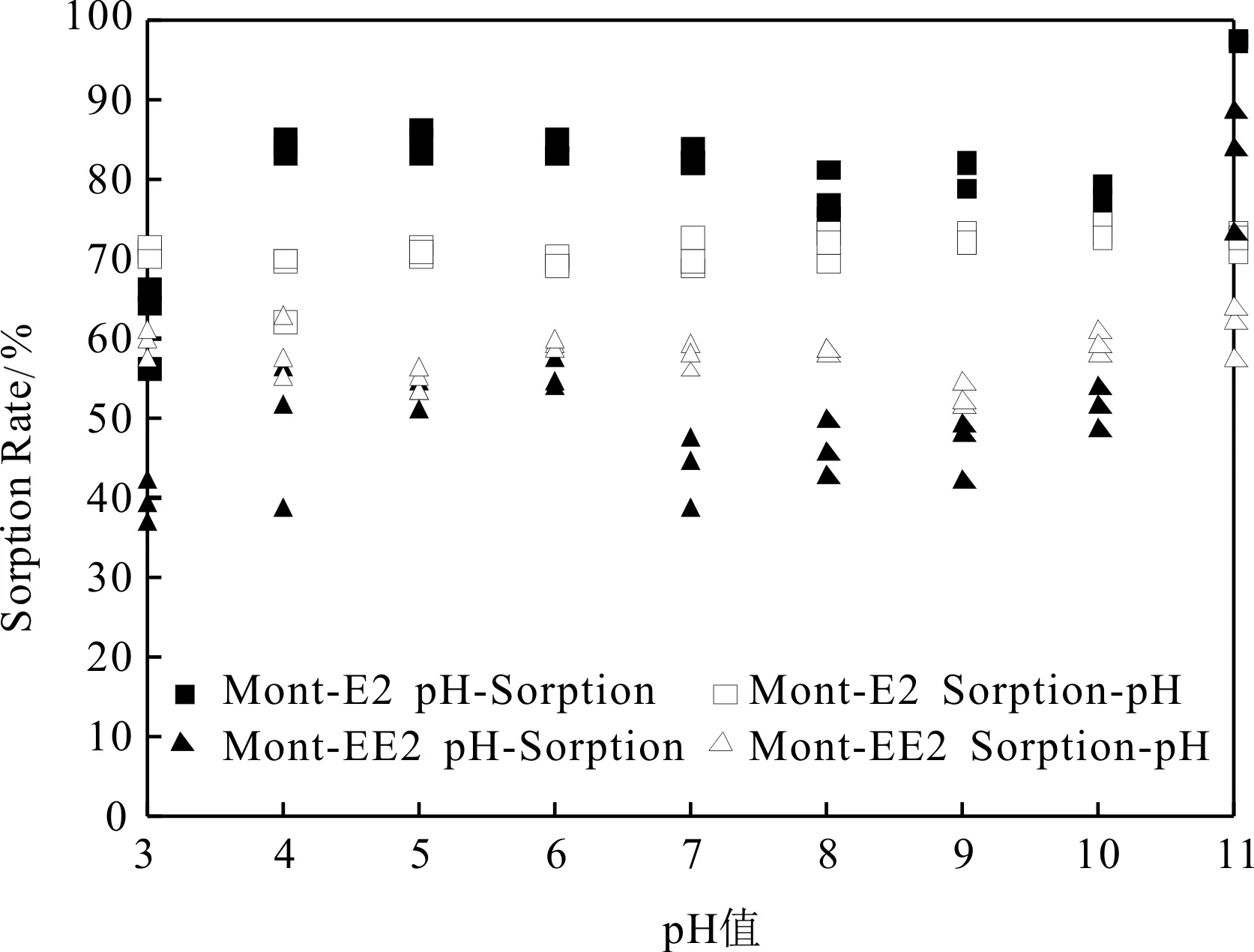
图4 pH值对蒙脱土吸附E2、EE2的影响
3.2.3 不同pH值下的动态解吸实验
动态解吸实验结果(图5)表明,所有的解吸均在最初的几秒内就已经完成,且EE2较E2解析率更高。在pH=3.0的条件下,E2的解吸达到15%,EE2的解吸率达到30%;在pH=11.0件下,E2、EE2基本无解吸。所有的解吸均在最初的几秒内就已经完成,说明被解吸下来的基本上都是表面吸附的物质。因为EE2分子较E2分子更大,相对更难进入蒙脱土的层间结构,更多的可能是表面吸附,表面吸附相对层间吸附更容易被解吸下来,因此,EE2的解吸率更高。酸性环境中,蒙脱土以边对面的形态聚集,E2、EE2等吸附质更不易进入蒙脱土层间结构,碱性环境中,蒙脱土以面对面的形态聚集,E2、EE2更容易进入层间结构,蒙脱土与吸附质结合得更为紧密。因此,在碱性条件下,E2、EE2更不易被解吸。

图5 pH 3.0(实心、)和pH11.0(空心、)下
3.2.4 pH值对解吸行为的影响
由图6可以看出,E2、EE2的pH-Sorption实验组在pH3.0下解吸率都较高,分别为15%和30%,从pH4.0开始解吸率都迅速降低,pH11.0时都几乎为0。而E2、EE2的Sorption-pH实验组在pH值3.0~11.0范围内解吸率都几乎不变。

图6 pH值对E2、EE2在蒙脱土上的解吸的影响
4 结论
(1)在pH 3.0~11.0范围内,酸性环境下(pH 3.0),蒙脱土胶体的Zeta电位低于碱性环境下(pH 11.0)的,而胶体颗粒粒径远大于碱性(pH 11.0)的。
(2)蒙脱土对E2、EE2的吸附性均表现出显著的非线性特征(n>1.6),蒙脱土对E2具有更强的吸附能力。
(3)pH值的调节时机对吸附结果影响明显,先调节pH值后吸附情况下,吸附率总体上随pH值的升高而增大,这主要与不同pH值下蒙脱土胶体的粒径和聚集形式有关;先吸附后调节pH值情况下,pH值对蒙脱土吸附E2、EE2的影响不明显。
(4)所有的解吸均在最初的几秒内就已经完成,且EE2比E2更容易被解吸下来,两种物质均在酸性条件下更易被解吸。

