摆位误差对宫颈癌放疗靶区和危及器官剂量分布的影响
牛利君
陕西省安康市人民医院肿瘤放疗科,陕西安康 725000
我国每年死于宫颈癌的患者约5万例,且呈逐年上升的趋势,严重威胁妇女健康。宫颈癌的主要病理类型为鳞癌[1]。放疗是目前治疗宫颈癌的常规手段,其中调强适形放射治疗(IMRT)是三维适形放疗的拓展,通过计算机制订治疗计划,减少了靶区周围危及器官的受照射体积,实现了三维空间上剂量分布与肿瘤形状的一致,提高了肿瘤靶区的放疗剂量及放射生物学效益,增强了放射治疗效果[2-3]。但在实际应用中,肿瘤的大小与位移、机体充盈程度及体形改变、危及器官的运动都会带来一定的摆位误差[4]。放射治疗时,实际放疗靶区与计划靶区之间的差异称为摆位误差。摆位误差对放疗患者治疗剂量的准确性有一定影响,如果超出允许的误差范围,可能导致放疗靶区漏照,高剂量区移位到危及器官上,影响治疗效果,且会产生不良反应[5-6]。本研究利用IMRT治疗宫颈癌,在放疗前用千伏级锥形束CT(CBCT)进行扫描,然后与CT图像进行对比,对摆位误差进行分析,探讨了摆位误差对宫颈癌放疗靶区和危及器官剂量分布的影响。
1 资料与方法
1.1一般资料 选取2018年8月至2020年6月在本院就诊的宫颈癌患者84例纳入研究。纳入标准:病理确诊为宫颈鳞状细胞癌且适合进行放疗的患者;签署了知情同意书;住院前未进行过放疗者;年龄20~80岁;临床分期ⅡB~ⅢB期;无CT扫描禁忌证及碘伏醇过敏病史;生存质量卡氏评分≥80分。排除标准:有严重的精神疾病、认知障碍及思维障碍者;临床资料缺乏者;合并严重的内科疾病者;合并其他部位恶性肿瘤者。纳入研究者年龄25~78岁,平均(56.17±4.28)岁;体质量指数(BMI)为(22.47±1.37)kg/m2;病理组织学检查:高分化49例,中分化21例,低分化14例;淋巴结转移39例。医院伦理委员会批准了此次研究。
1.2方法
1.2.1放疗设备 GE公司的64层螺旋CT与1.5T磁共振成像(MR),华光普泰公司的碳纤维体架及热塑成型体膜,瓦里安公司的Varian iX-5907直线加速器和机载CBCT,德国BEBIG公司的三维治疗计划系统。江苏恒瑞医药股份有限公司的碘伏醇注射液(100 mL/瓶),旭东海普公司的复方泛影葡胺注射液(20 mL∶15.2 g)。
1.2.2CT图像的采集 CT扫描前40 min嘱患者排空膀胱、直肠,口服含复方泛影葡胺20 mL的温水800 mL。患者取仰卧位,双手交叉置额头,采用热塑成型体膜固定体位,然后进行CT扫描定位,将扫描所得图像传至放疗系统。
1.2.3靶区与危及器官勾画 所有患者均由同一医师勾画靶区与危及器官,并由有丰富经验的副主任医师确认。肿瘤区(GTV)为原发肿瘤,临床靶区(CTV)包括GTV、亚临床病灶及肿瘤可能侵犯的范围和区域淋巴结。内靶区(ITV)为CTV外边界运动的范围。计划靶区(PTV)为包括CTV、ITV和其他因素引起的扩大照射的组织范围。危及器官为可能被放射野包括的正常组织或器官。
1.2.4放疗计划 计划要求:PTV和GTV内最小剂量不能低于治疗区剂量;100%的处方剂量至少包绕95%的靶区体积。危及器官的剂量体积限定:小肠V40<50%,脊髓<40 Gy,结肠V40<50%,膀胱V40<50%,直肠V40<50%,股骨V50≤5%;治疗计划放射剂量均匀度为93%~107%。
1.2.5计划评估 利用剂量体积直方图(DVH)评估靶区和危及器官的体积与受照射剂量情况,评估靶区的物理适形度与剂量适形度,评估危及器官受照剂量的范围。
1.2.6CBCT图像的获取与配准 CBCT参数:M20准直器,F1滤线器,120 kV、80 mA,扫描角度为360°。扫描完成后使用中等分辨率重建,配准得到患者的X(左右)、Y(头脚)、Z(腹背)三维平移误差,然后进行实时误差校正。
1.2.7生成模拟计划与评估 将摆位误差反向输入计划系统,在原计划的CT图像上进行靶区和危及器官照射剂量的重新计算。对比原计划与模拟计划的DVH,记录危及器官的受照射体积、PTV的照射剂量等参数。
1.3观察指标 (1)记录与比较所有患者3个方向首次摆位误差与纠正后摆位误差。(2)记录首次摆位误差与纠正后摆位误差对危及器官的影响,包括V100、直肠V40、膀胱V40、小肠V40等,V100为100%的处方剂量,各组织器官接受≥40 Gy的体积占总体积的百分比用V40表示。(3)记录首次摆位误差与纠正后摆位误差对PTV1、PTV2、PTV3照射剂量的影响。

2 结 果
2.1摆位误差纠正前后3个方向摆位误差的比较 摆位误差纠正后与纠正前比较,宫颈癌放疗患者在X、Y、Z轴方向的摆位误差差异均有统计学意义(P<0.05),见表1。
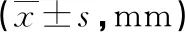
表1 摆位误差纠正前后宫颈癌放疗患者摆位误差的比较
2.2摆位误差纠正前后危及器官剂量分布的比较 摆位误差纠正后,V100、直肠V40、膀胱V40均低于摆位误差纠正前(P<0.05),小肠V40、结肠V40与摆位误差纠正前比较,差异无统计学意义(P>0.05),见表2。

表2 宫颈癌放疗患者摆位误差纠正前后危及器官剂量分布的比较
2.3摆位误差纠正前后PTV照射剂量的比较 宫颈癌放疗患者摆位误差纠正后的PTV1、PTV2、PTV3均低于摆位误差纠正前(P<0.05),见表3。
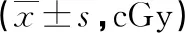
表3 宫颈癌放疗患者摆位误差纠正前后PTV照射剂量的比较
3 讨 论
宫颈癌的发病率一直位居所有妇科肿瘤的前列,我国每年约有15万新发宫颈癌患者。宫颈癌患者早期无明显症状,随着疾病的发展,可出现阴道流血和(或)下体恶臭味,可有淋巴结转移、血行转移等[7]。放疗为中晚期宫颈癌患者的主要治疗方法,随着影像学技术与放射物理学技术的飞速发展,已经逐步实现精确三维放疗。宫颈癌放疗的要求为提高肿瘤的局部控制率,显著降低危及器官的受照射剂量,降低放射治疗相关并发症的发生率,促进患者康复[8]。但是放疗基本都是以静态CT图像为基础,治疗中不同技术人员摆位标准的差异、患者肠管蠕动、肿瘤位移、膀胱充盈程度、患者体质量减轻等都会引起靶区的移位和变形,从而造成摆位误差[9]。本研究显示,摆位误差纠正后在X、Y、Z轴方向的摆位误差少于摆位误差纠正前。原因分析:在Y轴方向的误差最大,可能与宫颈癌患者多为腹型肥胖妇女、皮肤牵拉改变较大等有关;不同技术员摆位的个体差异也会引起该项误差。在放疗过程中通过CBCT影像系统实时校正摆位误差,可实现精确放疗[10-11]。
IMRT在治疗过程中利用加载的CBCT系统实时采集图像信息,考虑了各种误差导致的照射野对治疗靶区的偏离问题,可纠正存在的误差[12]。特别是在每次放疗前,CBCT扫描得到靶区周围组织器官的三维图像,与原计划图像配准,可计算得出摆位误差,并实时校正,从而降低危及器官的受照射体积及剂量[13]。本研究显示,摆位误差纠正后V100、直肠V40、膀胱V40值低于摆位误差纠正前,小肠V40、结肠V40纠正前后比较无明显差异,表明误差的校正降低了膀胱和直肠的受照射剂量,能保证患者安全、有效地进行放射治疗。
IMRT用于宫颈癌的治疗具有良好的剂量分布特性,在保证靶区剂量的同时可限制正常组织的受照射量[14]。本研究显示摆位误差纠正后PTV1、PTV2、PTV3的照射剂量都低于摆位误差纠正前。原因分析:CBCT能够获得患者每次放疗的图像和进行在线校正,有助于分辨盆腔器官结构和软组织器官的边界,从而保证放疗精确性[15]。本研究也存在一定的不足,PTV边界的确定还需要进行详细探讨,同时在放疗中保证危及器官的状态恒定也比较重要。
综上所述,宫颈癌患者放疗时在X、Y、Z轴方向均存在一定的摆位误差,纠正摆位误差有助于降低危及器官剂量分布与减少PTV照射剂量。

